南宁市2019年高三化学下半年高考模拟同步练习
| 1. | 详细信息 |
|
化学无处不在,下列说法错误的是( ) A. 《元丰行示德逢》里“雷蟠电掣云滔滔,夜半载雨输亭皋”涉及化学反应N2+O2 B. 根据化学学科核心素养之一(证据推理与模型认知)可推知Cr(OH)3胶体也可吸附悬浮杂质 C. 纳米铁粉可以高效地去除污水中的重金属离子是因为其具有较强的还原性 D. 二氧化硅广泛用于制作光导纤维,光导纤维遇强酸强碱都会“断路” |
|
| 2. | 详细信息 |
|
设阿伏加德罗常数的值为NA,下列叙述正确的是 A. 等质量的N2O和CO2中,分子数均为NA B. 3.1g 31P与3.2g 32S中,中子数均为1.6NA C. 0.4 mol BaCl2与0.4 mol Na2O2中,阴离子数均为0.8NA D. 1mol正丁烷与1mol异丁烷中,化学键数均为14NA |
|
| 3. | 详细信息 |
某药物中间体的合成路线如下。下列说法正确的是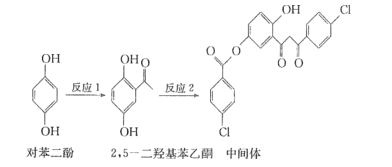 A. 1mol对苯二酚与足量H2加成,消耗3molH2 B. 2, 5-二羟基苯乙酮不能使酸性KMnO4溶液褪色 C. 2, 5-二羟基苯乙酮中所有碳原子一定处于同一平面 D. 中间体分子中含有的官能团之一是碳碳双键 |
|
| 4. | 详细信息 | |||||||||||||||
下列试验方案的设计能达到实验目的的是
|
||||||||||||||||
| 5. | 详细信息 | ||||||||
X、Y、Z、W四种短周期元素在元素周表中的相对位置如表所示,Y是地壳中含量最高的元素。下列说法中错误的是( )
|
|||||||||
| 6. | 详细信息 |
热激活电池可用作火箭、导弾的工作电源。一种热激活电池的基本结钩如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电极处生成Pb,下列有关说法正确的是( ) 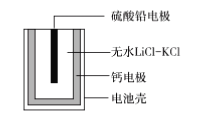 A. 输出电能时,外电路中的电子由硫酸铅电极流向钙电极 B. 放电时电解质LiCl-KCl中的Li+向钙电极区迁移 C. 每转0.2mol电子,论上消耗42.5gLiCl D. 电池总反应为Ca+PbSO4+2LiCl=Pb+Li2SO4+CaCl2 |
|
| 7. | 详细信息 |
常温下, HNO2的电离平衡常数为K=4.6×10-4(已知 A. X=20 B. a、b、c、d四点对应的溶液中水的电离程度逐渐减小 C. a点的溶液中c(H+)=2.14×10-3mol·L-1 D. b点溶液中微粒浓度的大小关系为c(HNO2)>c(Na+)>(NO2) |
|
| 8. | 详细信息 | ||||||||||||
|
甲酸钙广泛用于食品、化工、石油等工业生产上,在300~400℃左右分解。 Ⅰ.实验室制取甲酸钙的方法之一是Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2。实验室制取时,将工业氢氧化钙(含铜离子等杂质)和甲醛依次加入质量分数为30%~70%的过氧化氢溶液中(投料时工业氢氧化钙、甲醛、过氧化氢的物质的量之比为1: 2: 1.2),最终可得到质量分数大于98%且重金属含量极低的优质产品。 (1)铜离子对该实验的影响是________________________________________。 (2)甲酸钙的分解产物为_______________________________。 (3)制备时,在混合溶液中除了要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液。加硫化钠的目的之一是除去重金属离子,其反应的离子方程式为_________________________________。 (4)实验时需强力搅拌45min,其目的是__________________________________。 (5)取ag优质产品[杂质只有Ca(OH)2]溶于水,加入bgNa2CO3(过量),得到cg沉淀,则产品中甲酸钙的百分含量为__________________(列出计算式即可)。 Ⅱ.某研究性学习小组以工业碳酸钙(主要成分为CaCO3,杂质为Al2O3、FeCO3)为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合图中几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算),现提供的试剂有: a.甲酸钠 b.5mol·L-1的硝酸 c.澄清石灰水  请补充完整由碳酸钙制备甲酸钙的实验步骤: 步骤1:称取13.6g甲酸钠溶于约20mL水中,配成溶液待用,并称取研细的碳酸钙样品10g待用。
|
|||||||||||||
| 9. | 详细信息 |
工业上利用氧化铝基废催化剂(主要成分为Al2O3,还含有少量Pd)回收Al2(SO4)3及Pd的流程如下:  (1)Al2(SO4)3溶液蒸干灼烧后所得物质的化学名称是___________。 (2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为___________。 水浸与中和步骤得到溶液的操作方法是___________。 (3)浸液Y中含Pd元素的溶质是___________ (填化学式)。 (4)“热还原”中每生成1molPd生成的气体的物质的量为___________ (已知热还原得到的固体只有Pd)。 (5)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)==2PdHx(s),其中x的最大值为0.8。已知: Pd的密度为12g·cm-3, 则10.6cm3Pd能储存标准状况下H2的最大体积为___________L。 (6)铝的阳极氧化法是将铝作为阳极,置于硫酸等电解液中,加入α-羟基丙酸、丙三醇后进行电解,可观察到铝的表面会形成一层致密的氧化膜。 ①写出电解时阳极的电极反应式:______________________ 。 ②电解过程中α-羟基丙酸、丙三醇的作用可能是______________________。 |
|
| 10. | 详细信息 | ||||||||||||||||||||||||||||||||
|
研究化学反应时,既要考虑物质变化与能量变化,又要关注反应的快慢与限度。回答下列问题: (1)NH3还原NO是重要的烟气脱硝技术,其反应过程与能量关系如下图所示。  ①上图中因为改变了反应条件,反应的活化能b___________(填“>”“<”或“=”)a。 ②脱硝反应的热化学方程式可表示为反应物→生成物△H=___________(用E1, E2的代数式表示) ③研究发现,一定条件下的脱硝反应过程可能如图所示,根据氧化还原反应中物质的作用,NO为剂____,脱硝总反应的化学方程式为:___________。  (2)一定温度下,将不同物质的量的H2O(g)和CO分别通入容积为1L的恒容密闭容器中,进行反应H2O(g)+CO(g)=CO2(g)+H2(g),得到如表所示的三组数据:
|
|||||||||||||||||||||||||||||||||
| 11. | 详细信息 |
|
铁及其化合物在生产生活及科学研究方面应用非常广泛。回答下列问题: (1)Fe原子的核外电子排布式为_____。 (2)含锰奥氏体钢是一种特殊的铁合金,主要由Fe和Mn组成,其中锰能增加钢铁的强度和硬度,提高耐冲击性能和耐磨性能。第一电离能I1(Fe)____(填“大于”或“小于”)I1(Mn),原因是___。 (3)FeF3具有较高的熔点(熔点高于1000℃),其化学键类型是__,FeBr3的式量大于FeF3,但其熔点只有200℃,原因是____。 (4)FeCl3可与KSCN、苯酚溶液发生显色反应。 ①SCN-的三种元素中电负性最大的是____。 ②苯酚( (5)Fe(CO)3与NH3在一定条件下可合成一种具有磁性的氮化铁。该磁性氮化铁的晶胞结构如图所示。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,该磁性氮化铁的密度为____(列出计算式)g·cm-3。 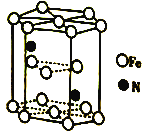 |
|
| 12. | 详细信息 |
盐酸吡酮洛芬(H)是一种消炎镇痛药,其合成路线如下: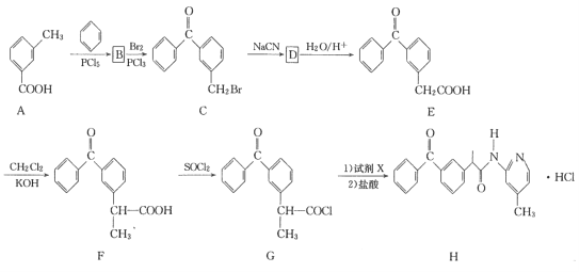 已知R-CN 回答下列问题: (1)A的化学名称是____。 (2)由B生成C的化学方程式为________。 (3)D的结构简式为_______。 (4)F中官能团的名称为_____。 (5)G生成H(试剂X的分子式为C6H8N2)的反应类型是____。 (6)E的分子式为____。X与E互为同分异构体,X的分子中含两个苯环,X水解后产物之一既能发生银镜反应又能与FeCl3溶液发生显色反应,X的核磁共振氢谱显示有6种不同化学环境的氢,峰面积之比为1:2:2:2:2:3。写出符合条件的X的结构简式:____。 |
|



