2017-2018年高二12月月考化学考试题(宁夏育才中学勤行校区)
| 1. | 详细信息 |
|
化学与生产、生活、科技等密切相关,下列说法不正确的是 A. 加大清洁能源的开发利用,提高资源的利用率 B. 研发使用高效催化剂,可提高反应中原料的转化率 C. 用K2FeO4取代Cl2处理饮用水,可杀菌消毒,还能沉降水中的悬浮物 D. 用沼气、太阳能,风能等新型能源代替化石燃料 |
|
| 2. | 详细信息 |
|
下列指定化学用语正确的是( ) A. NaHCO3 水解的离子方程式:HCO3-+H2O = CO32-+H3O+ B. Ba(OH)2的电离方程式:Ba(OH)2 C. NaHSO4在水中的电离方程式:NaHSO4 = Na++H++SO42- D. Na2S水解的离子方程式:S2-+2H2O = H2S+2OH- |
|
| 3. | 详细信息 |
|
下列既是放热反应,又是离子反应的是 A. 碳酸钙高温时的分解反应 B. 氢氧化钠和稀硫酸中和 C. 氯化铵与氢氧化钡晶体的反应 D. 铝和氧化铁在高温下的反应 |
|
| 4. | 详细信息 |
|
常温下,下列各组离子一定能在指定溶液中大量共存的是 A. Kw/c(OH-)=10-l2 mol?L-1 的溶液中: Na+、K+、SO32-、Cl- B. 使甲基橙变黄的溶液中:NH4+、Cu2+、NO3- 、SO42- C. 由水电离出的c(H+)=1.0×10-l3 mol?L-1 的溶液中:Na+、CO32-、K+、Cl- D. 使KSCN 显红色的溶液中:NH4+、K+、Cl-、AlO2- |
|
| 5. | 详细信息 |
|
下列有关AgCl沉淀的溶解平衡的说法中正确的是( ) A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等 B.AgCl难溶于水,溶液中没有Ag+和Cl- C.升高温度,AgCl沉淀的溶解度减小 D.在有AgCl沉淀生成的溶液中加入NaCl固体,AgCl沉淀溶解的量不变 |
|
| 6. | 详细信息 |
|
以下反应均可生成O2,下列有关说法正确的是 ①二氧化碳分解生成氧气:2CO2(g)=2 CO(g)+O2(g)? ΔH1=+566 kJ?mol-1 ② 过氧化氢分解生成氧气:2H2O2(l)===2H2O(l)+O2(g);ΔH2=-196.4 kJ?mol-1 ③ 光照条件下,催化分解水蒸气生成氧气:2H2O(g)===2H2(g)+O2(g);ΔH3=+483.6 kJ?mol-1 A. 反应①为放热反应 B. 反应②使用催化剂,能降低该反应的活化能 但不能改变ΔH2 C. 反应③将化学能转化为光能 D. 反应CO(g)+H2O(g)===CO2(g)+H2(g);ΔH=-82.4 kJ?mol-1 |
|
| 7. | 详细信息 |
“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O = 2Mg (OH)2 。下列关于该电池的说法错误的是( ) A. 食盐水作为电解质溶液 B. 电池工作时镁片作为正极逐渐被消耗 C. 电池工作时实现了化学能向电能的转化 D. 活性炭电极上的反应为O2+2H2O + 4e- = 4OH - |
|
| 8. | 详细信息 |
|
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42× 10-11。下列说法正确的是( ) A. 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 B. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 C. 25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01mol/L NH4Cl溶液中的Ksp小 D. 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后, Mg(OH)2不可能转化为MgF2 |
|
| 9. | 详细信息 |
|
一定温度下,在密闭容器中发生反应:2HI(g)= H2(g)+I2(g),能说明该反应达到平衡状态的标志是 A. 单位时间内消耗1molH2,同时生成2mol HI B. 每断裂2molH-I键,同时有1mol H?H键断裂 C. 容器中压强不再变化 D. 容器中混合气体的密度不再变化 |
|
| 10. | 详细信息 |
|
下列事实不能用勒夏特列原理解释的是 A. 对于平衡体系:2NO2(g) B. 某研究性学习小组为研究酸雨的成分,收集一部分酸雨测其pH,结果一天后再测,发现雨水的pH 减小 C. 光照新制氯水时,溶液的pH 逐渐减小 D. 合成氨工厂通常采用20MPa~50MPa 的高压,以提高原料的利用率 |
|
| 11. | 详细信息 |
下图所示原电池的总反应为Cu(s)+2Ag+(aq) A. 电子从银电极经导线流向铜电极 B. 工作一段时间后,右烧杯中溶液的pH变小 C. 电池工作时,Cu2+向铜电极移动 D. 将AgNO3溶液更换为Fe(NO3)3溶液,电流计指针反向偏转 |
|
| 12. | 详细信息 |
|
研究发现,腐蚀严重的青钢器表面大都存在CuC1。关于CuCl 在青铜器腐蚀过程中的催化作用,下列叙述不正确的是 A. 降低了反应的活化能 B. 增大了反应的速率 C. 没有改变化学反应过程 D. 没有改变反应的平衡常数 |
|
| 13. | 详细信息 |
|
不久前,美国一个海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600℃-700℃,所用燃料为H2,电解质为熔融的K2CO3,已知该电池的总反应为2H2+O2=2H2O,负极反应为H2+CO32--2e- =H2O+CO2,则下列推断正确的是 A.正极反应为:O2+2H2O+4e- =4OH- B.放电时CO32-向负极移动。 C.电池供应1mol水蒸气,转移电子4mol D.放电时正极发生氧化反应 |
|
| 14. | 详细信息 |
|
下列说法正确的是 A. S(g) +O2(g)=SO2 (g)可用该反应的ΔH表示燃烧热 B. 测定中和热的实验中,一套完整的实验数据至少需要测量3次 C. 通过直接蒸发MgCl2溶液的方法获取无水氯化镁固体 D. 除去CuC12溶液中的Fe3+离子,选用氢氧化钠溶液作沉淀剂 |
|
| 15. | 详细信息 |
|
已知醋酸在水溶液中建立如下电离平衡: CH3COOH A. 通氯化氢气体 B. 加入少量醋酸钾固体 C. 加入少量氢氧化钠固体 D. 通入少量冰醋酸 |
|
| 16. | 详细信息 |
|
下列说法错误的是 A. 常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 B. 常温下,将pH=3的硫酸和pH=11的氨水等体积混合后,所得溶液的pH>7 C. 常温下,将醋酸溶液与NaOH 溶液等体积混合后,若所得溶液的pH=7,则原溶液中c(CH3COOH)>c(NaOH) D. 常温下,pH=1的NaHSO4溶液:c(H+)=2c(SO42-)+c(OH-) |
|
| 17. | 详细信息 |
常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。下列说法不正确的是 A. 图中表示醋酸溶液中pH变化曲线的是B B. 设盐酸和醋酸中加入的Zn质量分别为m1、m2,则m1<m2 C. pH=2时盐酸和醋酸的物质的量前者小 D. pH=4时两溶液c(Zn2+)相等 |
|
| 18. | 详细信息 |
科研人员设想用如图所示装置生产硫酸,下列说法正确的是(? ) A. a为正极,b为负极 B. 生产过程中a电极质量减轻 C. 电子从b极向a极移动 D. 负极反应式为:SO2+2H2O?2e?=SO42?+4H+ |
|
| 19. | 详细信息 |
|
下列说法正确的是 A. 铅蓄电池工作时,电解质溶液H2SO4的浓度不变 B. 加水稀释0.1 mol?L-1CH3COOH溶液时,CH3COOH的电离程度增大,pH减小 C. 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 D. 标准状况下,2.24 LCCl4含有的共价键数为0.4×6.02×1023个 |
|
| 20. | 详细信息 |
|
已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2?L-2,Ksp=1.1×10-10 mol2?L-2,则BaSO4可做钡餐,BaCO3不能作钡餐的主要理由是( ) A. BaSO4的溶度积常数比BaCO3的小 B. SO C. BaSO4的密度大 D. 胃酸能与CO |
|
| 21. | 详细信息 |
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )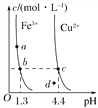 A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2] B. 加适量NH4Cl固体可使溶液由a点变到b点 C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 D. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
|
| 22. | 详细信息 |
|
完成下列各问题 (1)泡沫灭火器中的药品为NaHCO3和Al2(SO4)3,其反应的离子方程式为:________; (2)碳酸氢钠溶液中的粒子物质的量浓度有多种关系,请分别写出①电荷守恒__________________;②物料守恒______________________;③质子守恒______________________________;④下列粒子浓度由大到小的顺序为c(Na+)、c(HCO3-)、c(CO32-),c(H2CO3)、c(OH-)______。 |
|
| 23. | 详细信息 |
|
大气中可吸入颗粒物PM2.5主要来源为燃煤、机动车尾气等。 (1)若取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42-、NO3-、Cl-,该溶液呈酸性,其原因用离子方程式解释是:____________。 (2)“洗涤”燃煤烟气可减轻PM2.5中SO2的危害,下列可适用于吸收SO2的试剂有(____) ?a.CaCl2溶液 b.氨水 c.Ca(OH)2悬浊液 d.浓H2SO4 (3)煤烟气中的氮氧化物可用CH4催化还原成无害物质。若常温下,1molNO2与CH4反应,放出477.5kJ热量,该反应的热化学方程式是 __________ 。 (4)安装汽车尾气催化转化器也可减轻PM2.5的危害,其反应是:2NO(g) + 2CO(g) |
|
| 24. | 详细信息 |
|
化学反应原理对生产有重大的指导意义。回答下列问题: (1)有两个温度相同的密闭容器A和B,容器A保持容积不变,容器B保持压强不变,起始时向容积相等的A、B中分别充入等量的C(碳)和H2O(g),发生反应:C(s)+H2O(g) ①H2O的体积分数:V(A)%_____V(B)%。(填“>”、“<” “=”) ②达到平衡后,在两容器中分别通入等量的氦气,则A中H2O的转化率_______(填“ 增大” “减小”、“不变”);B中化学平衡_________移动(填“不”“向正反应方向”“向逆反应方向”)。 (2)某温度下,测得0.01mol?L-1 NaOH溶液的pH=10,则在该温度下Kw=______;在此温度下,将pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得溶液为中性,则a:b=_______(假设混合时体积不变)。 |
|
| 25. | 详细信息 |
以硅孔雀石(主要成分为 CuCO3?Cu(OH)2、CuSiO3?2H2O,含 SiO2、FeCO3、 Fe2O3等杂质)为原料制备CuCl2的工艺流程如下: 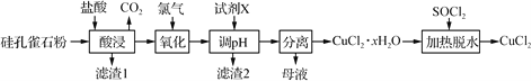 (1)为提高“酸浸”时铜元素的浸出率,可以采取的措施有: ①适当加快搅拌速率;②______________。(任答一点即可) (2)“氧化”时发生反应的离子方程式为__________。 (3)“滤渣1”的主要成分为SiO2和H2SiO3等,“滤渣2”的主要成分为______(填化学式);试剂X可选择_____(填字母)。 a. Cu b. NaOH c. Cu(OH)2 d.氨水 (4)“调pH”时,pH不能过高,其原因是_________________________。 |
|
| 26. | 详细信息 |
|
(1)在25 ℃下,向浓度均为0.1 mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为___________。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。 (2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, (3)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全_______________________。(提示:当某离子浓度小于10-5 mol?L-1时可以认为该离子沉淀完全) |
|
| 27. | 详细信息 |
依据反应:2Ag+(aq)+Cu(s)=Cu2+ (aq)+2Ag(s)设计的原电池如下图所示。 请回答下列问题: (1)电极X的材料是___________,电解质溶液Y是___________; (2)银电极为电池的___________极,发生的电极反应为___________;X电极上发生的电极反应为_________________________。 |
|
最近更新



