2020河南高一上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
化学与生活、社会发展息息相关,下列说法不正确的是 ( ) A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
|
|
| 2. | 详细信息 |
|
下列关于物质分类及胶体性质描述正确的是 ( ) A.明矾、空气、硫酸铜均为纯净物 B.熟石灰、烧碱、纯碱都是碱 C.纳米材料粒子直径一般从几纳米到几十纳米,因此纳米材料属于胶体 D.“血液透析”和“静电除尘”分别利用了胶体的不同性质
|
|
| 3. | 详细信息 |
|
下列物质的分类组合不正确的有 ( ) ①海水、空气、胆矾、盐酸均为混合物; A. ①③④⑥ B. ①③④ C. ①②③⑤⑥ D. ⑤⑥
|
|
| 4. | 详细信息 |
|
下列叙述正确的是 ( ) A.SO3的水溶液能导电,所以SO3是电解质 B.氯化钠晶体不导电,是因为氯化钠中没有离子 C.氨水能导电,所以氨水是电解质 D.液态氯化氢不能导电,但是氯化氢是电解质
|
|
| 5. | 详细信息 | ||||
|
下列反应的离子方程式正确的是 ( )
|
|||||
| 6. | 详细信息 |
|
配制溶液时,由于操作不当会引起误差,下列情况会使所配溶液浓度偏低的是 ( ) ①用天平称量时所用砝码生锈; ②用量筒量取所需浓溶液时,仰视刻度; ③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤; ④转移溶液前容量瓶内有少量蒸馏水 ⑤定容时,俯视容量瓶的刻度线; ⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线 A.②⑤ B.②③⑥ C.①⑤⑥ D.③⑥
|
|
| 7. | 详细信息 |
|
下列说法正确的是 ( ) A.现需480 mL 0. 1 mol/L硫酸铜溶液,则需要称量7. 68 g 硫酸铜固体 B.100 g物质的量浓度为18. 4 mol/L的硫酸,用水稀释到 物质的量浓度为9. 2 mol/L,需要水的质量为100 g C.将10 g CuSO4溶解在90 g水中,配制质量分数为10% 的CuSO4溶液 D.使用量筒量取一定体积的浓硫酸配制一定物质的量浓度 的稀硫酸,将浓硫酸转移至烧杯后须用蒸馏水洗涤量筒, 并将洗涤液一并转移至烧杯
|
|
| 8. | 详细信息 |
|
下列各项操作错误的是 ( ) A.用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液
|
|
| 9. | 详细信息 |
|
以下关于化学实验中“先与后”的说法中正确的是 ( ) ①加热试管时,先均匀加热,后局部加热 ②用排水法收集气体后,先移出导管后撤酒精灯 ③制取物质时,先检查装置气密性后装药品 ④使用容量瓶、分液漏斗前,先检査是否漏液,后洗涤干净 ⑤做H2还原CuO实验时,先通H2后加热CuO;反应完毕后,先撤酒精灯待试管冷却后停止通H2 ⑥蒸馏时加热一段吋间,发现忘记加沸石,应先迅速补加沸石后继续加热 ⑦碱液流到桌子上,先加稀醋酸溶液中和,后水洗 ⑧点燃可燃性气体如H2、CH4、C2H4等时,先检验气体纯度,后点燃 ⑨蒸馏时,先点燃酒精灯,后通冷凝水 ⑩分液时,先打开分液漏斗颈上的玻璃塞,后打开分液漏斗下面的活塞 A.①②③④⑤⑥⑦⑧⑩ B.①②③④⑤⑥⑧ C.①②③④⑤⑦⑧⑩ D.全部
|
|
| 10. | 详细信息 |
|
在11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4的反应中,1mol Cu2+能氧化的P原子的物质的量 ( ) A.0.4mol B.2.2mol C.0.2mol D.0.3mol
|
|
| 11. | 详细信息 |
|
两份质量相同的CH4和NH3比较,下列结论错误的是 ( ) A.分子个数比为17:16 B.同温同压下两种气体的体积之比是17:16
|
|
| 12. | 详细信息 |
|
.已知一定条件下,CO2和CO的混合气体对氢气的相对密度是20,则CO2和CO的质量比为 ( ) A.1:3 B.33:7 C.3:1 D.7:33
|
|
| 13. | 详细信息 |
|
下列叙述正确的是 ( ) A.标准状况下,22.4L CO所含原子的物质的量为1mol
|
|
| 14. | 详细信息 |
|
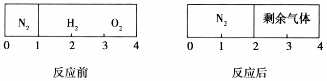
如图所示,一密闭气缸被一不漏气但可滑动的活塞隔开分成两部分。反应前,左边充有N2,右边充有H2和O2的混合气体;20℃ 时,将右边混合气体点燃,反应冷却到20℃,若活塞最终静置于气缸的中央(液体体积忽略不计)。则反应前容器中N2和O2的物质的量之比可能为 ( )
A.3:5 B.5:4 C.2:7 D.2:5
|
|
| 15. | 详细信息 |
|
根据反应:①2Fe3++2I-=2Fe2++I2,②Br2+2Fe2+=2Fe3++2Br-,③ Br2+2I-=I2+2Br-, 判断离子的还原性由强到弱的顺序正确的是 ( ) A.Br-、Fe2+、I- B.I-、Fe2+、Br-
|
|
| 16. | 详细信息 |
|
某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧,发生2Mg+CO2 A.Mg元素化合价由0价升高到+2价,所以MgO是还原产物 B.由此反应可以判断氧化性:CO2>MgO,还原性:Mg>C C.CO2作氧化剂,表现氧化性,发生氧化反应 D.Mg原子失去的电子数目等于氧原子得到的电子数目
|
|
| 17. | 详细信息 |
|
.SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应: ①SO2+2Fe3++2H2O ②Cr2O72-+6Fe2++14H+ 下列有关说法不正确的是 ( ) A.SO2发生氧化反应
|
|
| 18. | 详细信息 |
|
将11.5g钠、9g铝、28g铁分别投入200mL 1mol/L的盐酸中,下列说法正确的是( ) A.钠与盐酸反应最剧烈,产生的气体最多
|
|
| 19. | 详细信息 |
|
室温下,某无色透明溶液能与铝反应放出H2,一定能大量共存的离子组是( ) A. Cl-、 C.
|
|
| 20. | 详细信息 | ||||||||||||||||||||
|
下列实验操作,现象和解释或结论都正确的 ( )
|
|||||||||||||||||||||
| 21. | 详细信息 |
|
某化学实验小组需要1
|
|
| 22. | 详细信息 |
|
实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用的时间来判断空气中的含汞量,其反应为4CuI+Hg (已知:Hg化合价为+2价) (1).上述反应产物 Cu2HgI4中, Cu元素显__________价。
|
|