2018广东高二上学期人教版高中化学期中考试
| 1. | 详细信息 |
|
设NA代表阿伏加德罗常数,下列说法中正确的是( ) A.1mol/L的碳酸钠溶液中含有Na+的数目为2NA B.标准状况下,22.4L CH4分子中含质子总数为10NA C.1 mol Na2O2中含有阴离子的数目为2NA D.1 mol Na被完全氧化生成Na2O2,失去2NA个电子
|
|
| 2. | 详细信息 |
|
下列各组离子一定能大量共存的是( ) A.在强碱溶液中:Na+、K+、AlO2-、CO32- B.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- C.在能使酚酞试剂变红的溶液中:NH4+、Al3+、SO42-、NO3- D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
|
|
| 3. | 详细信息 |
|
下列说法错误的是( )B A.钢是用途最广的合金 B.光导纤维和玻璃的主要成分是硅酸盐 C.常温条件下可以用铁质容器盛放浓硫酸 D.苯不能使高锰酸钾溶液褪色
|
|
| 4. | 详细信息 | ||
|
下列方程式书写正确的是( ) A.往铝盐溶液中加入过量的氨水制备氢氧化铝沉淀: Al3++3NH3·H2O = Al(OH)3↓+3NH4+ B.Cu和浓硝酸反应:3Cu+8HNO3(浓)=3Cu(NO3)2+2NO↑+4H2O 点燃 D.过量的铁在氯气中燃烧:Fe + Cl2=== FeCl2
|
|||
| 5. | 详细信息 |
|
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( ) A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) B.Y分别与Z、W形成的化合物中化学键类型相同 C.X的最高价氧化物对应水化物的酸性比W的弱 D.Y的气态简单氢化物的热稳定性比W的强
|
|
| 6. | 详细信息 |
|
人造地球卫星用到的一种高能电池—银锌蓄电池,其电池的电极反应式为: 2Zn+2OH--2e-= 2ZnO + H2↑ ,Ag2O+H2O+2e-=2Ag+2OH-,据此判断氧化银是( ) A.负极,并被氧化 B.负极,并被还原 C.正极,并被氧化 D.正极,并被还原
|
|
| 7. | 详细信息 |
|
下列关于反应能量的说法正确的是( ) A.Zn(s) + CuSO4(aq) = ZnSO4(aq) + Cu(s),ΔH =-216 kJ•mol-1,则反应物的总能量大于生成物的总能量 B.若一定条件下,A = B,ΔH<0,说明A物质比B物质稳定 C.101 kPa时,2H2(g) + O2(g) = 2H2O (l),ΔH=-571.6 kJ•mol-1,则H2的燃烧热为 571.6 kJ•mol-1 D.H+(aq) + OH-(aq) = H2O(l),ΔH=-57.3 kJ·mol-1,含1 mol NaOH的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量
|
|
| 8. | 详细信息 |
|
已知298 K时,合成氨反应N2(g)+3H2(g) ⇌ 2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失) ( ) A.一定等于92.0 kJ B.一定大于92.0 kJ C.一定小于92.0 kJ D.无法确定
|
|
| 9. | 详细信息 |
|
在2A(g)+B(g) ⇌ 3C(g)+4D(g)反应中,表示该反应速率最快的是( ) A.vA=0.5mol·L-1·s-1 B.vB=0.3mol·L-1·s-1 C.vC=0.8mol·L-1·s-1 D.vD=1.0mol·L-1·s-1
|
|
| 10. | 详细信息 |
|
一定温度下,在某密闭容器中发生反应:2HI(g) ⇌ H2(g)+I2(s) ΔH > 0,若0~15 s内c(HI)由0.1 mol•L-1降到0.07 mol•L-1,则下列说法正确的是 ( ) A.0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol•L-1·s-1 B.c(HI)由0.07 mol•L-1降到0.04 mol•L-1所需的反应时间为15 s C.升高温度正反应速率加快,逆反应速率减慢 D.减小反应体系的体积,化学反应速率加快
|
|
| 11. | 详细信息 |
|
在1 L定容的密闭容器中,可以证明可逆反应N2(g)+3H2(g)⇌ 2NH3(g)已达到平衡状态的是( ) A.各物质的浓度之比c(N2)∶c(H2)∶c(NH3)=1∶3∶2 B.一个N≡N断裂的同时,有3个H—H生成 C.其他条件不变时,混合气体的密度不再改变 D.v正(N2)=2v逆(NH3)
|
|
| 12. | 详细信息 |
|
t ℃时,将一定量的混合气体在密闭容器中发生反应:aA(g)+bB(g) ⇌ cC(g)+dD(g),平衡后测得B气体的浓度为0.6 mol•L-1。恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4 mol·L-1。下列叙述中正确的是( ) A.重新达到平衡时,D的体积分数减小 B.a+b < c+d C.平衡向右移动 D.重新达到平衡时,A的转化率增大
|
|
| 13. | 详细信息 |
|
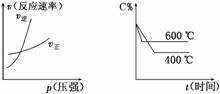
如图表示可逆反应mA(g)+nB(g) ⇌ pC(g)在不同温度(T)下生成物C的物质的量分数C%的变化情况和正、逆反应速率随压强的变化情况。下列关于该正反应热效应及方程式中A、B、C 的化学计量数的判断中,正确的是( )
A.放热反应,m+n<p B.放热反应,m+n>p C.吸热反应,m+n<p D.吸热反应,m+n>p
|
|
| 14. | 详细信息 |
|
一定温度下,反应N2(g)+O2(g) ⇌ 2NO(g)在密闭容器中进行,下列措施不改变化学反 应速率的是 ( ) A.缩小容积使压强增大 B.恒容,充入N2 C.恒容,充入He D.恒压,充入He
|
|
| 15. | 详细信息 |
|
Ⅰ.实验室常用二氧化锰与浓盐酸反应制氯气,写出其反应的化学方程式:____________ ________________________。该反应中氧化剂与还原剂的物质的量之比为_________。 Ⅱ.某研究性学习小组利用下列装置制备漂白粉。(已知2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O)
(1)装置②的作用是 。 (2)装置③中发生反应的化学方程式为____________________________,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是____________。 (3)装置④中的X试剂为______________溶液。
|
|
| 16. | 详细信息 | |||||||||
|
(1)为了检验和除去下表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内。
①检验的试剂:A.无水硫酸铜 B.酸性高锰酸钾溶液 C.水 D.氢氧化钠溶液 ②除杂试剂:a.无水硫酸铜 b.乙酸 c.新制的生石灰 d.溴水 除杂时,乙烯发生反应的化学方程式为________________________________________。
3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。按图连接好装置,用酒 精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管 中有明显现象时停止实验。在右试管中通常加入__________溶液。 分离右试管中所得乙酸乙酯的操作为(只填名称)__________。
|
||||||||||
| 17. | 详细信息 |
|
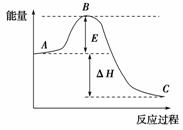
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。2SO2(g)+O2(g) ⇌ 2SO3(g)反应过程中的能量变化如下图所示。请回答下列问题:
(2)该反应通常用V2O5作催化剂,加V2O5会使图 中B点________(填“升高”还是“降低”), ΔH________(填“变大”、“变小”或“不变”), 理由是___________。 (3) 图中ΔH=________。
|
|
| 18. | 详细信息 |
|
(1)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1________ΔH2(填“>”“<”或“=”下同)。 (2)已知:2CO(g)+O2(g)=2CO2(g) △H1=-566 kJ·mol-1 2H2(g)+O2(g)=2H2O(g) △H2=-484 kJ·mol-1 CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802 kJ·mol-1 则CH4(g)+CO2(g) ⇌ 2CO(g)+2H2(g) 的ΔH=______________。 (3)已知CH3OH(l)的燃烧热ΔH=-726.5 kJ·mol-1,CH3OH(l)+1/2 O2(g)===CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a________726.5 (填“>”“<”或“=”)。 (4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:______________________________。 (5)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为____________。
|
|
| 19. | 详细信息 |
|
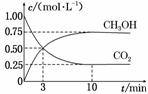
工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇。为探究反应原理,进行如下实验,在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,CO2的平均反应速率v(CO2)=________。 (2)平衡时氢气的转化率为________。 (3)平衡时CH3OH的物质的量分数为 。 (3)求此温度下该反应的平衡常数K=________。(保留两位小数) (4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是________。 A.将H2O(g)从体系中分离出去 B.充入He(g),使体系压强增大 C.升高温度 D.再充入1 mol CO2和3 mol H2
|
|
| 20. | 详细信息 | |||||||||||||||||||||||
|
Ⅰ.已知汽车尾气排放时容易发生以下反应: 2NO(g)+O2(g) ⇌ 2NO2(g),下列情况能说明上述反应已达平衡状态的是 (填编号)。 A.各物质的物质的量之比n (NO):n (O2):n (NO2)=2:1:2 B.在恒温恒容的容器中,容器中气体的压强保持不变 C.在恒温恒容的容器中,混合气体的密度保持不变 D.混合气体的颜色保持不变 E.在恒温恒压的容器中,NO的体积分数保持不变 Ⅱ.甲醇是重要的化工原料,又可作为燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学平衡常数如下所示:
请回答下列问题: (1) 据反应①与②可推导出K1、K2与K3之间的关系,则K3= (填具体数值)。 (2) 500 ℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度( mol·L-1)分别为1.0、0.1、0.3、0.15,则此时v(正) v(逆)(填“>”“=”或“<”)。 (3) 反应①是 (填“吸热”或“放热”)反应。
A.温度:T1>T2>T3 B.正反应速率: v(b)=v(d) C.平衡常数:K(a)>K(c),K(b)=K(d)
|
||||||||||||||||||||||||