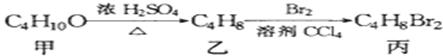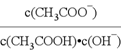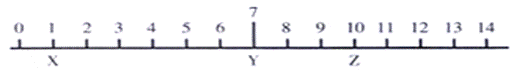2019жІіеҢ—й«ҳдәҢдёҠеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹдёӯиҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү A. зҹіжІ№ж¶ІеҢ–ж°”гҖҒжұҪжІ№гҖҒең°жІҹжІ№еҠ е·ҘеҲ¶жҲҗзҡ„з”ҹзү©жҹҙжІ№йғҪжҳҜзўіж°ўеҢ–еҗҲзү© B. й“ңзӣҗжңүжҜ’пјҢдё»иҰҒжҳҜеӣ дёәй“ңзҰ»еӯҗиғҪдёҺиӣӢзҷҪиҙЁеҸҚеә”пјҢдҪҝиӣӢзҷҪиҙЁеҸҳжҖ§ C. ејәз”өи§ЈиҙЁжә¶ж¶ІеҜјз”өиғҪеҠӣдёҖе®ҡжҜ”ејұз”өи§ЈиҙЁжә¶ж¶Іејә D. дёӯе’ҢзӯүдҪ“з§ҜгҖҒзӯүзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„зӣҗй…ёе’ҢйҶӢй…ёжә¶ж¶ІпјҢзӣҗй…ёжүҖйңҖж°ўж°§еҢ–й’ еӨҡдәҺйҶӢй…ё
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ұзҫҹеҹәдёҺдёӢеҲ—еҹәеӣўз»„жҲҗзҡ„еҢ–еҗҲзү©дёӯпјҢеұһдәҺйҶҮзұ»зҡ„жҳҜпјҲВ пјү A. вҖ”COOHВ В В B.
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯпјҢж—ўиғҪеӣ еҸ‘з”ҹеҢ–еӯҰеҸҚеә”дҪҝжәҙж°ҙиӨӘиүІпјҢеҸҲиғҪдҪҝй…ёжҖ§KMnO4жә¶ж¶ІиӨӘиүІзҡ„жҳҜпјҲВ В пјү в‘ SO2гҖҖВ в‘ЎCH3CH2CH===CH2гҖҖВ В В в‘ўC6H6гҖҖВ В В в‘ЈCH3CH3 A. в‘ в‘Ўв‘ўв‘ЈВ В В B. в‘Ўв‘ўВ В В C. в‘Ўв‘ЈВ В В D. в‘ в‘Ў
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
ж—ўеҸҜд»ҘйүҙеҲ«д№ҷзғ·е’Ңд№ҷзғҜпјҢеҸҲеҸҜд»ҘйҷӨеҺ»д№ҷзғ·дёӯж··жңүзҡ„д№ҷзғҜпјҢеҫ—еҲ°зәҜеҮҖд№ҷзғ·зҡ„ж–№жі•жҳҜпјҲВ В пјү A. дёҺи¶ійҮҸCl2еҸҚеә”В В В В В В В В В В B. йҖҡе…Ҙи¶ійҮҸжәҙж°ҙдёӯ C. еңЁдёҖе®ҡжқЎд»¶дёӢйҖҡе…Ҙж°ўж°” В В В D. йҖҡе…Ҙи¶ійҮҸй«ҳй”°й…ёй’ҫжә¶ж¶Ідёӯ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еҗҲзү©дёҷеҸҜз”ұеҰӮдёӢеҸҚеә”еҫ—еҲ°пјҡ
дёҷзҡ„з»“жһ„дёҚеҸҜиғҪжҳҜпјҲВ В пјү A. CH3CBr2CH2CH3В В В B. пјҲCH3пјү2CBrCH2Br C. C2H5CHBrCH2BrВ В В D. CH3пјҲCHBrпјү2CH3
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҺдёҷзғҜе…·жңүзӣёеҗҢзҡ„зўігҖҒж°ўзҷҫеҲҶеҗ«йҮҸпјҢдҪҶж—ўдёҚжҳҜеҗҢзі»зү©еҸҲдёҚжҳҜеҗҢеҲҶејӮжһ„дҪ“зҡ„жҳҜВ В пјҲВ пјү A. зҺҜдёҷзғ·В В В B. зҺҜдёҒзғ·В В В C. д№ҷзғҜВ В В D. дёҷзғ·
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ёе·ІзҹҘжө“еәҰзҡ„NaOHжә¶ж¶Іж»ҙе®ҡжңӘзҹҘжө“еәҰзҡ„зӣҗй…ёпјҢж»ҙе®ҡејҖе§Ӣж—¶д»°и§Ҷж»ҙе®ҡз®ЎпјҢж»ҙе®ҡеҲ°з»ҲзӮ№ж—¶е№іи§Ҷж»ҙе®ҡз®ЎиҜ»ж•°пјҢдҪҝи®Ўз®—еҮәзҡ„зӣҗй…ёжө“еәҰдёҺе®һйҷ…жө“еәҰжҜ”иҫғпјҲВ В В пјү A.еҒҸй«ҳВ В В В В В В В B.еҮҶзЎ®В В В В В В В В В В В В В В В В C.еҒҸдҪҺВ В В В В В В В D.еҸҜиғҪеҒҸй«ҳжҲ–еҒҸдҪҺ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖе®ҡиҙЁйҮҸзҡ„жҹҗжңүжңәзү©е’Ңи¶ійҮҸзҡ„йҮ‘еұһй’ еҸҚеә”пјҢеҸҜеҫ—еҲ°ж°”дҪ“VA еҚҮпјҢзӯүиҙЁйҮҸзҡ„иҜҘжңүжңәзү©еҰӮжһңи·ҹи¶ійҮҸзҡ„NaHCO3жә¶ж¶ІеҸҚеә”пјҢеҸҜеҫ—еҲ°ж°”дҪ“VB еҚҮпјҢиӢҘеҗҢжё©еҗҢеҺӢдёӢVA=VBпјҢдёӢеҲ—жңүжңәзү©з¬ҰеҗҲиҰҒжұӮзҡ„жҳҜпјҲВ пјү A. HO-(CH2)2-COOHВ В В B. HO-(CH2)2-CHO C. HOOC-COOHВ В В D. CH3COOH
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
гҖҠйҪҗж°‘иҰҒжңҜгҖӢдёӯи®°иҪҪдәҶдәҢеҚҒдёүз§ҚеҲ©з”Ёи°·зү©й…ҝеҲ¶йЈҹйҶӢзҡ„е·ҘиүәгҖӮе…¶з»ҸеҺҶзҡ„дёүдёӘдё»иҰҒеҸ‘й…өиҝҮзЁӢдёәпјҡзі–еҢ–вҶ’й…’еҢ–вҶ’дёҖйҶӢеҢ–гҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ(В В В В В ) A. зі–еҢ–иҝҮзЁӢжҳҜж·ҖзІүеңЁеҫ®з”ҹзү©дҪңз”ЁдёӢеҲҶи§ЈжҲҗи‘Ўиҗ„зі– B. дј з»ҹй…ҝйҶӢе·ҘиүәеқҮз»ҸеҺҶдәҶй…ҝй…’зҡ„иҝҮзЁӢ C. й…’еҢ–е’ҢйҶӢеҢ–йғҪиҰҒеңЁжңүж°§зҺҜеўғдёӯиҝӣиЎҢ D. еҸ‘й…өж¶Ізҡ„жё©еәҰжҺ§еҲ¶еҲ°вҖңе°Ҹжҡ–еҰӮдәәдҪ“вҖқзҡ„зЁӢеәҰжҳҜдёәдәҶжҸҗй«ҳй…¶зҡ„жҙ»жҖ§
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—ж №жҚ®еҸҚеә”еҺҹзҗҶи®ҫи®Ўзҡ„еә”з”ЁпјҢдёҚжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү A. CO32-+H2O B. Al3++3H2O C. TiCl4+ (x+2) H2OпјҲиҝҮйҮҸпјү D. SnCl2+H2O=Sn(OH)Cl+HClй…ҚеҲ¶ж°ҜеҢ–дәҡй”Ўжә¶ж¶Іж—¶еҠ е…Ҙж°ўж°§еҢ–й’
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
дёӢеҲ—еҗ„е®һйӘҢзҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү
|
||||||||||||||||
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ідәҺжә¶ж¶Ізҡ„й…ёзўұжҖ§иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү A. c(H+)еҫҲе°Ҹзҡ„жә¶ж¶ІдёҖе®ҡе‘ҲзўұжҖ§ B.зӯүдҪ“з§ҜгҖҒpH зӣёзӯүзҡ„ж°Ёж°ҙе’ҢNaOHжә¶ж¶Ідёӯе’Ңзӣҗй…ёиғҪеҠӣзӣёеҗҢ C.дёҖе®ҡжқЎд»¶дёӢжҹҗжә¶ж¶ІpH=6.5пјҢеҸҜиғҪе‘ҲдёӯжҖ§ D. дёҚиғҪдҪҝй…ҡй…һиҜ•ж¶ІеҸҳзәўзҡ„жә¶ж¶ІдёҖе®ҡе‘Ҳй…ёжҖ§
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
дёӢеҲ—жңүе…іе®һйӘҢж“ҚдҪңжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү
|
||||||||||||||||
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
0.10mol/L зҡ„ NH4Cl жә¶ж¶ІдёӯпјҢжө“еәҰжңҖе°Ҹзҡ„зҰ»еӯҗжҳҜпјҲВ В пјү A. NH4+В В В B. H+В В В C. Cl-В В В D. OH-
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
е°ҶpHдёә5зҡ„зЎ«й…ёжә¶ж¶ІзЁҖйҮҠ500еҖҚпјҢзЁҖйҮҠеҗҺжә¶ж¶Ідёӯc(SO AпјҺ1вҲ¶1В В В В BпјҺ1вҲ¶2В В В В CпјҺ1вҲ¶10В В В В DпјҺ10вҲ¶1
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁеҗ«й…ҡй…һзҡ„0.1 mol/Lж°Ёж°ҙдёӯеҠ е…Ҙе°‘йҮҸNH4Clжҷ¶дҪ“пјҢеҲҷжә¶ж¶ІйўңиүІ В В В В В В (гҖҖгҖҖ) AпјҺеҸҳи“қиүІгҖҖгҖҖВ В В В В В В В В В В BпјҺеҸҳж·ұгҖҖгҖҖ CпјҺеҸҳжө…гҖҖгҖҖ В В В В В В В В В В В В DпјҺдёҚеҸҳ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
йҶӢй…ёжә¶ж¶ІдёӯеӯҳеңЁз”өзҰ»е№іиЎЎпјҡCH3COOH A. йҶӢй…ёжә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰзҡ„е…ізі»ж»Ўи¶іпјҡc(H+)= c(CH3COO-)+c(OH-) B. зү©иҙЁзҡ„йҮҸжө“еәҰзӣёзӯүCH3COOH е’ҢCH3COONa ж··еҗҲжә¶ж¶Іпјҡc (CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-) C. CH3COOH жә¶ж¶ІеҠ ж°ҙзЁҖйҮҠ D. CH3COOH жә¶ж¶ІеҠ ж°ҙзЁҖйҮҠпјҢжә¶ж¶Ідёӯ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еӣӣз§Қжә¶ж¶ІдёӯпјҢз”ұж°ҙз”өзҰ»з”ҹжҲҗзҡ„ж°ўзҰ»еӯҗжө“еәҰд№ӢжҜ”пҖЁв‘ вҲ¶в‘ЎвҲ¶в‘ўвҲ¶в‘ЈпҖ©жҳҜпјҲВ В В пјү в‘ pHпјқ0зҡ„зӣҗй…ёВ В В В В В В В В В В в‘Ў 0пҖ®1 mol / Lзҡ„зӣҗй…ёВ В В В В в‘ў 0пҖ®01 mol / Lзҡ„NaOHжә¶ж¶ІВ В В В В В В в‘Ј pHпјқ11зҡ„NaOHжә¶ж¶І В В В В AпҖ® 1вҲ¶10вҲ¶100вҲ¶1000В В В В В В В В В В В В В В BпҖ® 0вҲ¶1вҲ¶12вҲ¶11 В В В В CпҖ® 14вҲ¶13вҲ¶12вҲ¶11В В В В В В В В В В В В В В В В DпҖ® 14вҲ¶13вҲ¶2вҲ¶3
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢйқўжҳҜдёҖж®өе…ідәҺдёӯе’Ңж»ҙе®ҡе®һйӘҢж“ҚдҪңзҡ„еҸҷиҝ°пјҡ в‘ еҸ–дёҖй”ҘеҪўз“¶пјҢз”Ёеҫ…жөӢNaOHжә¶ж¶Іж¶Ұжҙ—дёӨж¬Ў в‘ЎеңЁдёҖй”ҘеҪўз“¶дёӯеҠ е…Ҙ25 mLеҫ…жөӢNaOHжә¶ж¶І в‘ўеҠ е…ҘеҮ ж»ҙзҹіи•ҠиҜ•ж¶ІеҒҡжҢҮзӨәеүӮ в‘ЈеҸ–дёҖж”Ҝй…ёејҸж»ҙе®ҡз®ЎпјҢжҙ—ж¶Өе№ІеҮҖ в‘ӨзӣҙжҺҘеҫҖе…¶дёӯжіЁе…Ҙж ҮеҮҶй…ёжә¶ж¶ІпјҢиҝӣиЎҢж»ҙе®ҡ в‘Ҙе·ҰжүӢж—ӢиҪ¬ж»ҙе®ҡз®Ўзҡ„зҺ»з’ғжҙ»еЎһпјҢеҸіжүӢдёҚеҒңж‘ҮеҠЁй”ҘеҪўз“¶ в‘ҰдёӨзңјжіЁи§ҶзқҖж»ҙе®ҡз®ЎеҶ…зӣҗй…ёж¶ІйқўдёӢйҷҚпјҢзӣҙиҮіж»ҙе®ҡз»ҲзӮ№ дёҠиҝ°иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲВ В В пјү A.в‘Јв‘Ҙв‘ҰВ В В B.в‘ в‘Өв‘Ҙв‘Ұ C.в‘Ўв‘Өв‘ҘВ В В D.в‘ в‘ўв‘Өв‘Ұ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁиҜ•з®ЎдёӯжіЁе…ҘжҹҗзәўиүІжә¶ж¶ІпјҢз»ҷиҜ•з®ЎеҠ зғӯпјҢжә¶ж¶ІйўңиүІйҖҗжёҗеҸҳжө…пјҢеҲҷеҺҹжә¶ж¶ІеҸҜиғҪжҳҜпјҲВ пјү в‘ ж»ҙжңүзҹіи•Ҡзҡ„H2SO4жә¶ж¶І в‘Ўж»ҙжңүй…ҡй…һзҡ„ж°Ёж°ҙжә¶ж¶І в‘ўж»ҙжңүй…ҡй…һзҡ„ж°ўж°§еҢ–й’ жә¶ж¶І в‘Јж»ҙжңүй…ҡй…һзҡ„йҘұе’Ңж°ўж°§еҢ–й’ҷжә¶ж¶І в‘Өж»ҙжңүй…ҡй…һзҡ„Na2CO3жә¶ж¶І в‘Ҙжә¶жңүSO2зҡ„е“Ғзәўжә¶ж¶І A. в‘Ўв‘ҘВ В В B. в‘Ўв‘Ј C. в‘ в‘ўв‘ӨВ В В D. в‘Ўв‘Јв‘Ҙ
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
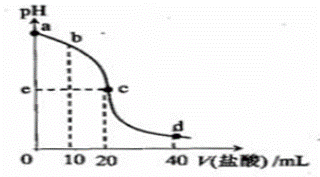
еёёжё©дёӢпјҢе°Ҷ1.0mol/L зӣҗй…ёж»ҙе…Ҙ20mL 10mol/Lж°Ёж°ҙдёӯпјҢжә¶ж¶ІpHйҡҸеҠ е…Ҙзӣҗй…ёдҪ“з§ҜеҸҳеҢ–зҡ„жӣІзәҝеҰӮеҸіеӣҫжүҖзӨәгҖӮдёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү
A. aзӮ№пјҢc(NH4+)=c(OH-) B. bзӮ№пјҢc(NH4+)>c(Cl-)>c(NH3В·H2O) C. cзӮ№,pH=7 D. dзӮ№пјҢc(NH4+)+c(NH3В·H2O)=c(Cl-)
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүе®Өжё©дёӢеӣӣз§Қжә¶ж¶Іпјҡв‘ pH=11зҡ„ж°Ёж°ҙгҖҒв‘ЎpH=11зҡ„NaOHжә¶ж¶ІгҖҒв‘ўpH=3зҡ„CH3COOHжә¶ж¶ІгҖҒв‘ЈpH=3зҡ„H2SO4жә¶ж¶ІгҖӮдёӢеҲ—жңүе…іиҜҙжі•дёӯдёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В В В В пјү AпјҺв‘ гҖҒв‘ЎдёӯеҲҶеҲ«еҠ е…ҘйҖӮйҮҸзҡ„NH4Clжҷ¶дҪ“еҗҺпјҢдёӨжә¶ж¶Ізҡ„pHеқҮеҮҸе°Ҹ BпјҺеҲҶеҲ«еҠ ж°ҙзЁҖйҮҠ10еҖҚпјҢеӣӣз§Қжә¶ж¶Ізҡ„pHеӨ§е°ҸйЎәеәҸдёәв‘ пјһв‘Ўпјһв‘Јпјһв‘ў CпјҺв‘ гҖҒв‘ЈдёӨжә¶ж¶Іж··еҗҲеҗҺпјҢиӢҘжә¶ж¶Іе‘ҲдёӯжҖ§пјҢеҲҷжүҖеҫ—жә¶ж¶Ідёӯ2 c(NH4+)пјқc (SO42-) DпјҺV1 L в‘ЈдёҺV2 L в‘Ўжә¶ж¶Іж··еҗҲеҗҺпјҢиӢҘж··еҗҲеҗҺжә¶ж¶ІpH=4пјҢеҲҷVIвҲ¶V2=11вҲ¶9
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
25 в„ғж—¶жңүе…ізү©иҙЁзҡ„йўңиүІе’Ңжә¶еәҰз§Ҝ(Ksp)еҰӮдёӢиЎЁпјҡ дёӢеҲ—еҸҷиҝ°дёӯдёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺеҗ‘AgClзҡ„зҷҪиүІжӮ¬жөҠж¶ІдёӯеҠ е…Ҙ0.1 molВ·LпјҚ1 KIжә¶ж¶ІпјҢжңүй»„иүІжІүж·Җдә§з”ҹ BпјҺ25 в„ғж—¶пјҢAgClгҖҒAgBrгҖҒAgIгҖҒAg2SйҘұе’Ңж°ҙжә¶ж¶ІдёӯAgпјӢзҡ„жө“еәҰзӣёеҗҢ CпјҺ25 в„ғж—¶пјҢAgClеӣәдҪ“еңЁзӯүзү©иҙЁзҡ„йҮҸжө“еәҰNaClгҖҒCaCl2жә¶ж¶Ідёӯзҡ„жә¶еәҰз§ҜзӣёеҗҢ DпјҺеңЁ5 mL 1.8Г—10пјҚ6 molВ·LпјҚ1 NaClжә¶ж¶ІдёӯпјҢеҠ е…Ҙ1ж»ҙ(20ж»ҙзәҰдёә1 mL)1Г—10пјҚ3 molВ·LпјҚ1 AgNO3жә¶ж¶ІпјҢдёҚиғҪдә§з”ҹзҷҪиүІжІүж·Җ
|
||||||||||||||||
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁе®Өжё©дёӢпјҢ100mL0.1mol/Lзҡ„йҶӢй…ёжә¶ж¶ІдёӯпјҢж¬ІдҪҝе…¶жә¶ж¶Ізҡ„pHеҮҸе°ҸпјҢеҗҢж—¶еҸҲиҰҒдҪҝйҶӢй…ёзҡ„з”өзҰ»зЁӢеәҰеҮҸе°‘пјҢеҸҜйҮҮеҸ–пјҲВ В пјү AпјҺеҠ е…Ҙе°‘йҮҸCH3COONaеӣәдҪ“В В В BпјҺйҖҡе…Ҙе°‘йҮҸHClж°”дҪ“ CпјҺеҚҮй«ҳжё©еәҰВ В В В В В В В В В В В В В В В DпјҺеҠ е…Ҙе°‘йҮҸNaOHеӣәдҪ“
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
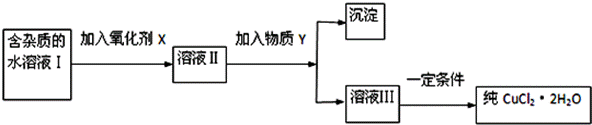
зҺ°з”Ёж°ҜеҢ–й“ңжҷ¶дҪ“(CuCl2В·2H2OпјҢеҗ«ж°ҜеҢ–дәҡй“ҒжқӮиҙЁ)еҲ¶еҸ–зәҜеҮҖзҡ„CuCl2В·2H2OгҖӮе…Ҳе°Ҷе…¶еҲ¶жҲҗж°ҙжә¶ж¶ІпјҢеҗҺжҢүеҰӮеӣҫжӯҘйӘӨиҝӣиЎҢжҸҗзәҜпјҡ
е·ІзҹҘCu2+гҖҒFe3+е’ҢFe2+зҡ„ж°ўж°§еҢ–зү©ејҖе§ӢжІүж·Җе’ҢжІүж·Җе®Ңе…Ёж—¶зҡ„pHи§ҒдёӢиЎЁпјҡ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүзҺ°жңүж°§еҢ–еүӮNaClOгҖҒH2O2гҖҒKMnO4пјҢXеҠ В В В В В В В В еҘҪпјҢеҺҹеӣ жҳҜ____________________________пјҢиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә_______________________В В В В В В В В В В В В В В В В В В В В В В В _____гҖӮ пјҲ2пјүжә¶ж¶ІIIдёӯйҷӨCu2+еӨ–пјҢиҝҳжңү______йҮ‘еұһзҰ»еӯҗпјҢжЈҖйӘҢиҜ•еүӮдёә______________гҖӮзү©иҙЁY дёҚиғҪдёәдёӢеҲ—зҡ„________________________гҖӮ a.CuOВ В В В b.Cu(OH)2В В c.CuCO3В В В В d.Cu2(OH)2CO3В В В e.CaOВ В В В f.NaOH пјҲ3пјүеёёжё©дёӢпјҢйҷӨеҺ»CuCl2 жә¶ж¶Ідёӯзҡ„Fe2+пјҢеҠ е…Ҙж°§еҢ–еүӮXпјҢдҪҝFe2+ж°§еҢ–дёәFe3+пјҢ然еҗҺеҠ е…Ҙзү©иҙЁY иҮіжә¶ж¶ІpH=4пјҢжӯӨж—¶c(Fe3+)=_________mol/LгҖӮ[е·ІзҹҘFe(OH)3 зҡ„Ksp=4Г—10-38] пјҲ4пјүиӢҘеңЁз©әж°”дёӯеҠ зғӯеӣәдҪ“CuCl2В·2H2OпјҢеҸҜж°ҙи§Јз”ҹжҲҗCu(OH)ClпјҢеҶҷеҮәзӣёе…ізҡ„еҢ–еӯҰж–№зЁӢејҸ_______________________________________гҖӮ
|
|||||||||||||
| 26. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
з”өзҰ»е№іиЎЎеёёж•°жҳҜиЎЎйҮҸејұз”өи§ЈиҙЁз”өзҰ»зЁӢеәҰзҡ„йҮҸгҖӮе·ІзҹҘеҰӮдёӢиЎЁж•°жҚ®пјҲ25в„ғпјүпјҡ
пјҲ1пјү25 в„ғж—¶пјҢзӯүжө“еәҰзҡ„дёүз§Қжә¶ж¶І(a.NaCNжә¶ж¶ІгҖҒb.Na2CO3жә¶ж¶ІгҖҒc.CH3COONaжә¶ж¶І)зҡ„pHз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёә________________________________гҖӮ(еЎ«еҶҷеәҸеҸ·) пјҲ2пјү25 в„ғж—¶пјҢеҗ‘NaCNжә¶ж¶ІдёӯйҖҡе…Ҙе°‘йҮҸCO2пјҢжүҖеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә_____________________гҖӮ пјҲ3пјүзҺ°жңүжө“еәҰдёә0.02 mol/Lзҡ„HCNдёҺ0.01mol/L NaOHзӯүдҪ“з§Ҝж··еҗҲеҗҺпјҢжөӢеҫ—C(Na+)>C(CN-)пјҢдёӢеҲ—е…ізі»жӯЈзЎ®зҡ„жҳҜ _______гҖӮ A.C(H+)>C(OH-)В В В В В В В В В В В В В В В В В В B.C(H+)<C(OH-) C.C(H+)+C(HCN) = C(OH-)В В В В В В В В В D.C(HCN)+C(CN-)=0.01mol/L пјҲ4пјүеёёжё©дёӢпјҢе°ҶжҹҗдёҖе…ғй…ёHA е’ҢNaOH жә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲпјҢдёӨз§Қжә¶ж¶Ізҡ„жө“еәҰе’Ңж··еҗҲеҗҺжүҖеҫ—жә¶ж¶Ізҡ„pH еҰӮдёӢиЎЁпјҡ
иҜ·еӣһзӯ”пјҡ в‘ д»Һaз»„жғ…еҶөеҲҶжһҗпјҢ HAжҳҜејәй…ёиҝҳжҳҜејұй…ё_____________гҖӮ в‘Ўbз»„жғ…еҶөиЎЁжҳҺпјҢc_______0.2пјҲйҖүеЎ«вҖңеӨ§дәҺвҖқвҖңе°ҸдәҺвҖқжҲ–вҖңзӯүдәҺвҖқпјүгҖӮж··еҗҲжә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰcпјҲA-пјү________ cпјҲNa+пјүпјҲйҖүеЎ«вҖңеӨ§дәҺвҖқвҖңе°ҸдәҺвҖқжҲ–вҖңзӯүдәҺвҖқпјүгҖӮ в‘ўaз»„е®һйӘҢжүҖеҫ—ж··еҗҲжә¶ж¶Ідёӯз”ұж°ҙз”өзҰ»еҮәзҡ„cпјҲOH-пјү=______molВ·L-1пјҺеҶҷеҮәиҜҘж··еҗҲжә¶ж¶ІдёӯдёӢеҲ—з®—ејҸзҡ„зІҫзЎ®з»“жһңпјҲдёҚйңҖеҒҡиҝ‘дјји®Ўз®—пјүпјҺcпјҲNa+пјү-cпјҲA-пјү=______molВ·L-1 гҖӮ
|
|||||||||||||||||||||
| 27. | иҜҰз»ҶдҝЎжҒҜ |
|
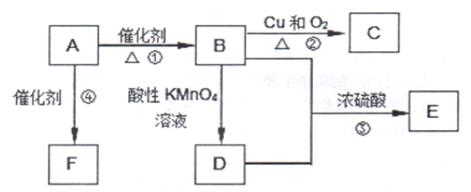
е·ІзҹҘAжҳҜжқҘиҮӘзҹіжІ№зҡ„йҮҚиҰҒжңүжңәеҢ–е·ҘеҺҹж–ҷпјҢе…¶дә§йҮҸз”ЁжқҘиЎЎйҮҸдёҖдёӘеӣҪ家зҹіжІ№еҢ–е·ҘеҸ‘еұ•ж°ҙе№іпјҢEжҳҜе…·жңүжһңйҰҷе‘ізҡ„жңүжңәзү©пјҢFжҳҜдёҖз§Қй«ҳиҒҡзү©пјҢеҸҜеҲ¶жҲҗеӨҡз§ҚеҢ…иЈ…жқҗж–ҷгҖӮ
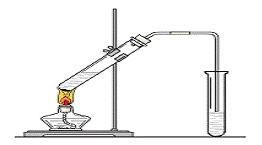
пјҲ1пјү Aзҡ„еҗҚз§°дёә___В В В В В _пјӣCеҲҶеӯҗдёӯзҡ„е®ҳиғҪеӣўеҗҚз§°дёә_________гҖӮ пјҲ2пјүеҸҚеә”в‘Ўзҡ„еҢ–еӯҰж–№зЁӢејҸдёә______В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В ___пјӣ пјҲ3пјүеҸҚеә”в‘ўзҡ„еҢ–еӯҰж–№зЁӢејҸдёә_____В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В ____пјӣ иҜҘеҸҚеә”зҡ„еҸҚеә”зұ»еһӢдёә_____В В В В В В В В ____гҖӮ пјҲ4пјүеҸҚеә”в‘ўзҡ„еҢ–еӯҰж–№зЁӢејҸдёә_____________В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В ___пјӣ иҜҘеҸҚеә”зҡ„еҸҚеә”зұ»еһӢдёә_____В В В В В В В В В ____гҖӮ в‘ёе®һйӘҢе®ӨеҸҚеә”в‘ЈжҲ‘们д№ҹеҸҜд»Ҙз”ЁеҸіеӣҫжүҖзӨәзҡ„иЈ…зҪ®гҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ В В В В В В В В В В В В В В В В В В В В В В В
в‘ зЎ«й…ёзҡ„дҪңз”ЁжҳҜпјҡВ В В В В В В В В В В В В В В В В В В гҖҒ В В В В В В В В В В В В В В В В В В пјӣ в‘ЎйҘұе’Ңзўій…ёй’ жә¶ж¶Ізҡ„дё»иҰҒдҪңз”ЁжҳҜ ________В В В В В В В В В В В _________В В В В В В В В В В _____ пјӣВ В В В В В В В В В В В В В В В В В В В в‘ўиЈ…зҪ®дёӯйҖҡи’ёж°”зҡ„еҜјз®ЎиҰҒжҸ’еңЁйҘұе’Ңзўій…ёй’ жә¶ж¶Ізҡ„ж¶ІйқўдёҠпјҢдёҚиғҪжҸ’е…Ҙжә¶ж¶ІдёӯпјҢе…¶зӣ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В __________________В В В В В В В В В В В В В В В В В В В В В В В В В В В _____В гҖӮ
|
|
| 28. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҲ1пјүXгҖҒYгҖҒZдёүз§Қж¶ІдҪ“зҡ„иҝ‘дјјpHеҰӮеӣҫпјҢдёӢеҲ—еҲӨж–ӯжӯЈзЎ®зҡ„жҳҜ___________гҖӮ
AпјҺXдёҖе®ҡжҳҜй…ёжҲ–ејәй…ёејұзўұзӣҗжә¶ж¶І BпјҺYдёҖе®ҡжҳҜ90в„ғж—¶зҡ„зәҜж°ҙ CпјҺYж¶ІдҪ“дёҖе®ҡе‘ҲдёӯжҖ§ DпјҺZеҸҜиғҪжҳҜNa2SiO3жә¶ж¶І пјҲ2пјүзү©иҙЁзҡ„йҮҸжө“еәҰзӣёеҗҢзҡ„дёүз§Қжә¶ж¶Іпјҡв‘ NH4Cl в‘Ўж°Ёж°ҙ в‘ўNH4HSO4пјҢc(NH4+)еӨ§е°ҸйЎәеәҸжӯЈзЎ®зҡ„жҳҜ___________гҖӮ AпјҺв‘ >в‘Ў>в‘ўВ В В В В В В В BпјҺв‘ў>в‘ >в‘ЎВ В В В В В В CпјҺв‘Ў>в‘ў>в‘ В В В В В В DпјҺв‘ў>в‘Ў>в‘ пјҲ3пјүеёёжё©дёӢдёӨз§Қжә¶ж¶ІпјҡaпјҺpH=4зӣҗй…ё bпјҺpH=4NH4Clжә¶ж¶ІпјҢе…¶дёӯж°ҙзҡ„з”өзҰ»зЁӢеәҰеӨ§е°ҸпјҡaВ В В В В bгҖӮ(йҖүеЎ«вҖң>вҖқжҲ–вҖң <вҖқжҲ–вҖң=вҖқпјү пјҲ4пјүpHпјқ2зҡ„жҹҗй…ёHnA(An-дёәй…ёж №)дёҺpHпјқ12зҡ„жҹҗзўұB(OH)mж··еҗҲпјҢжҒ°еҘҪеҸҚеә”з”ҹжҲҗжӯЈзӣҗпјҢж··еҗҲж¶ІpHпјқ8,еҸҚеә”з”ҹжҲҗзҡ„жӯЈзӣҗзҡ„еҢ–еӯҰејҸдёә_________,зӣҗдёӯ________зҰ»еӯҗдёҖе®ҡиғҪж°ҙи§ЈпјҢ其第дёҖжӯҘж°ҙи§Јзҡ„зҰ»еӯҗж–№зЁӢејҸдёә__________________В В В В В В В В В В _____гҖӮ пјҲ5пјүеҪ“300mL 1 mo1В·L-1зҡ„NaOH жә¶ж¶Іеҗёж”¶ж ҮеҮҶзҠ¶еҶөдёӢ4.48LCO2ж—¶пјҢжүҖеҫ—жә¶ж¶Ідёӯеҗ„зҰ»еӯҗжө“еәҰз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёә_________________________________________гҖӮ
|
|
- 2019-2020е№ҙй«ҳдәҢдёӢеҚҠжңҹ第дәҢж¬ЎжңҲиҖғеҢ–еӯҰиҜ•еҚ·е®Ңж•ҙзүҲпјҲжұҹиҘҝзңҒе®ңжҳҘеёӮ第д№қдёӯеӯҰпјү
- еҚ—е……еёӮ2020е№ҙй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҹдёӯиҖғиҜ•еңЁзәҝеҒҡйўҳ
- 2019еұҠй«ҳдёүдёҠеӯҰжңҹ12жңҲжңҲиҖғзҗҶ科综еҗҲеҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲж№–еҢ—зңҒжӯҰжұүеёӮ第е…ӯдёӯеӯҰпјү
- еӣӣе·қй«ҳдәҢеҢ–еӯҰ2018е№ҙдёҠеӯҰжңҹжңҹдёӯиҖғиҜ•еңЁзәҝе…Қиҙ№иҖғиҜ•
- ж–°д№ЎеёӮ2018е№ҙй«ҳдёҖеҢ–еӯҰдёҠеҚҠе№ҙжңҹдёӯиҖғиҜ•е®Ңж•ҙиҜ•еҚ·
- еұұиҘҝй«ҳдёүеҢ–еӯҰжңҲиҖғжөӢйӘҢпјҲ2019е№ҙеүҚеҚҠжңҹпјүиҜ•еҚ·е®Ңж•ҙзүҲ
- й«ҳдёҖдёҠжңҹж®өиҖғеҢ–еӯҰе…Қиҙ№иҜ•йўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲ2019-2020е№ҙжө·еҚ—зңҒзҗјжө·еёӮеҳүз§ҜдёӯеӯҰпјү
- иҘҝе®ҒеёӮ2020е№ҙй«ҳдёҖеҢ–еӯҰеҗҺеҚҠжңҹжңҲиҖғжөӢйӘҢйҷ„зӯ”жЎҲдёҺи§Јжһҗ