2018高二上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列关于能源和作为能源的物质叙述错误的是 A.化石能源物质内部蕴涵着大量的能量 B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 C.物质的化学能可以在不同的条件下转化为热能、电能被人类利用 D.吸热反应没有利用价值
|
|
| 2. | 详细信息 |
|
下列反应中生成物总能量高于反应物总能量的是( ) A.碳酸钙受热分解 B.乙醇燃烧 C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
|
|
| 3. | 详细信息 |
|
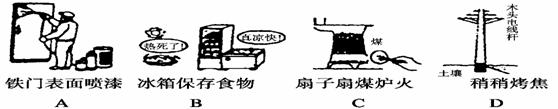
下列各图所反映的措施中,目的是为了加快其化学反应速率的是
|
|
| 4. | 详细信息 |
|
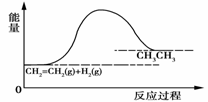
对于反应CH2=CH2+H2→CH3CH3,反应过程的能量变化如图所示。下列说法正确的是
B.此反应的ΔH<0 C.此反应中反应物的能量总和大于产物的能量总和 D.1分子乙烯和1分子氢气的键能总和大于1分子乙烷的键能总和
|
|
| 5. | 详细信息 |
|
25 ℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,则下列描述正确的是 A.KOH(aq)+ B.NaOH(aq)+HCl(aq) C.H2SO4和Ca(OH)2反应的中和热为ΔH=2×(-57.3) kJ·mol-1 D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
|
|
| 6. | 详细信息 |
|
已知氢气、乙烷、甲醇、甲烷的燃烧热分别为285.8 kJ·mol−1、1559.8 kJ·mol−1、726.51 kJ·mol−1、890.31 kJ·mol−1,相同质量的氢气、乙烷、甲醇、甲烷完全燃烧时,放出热量最多的是 A.H2(g) B.C2H6(g) C.CH3OH(l) D.CH4(g)
|
|
| 7. | 详细信息 |
|
已知Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0;则下列关于该反应的叙述不正确的是 A.该反应中旧键断裂需吸收能量,新键形成需放出能量,所以总能量不变 B.上述热化学方程式中的ΔH的值与反应物的用量无关 C.该反应的化学能可以转化为电能 D.反应物的总能量高于生成物的总能量
|
|
| 8. | 详细信息 |
|
已知在一定条件下,CO的燃烧热为283 kJ/mol,CH4的燃烧热为890 kJ/mol,由1 mol CO和3 mol CH4组成混合气体在上述条件下充分燃烧,释放的热量为 ( ) A.2912 kJ B.2953 kJ C.3236 kJ
|
|
| 9. | 详细信息 |
|
下列说法正确的是 ( ) A.1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热 B.25℃、101 kPa时,1 mol S和2 mol S的燃烧热相等 C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 D.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
|
|
| 10. | 详细信息 |
|
已知25℃、101 kPa条件下: 4Al(s)+3O2(g)===2Al2O3(s)ΔH=-2834.9 kJ/mol 4Al(s)+2O3(g)===2Al2O3(s)ΔH=-3119.1 kJ/mol由此得出的正确结论是 ( ) A.等质量的O2比O3能量低,由O2变O3为放热反应 B.等质量的O2比O3能量高,由O2变O3为吸热反应 C.O3比O2稳定,由O2变O3为放热反应 D.O2比O3稳定,由O2变O3为吸热反应
|
|
| 11. | 详细信息 |
|
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol Na2O2(s)+CO2(g)===Na2CO3(s)+ 根据以上热化学方程式判断,下列说法正确的是 ( ) A.CO的燃烧热为283 kJ B.由CO生成CO2的反应过程是吸热反应 C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH >-452kJ/mol D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
|
|
| 12. | 详细信息 |
|
2008年北京奥运会“祥云”奥运火炬所用环保型燃料为丙烷,悉尼奥运会所用火炬燃料为65%丁烷和35%丙烷,已知丙烷的燃烧热为2221.5 kJ/mol;正丁烷的燃烧热为2878 kJ/mol;异丁烷的燃烧热为2869.6 kJ/mol;下列有关说法正确的是 A.丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)===3CO2(g)+4H2O(g) ΔH=-2221.5 kJ/mol B.相同质量的正丁烷和异丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多 C.正丁烷比异丁烷稳定 D.奥运火炬燃烧时主要是将化学能转变为热能和光能
|
|
| 13. | 详细信息 | ||||||||
|
通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
则下列热化学方程式不正确的是 ( ) A. C.
|
|||||||||
| 14. | 详细信息 |
|
反应3A(g) + B(g) ① v (A) = 0.6 mol · L-1 · min-1 ② v (B) = 0.45 mol · L-1 · min-1 ③ v (C) = 0.015 mol · L -1 · s -1 ④ v (D) = 0.45 mol · L-1 · min-1 则此反应在不同条件下进行得最快的是 ( ) A.②③ B.①③ C.②④ D.①
|
|
| 15. | 详细信息 |
|
已知298K时,合成氨反应 N2 (g ) + 3H2 ( g ) A. 一定大于92.0 kJ B. 一定等于92.0 kJ C. 一定小于92.0 kJ D. 不能确定
|
|
| 16. | 详细信息 |
|
下列说法或表示方法正确的是( ) A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 B.由C(石墨)→C(金刚石);ΔH=+119kJ·mol-1可知,金刚石比石墨稳定 C.在稀溶液中:H+(aq)+OH-(aq)===H2O(l);ΔH=-57.3kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的稀溶液混合,放出的热量大于57.3kJ D.在101kPa、25℃时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)===2H2O(l);ΔH=-285.8kJ·mol-1
|
|
| 17. | 详细信息 |
|
反应4A(s)+3B(g) A.用A表示的反应速率是0.8 mol·L-1·s-1 B.分别用B C.在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1 D.在这2 min内用B和C表示的反应速率的值都是相同的
|
|
| 18. | 详细信息 |
|
按要求写热化学方程式: (1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程_____________________________ ________. (2)实验测得25℃、101kPa时1molH2完全燃烧放出285.8 kJ的热量,写出H2燃烧热的热化学方程式: 。 (3)25℃、101 kPa条件下充分燃烧一定量的甲烷气体放出热量为Q kJ,经测 (4)已知下列热化学方程式: ①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol ②C(s)+O2(g)===C ③H2(g)+ 写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_____________ ___________. (5)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_______________ _________________
|
|
| 19. | 详细信息 |
|
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) (1)用物质A表示的反应的平均速率为_____ ____;(2)2 s时物质B的转化率为_____ ___; (3)用物质B表示的反应的平均速率为____ _ ____;(4)2 s时物质A的浓度为_____ _____。
|
|
| 20. | 详细信息 |
|
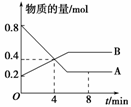
某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得: (1)该反应的化学方程式为__ ______________________________。 (2)反应开始至4 min时,A的平均反应速率为__________________________。 B的平均反应速率为__________________________。 (3)4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
|
|
| 21. | 详细信息 |
|
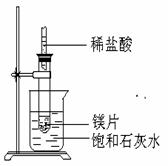
(1)实验中观察到的现象是 (2)产生该现象的原因 (3)写出有关反应的离子反应方程式 (4)有此推知,MgCl2溶液和H2的总能量 填(“大于”“小于”或“等于”)镁片和盐酸的总能量
|
|
| 22. | 详细信息 | ||||||||||||||||||||
|
某化学兴趣小组要完成中和热的测定。 (1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是 、 。 (2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 。 (3)他们记录的实验数据如下:
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。 ①计算完成上表。 ②根据实验①结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。 (4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
|
|||||||||||||||||||||