2019四川高一下学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
关于核素碳 A.碳元素的相对原子质量为14 B.碳元素的原子序数为6 B.该核素的中子数为8 D.该核素用于测定一些文物的年代
|
|
| 2. | 详细信息 |
|
下列气体为红棕色的是 A.SO2 B.NO C.NO2 D.NH3
|
|
| 3. | 详细信息 |
|
浓硫酸是实验室必备的重要试剂,下列有关它的说法错误的是 A.具有强腐蚀性 B.能用于干燥氨气 C.能使蔗糖变黑 D.加热时能与铜发生反应
|
|
| 4. | 详细信息 |
|
下列元素的非金属性最强的是 A.氟 B.氯 C.磷 D.硅
|
|
| 5. | 详细信息 |
|
下列反应中,既属于氧化还原反应,又属于吸热反应的是 A.锌片与稀硫酸的反应 B.灼热的炭与水蒸气的反应 C.甲烷在空气中的燃烧反应 D.Ba(OH)2 ·8H2O与NH4Cl的反应
|
|
| 6. | 详细信息 |
|
1868年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一。下列有关元素周期表的说法不正确的是 A.迄今人类发现的元素中,金属元素和非金属元素种数相近 B. 元素周期表有18个纵行16个族,分为主族、副族、第Ⅷ族和零族 C. 元素周期表有七个周期,分为短周期和长周期 D. 人们在周期表中金属与非金属的分界处可以找到半导体材料,如硅、锗等
|
|
| 7. | 详细信息 |
|
下列有关能量变化的说法中不正确的是 A.化学反应必伴随能量变化 B.反应是放热还是吸热取决于反应物和生成物具有的总能量的相对大小 C.可燃物燃烧和酸碱中和反应都是典型的放热反应 D.燃煤发电不需经过其它能量转换过程,可直接把化学能转化为电能
|
|
| 8. | 详细信息 |
|
下列比较中,正确的是 A.酸性:HClO4>H2CO3>HClO B.金属性:Mg>Ca>Ba C.热稳定性:HBr>HCl>HF D.沸点:HF>H2O>NH3
|
|
| 9. | 详细信息 | |||||||||||||||
|
根据元素周期律,由下列事实进行归纳推测,推测不合理的是
|
||||||||||||||||
| 10. | 详细信息 | ||||||||||
|
根据下表第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是
A. F B. Cl C. Br D. I
|
|||||||||||
| 11. | 详细信息 |
|
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的L层电子数是K层电子数的3倍,下列说法不正确的是 A.Y的气态氢化物比X的稳定 B.W的最高价氧化物对应水化物的酸性比Z的强 C.Y的非金属性比Z的强 D.X与Y形成的化合物都易溶于水
|
|
| 12. | 详细信息 |
|
105 ℃、101 kPa时,甲烷、乙烷和乙烯组成的混合烃80 mL与过量O2混合并完全燃烧,恢复到原来的温度和压强,混合气体总体积增加了30 mL。原混合烃中乙烷的体积分数为 A. 12.5% B. 25% C. 50% D. 75%
|
|
| 13. | 详细信息 |
|
在1L浓度为0.2mol·L-1 Fe(NO3)3和1.5 mol·L-1 H2SO4组成的混合溶液中,加入39.2g铁粉使其充分反应。下列有关说法正确的是 A.反应后产生标准状况下的氢气11.2 L B. 反应后的溶液中c(Fe2+)∶c(Fe3+)=2∶1 C.反应后的溶液还可以溶解19.2g铜 D.反应后的溶液还可以溶解16.8 g铁粉
|
|
| 14. | 详细信息 |
|
X、Y、Z、R、W为五种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价代数和为4;Z的单质常用于漂白工业;R是短周期元素中金属性最强的元素,W是生活中的常见金属,其氧化物常做耐高温材料。回答下列问题: (1)Y元素的名称 ,在周期表中的位于第三周期 族 (2) W与Z单质化合得到的物质属于 化合物(选填“离子”或“共价”),向其溶液中加入足量NaOH溶液,反应的离子方程式为 。 (3)工业上常用W单质与氨气在1700℃发生置换反应,生成一种最轻的气体和一种坚硬耐磨的固体,试写出该反应的化学方程式 。 (4)化合物甲由元素X、R组成,甲能与水剧烈反应,并产生大量气泡,写出其化学反应方程式 ,甲的电子式为 。 (5)为比较元素X和Y的非金属性强弱,下列方法不可行的是 。 a.比较这两种元素的常见单质的沸点b.比较这两种元素的单质与氢气化合的难易 c.比较这两种元素的气态氢化物的稳定性
|
|
| 15. | 详细信息 |
|
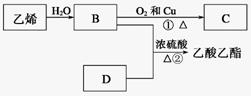
(1)乙烯的结构简式为 。(2)D中官能团的名称: 。 (3) 物质B可以被直接氧化为D,需要加入的试剂是 。(4)②的反应类型 。 (5)写出①的化学方程式___________________________________________。
|
|
| 16. | 详细信息 |
|
为了探究氨、乙醇的性质,某同学设计并进行了下列实验。
请回答: (1)仪器B的名称为_____________。 (2)为快速制备氨气,A中应加入的试剂为______,B中应放入的试剂为_______。 (3)若A中加入乙醇,B中加入生石灰,C中加入无水硫酸铜,反应一段时间后,C中的现象为_________。经检测反应中既生成了乙醛,又生成了少量乙酸。请写出乙醇与氧化铜反应生成乙醛的化学方程式______。 (4)在(3)中实验里,某同学为检验尾气中是否含有乙醇,虚线框处宜选择的装置是______(填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入试管中,观察到铜丝由黑渐渐变红,由此可得出的结论是____________________。(并简述其理由)
|
|
| 17. | 详细信息 |
|
海洋资源的利用具有广阔前景。 (1)无需经过化学变化就能从海水中获得的物质是( )(填序号) A.Cl2 B.淡水 C.烧碱 D.食盐 (2)下图是从海水中提取镁的简单流程。
①操作A是 。 ②无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为 。 ③海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁? 。 (3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
①灼烧海带至灰烬时所用的主要仪器名称是( )(填序号) a.坩埚 b.试管 c.蒸发皿 d.烧杯 ②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式__________________。 ③用CCl4提取碘时除了用CCl4还可以选用的试剂是( )(填字母序号) a.苯 b.乙醇 c.乙酸 ④为检验用CCl4提取碘后的水溶液中是否还含有碘单质。请写出该实验的实验步骤、现象及结论: 。 (4)利用海底的“可燃冰”制作的燃料电池的总反应式为CH4+2O2+2KOH = K2CO3+3H2O,则该燃料电池的负极的电极反应为 。 (5)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为: CO2(g)+3H2(g)
①a点正反应速率_________(填“大于、等于或小于”)a点逆反应速率。 ②平衡时CO2的物质的量浓度是___________mol/L。 ③能够说明该反应达到化学平衡状态的标志是_______(双选)。 A.单位时间内消耗1molCO2,同时生成3mol H2 B.混合气体的密度不随时间变化 C.CH3OH、H2的浓度不再随时间变化 D.CH3OH和H2O浓度相等
|
|