莆田某中学2017-2018学年高二下学期期初考试卷 化学试题及答案 ★★★
| 1. | 详细信息 |
|
下列叙述正确的是( ) A.原电池中阳离子向负极移动 B.用铝质铆钉接铁板,铁易被腐蚀 C.马口铁(镀锡)的表面一旦破损,铁腐蚀加快 D.白铁(镀锌)的表面一旦破损,铁腐蚀加快
|
|
| 2. | 详细信息 |
|
肼(N2H4)是火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。 已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol 下列关于肼和NO2反应的热化学方程式中,正确的是( ) A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g); △H = – 1135.7kJ/mol B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g); △H = – 1000.3kJ/mol C.N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l); △H = – 601.7kJ/mol D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l); △H = – 1135.7kJ/mol
|
|
| 3. | 详细信息 |
|
某同学为了使反应2HCl + 2Ag
|
|
| 4. | 详细信息 |
|
下列溶液中,一定呈中性的是( ) A.由非电解质溶于水得到的溶液 B. C.等物质的量的强酸与强碱反应得到的溶液 D.将pH =9的烧碱溶液稀释100倍所得到的溶液
|
|
| 5. | 详细信息 |
|
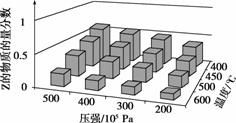
往某恒温密闭容器中加入CaCO3,发生反应: 反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示。x不可能是( ) A. v逆 B. c(CO2) C.
|
|
| 6. | 详细信息 |
|
往含I一和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示。已知:Ksp(AgCl)=1.8×l0-10, Ksp( AgI) =l.5xl0-16 则原溶液中c(I一)/c(Cl-)的比值为( ) A.(V2- Vl)/Vl B.Vl/V2 C.Vl/( V2- Vl) D.V2/Vl
|
|
| 7. | 详细信息 |
|
某实验小组为测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量Wg样品进行实验,下列实验方法所对应的方案和测量数据最合理的是( )
|
|
| 8. | 详细信息 | ||||||||||
|
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)
下列说法中不正确的是( ) A.500 s内N2O5分解速率为2.96×10-3mol·L-1·s-1 B.T1温度下的平衡常数K1=125,平衡时N2O5的转化率为50% C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 D.达到平衡后其他条件不变,将容器的体积压缩到原来的
|
|||||||||||
| 9. | 详细信息 |
|
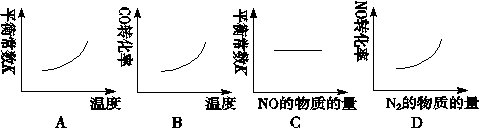
为了探究外界条件对反应aX(g)+bY(g) A.ΔH>0,a+b>c B.ΔH>0,a+b<c C.ΔH<0,a+b>c D.ΔH<0,a+b<c
|
|
| 10. | 详细信息 |
|
体积10 mL浓度为1 mol·L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是( ) A.KOH B.CH3COONa C.CuSO4 D.Na2CO3
|
|
| 11. | 详细信息 |
|
将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) A.2v(NH3)=v(CO2) B.密闭容器中c(NH3)∶c(CO2)=2∶1 C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
|
|
| 12. | 详细信息 |
|
反应COCl2(g) A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
|
|
| 13. | 详细信息 |
|
25 ℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示。则下列说法不正确的是( ) A.醋酸的电离程度:a<b<c B.溶液中c(H+):b>a>c C.a、b、c三点的溶液都有c(H+)=c(CH3COO-)+c(OH-) D.从b点到c点,溶液中
|
|
| 14. | 详细信息 |
|
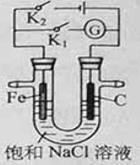
如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是 ( ) A.K1闭合,铁棒上发生的反应为2H++2e-=H2↑ B.K1闭合,石墨棒周围溶液pH逐渐升高 C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
|
|
| 15. | 详细信息 | ||||||||||||||
|
在一定温度下,10 mL 0.40mol/LH2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。(溶液体积变化忽略不计)
下列叙述不正确的是( ) A.0~6 min的平衡反应速率:v(H2O2)≈3.3×10-2 mol/(L·min) B.6~10 min的平衡反应速率:v(H2O2)<3.3×10-2 mol/(L·min) C.反应到6 min时,c(H2O2)=0.30mol/L D.反应到6 min时,H2O2分解了50%
|
|||||||||||||||
| 16. | 详细信息 |
|
将BaO2放入密闭真空容器中,反应2BaO2(s) A、平衡常数减小 B、BaO量不变 C、氧气压强不变 D、BaO量增加
|
|
| 17. | 详细信息 |
|
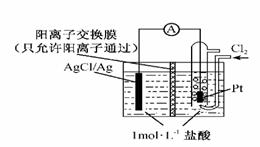
某原电池装置如右图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是 ( )
B.放电时,交换膜右侧溶液中有大量白色沉淀生成 C.若用NaCl溶液代替盐酸,则电池总反应随之改变 D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
|
|
| 18. | 详细信息 |
|
把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s) A.溶液中Ca2+数目增多 B.溶液中c(Ca2+)增大 C.溶液pH值不变 D.溶液pH值增大
|
|
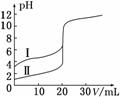
| 19. | 详细信息 |
|
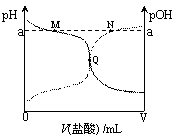
室温下,将0.10 mol·L-1盐酸滴入20.00 mL 0.10mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列说法正确的是( ) A.M点所示溶液中c(NH4+)+c(NH3·H2O)=c(Cl-) B.N点所示溶液中c(NH4+)>c(Cl-) C.Q点消耗盐酸的体积等于氨水的体积 D.M点和N点所示溶液中水的电离程度相同
|
|
| 20. | 详细信息 |
|
汽车尾气净化中的一个反应如下:NO(g)+CO(g)=
|
|
| 21. | 详细信息 | |||||||||||||||
|
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
|
||||||||||||||||
| 22. | 详细信息 |
|
已知25 ℃时,Ka(HF)=3.6×10-4 mol·L-1,Ksp(CaF2)=1.46×10-10 mol3·L-3。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是( ) A.25 ℃时,0.1 mol·L-1 HF溶液中pH=1 B.Ksp(CaF2)随温度和浓度的变化而变化 C.该体系中没有沉淀产生 D.该体系中HF与CaCl2反应产生沉淀
|
|
| 23. | 详细信息 | ||||||||||||
|
某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=
下列判断不正确的是( ) A.平衡时,乙中CO2的转化率大于60% B.平衡时,甲中和丙中H2的转化率均是60% C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
|
|||||||||||||
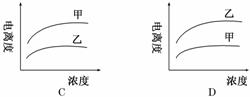
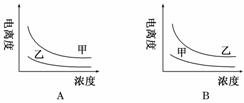
| 24. | 详细信息 |
|
下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在水中的电离度与浓度关系的是( )
|
|
| 25. | 详细信息 |
|
室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL C.V(NaOH)=20.00 mL时,两份溶液中c(Cl-)=c(CH3COO-) D.V(NaOH)=10.00 mL时,醋酸溶液中 c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
|
|
| 26. | 详细信息 | |||||||||||||||||||||||
|
一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应: 2CH3OH(g)
下列说法正确的是( ) A.该反应的正反应为吸热反应 B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小 C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长 D.若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol和H2O 0.10 mol,则反应将向正反应方向进行
|
||||||||||||||||||||||||
| 27. | 详细信息 |
|
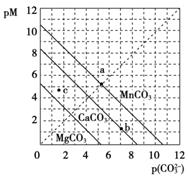
.一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=-lg c(M),p(CO
A.MgCO3、CaCO3、MnCO3的Ksp依次增大 B.a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO D.c点可表示MgCO3 的不饱和溶液,且c(Mg2+)>c(CO
|
|
| 28. | 详细信息 |
|
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇Y2O3的氧化锆ZrO2晶体,在熔融状态下能传导O2。下列对该燃料电池说法正确的是 A.在熔融电解质中,O2由负极移向正极 B.通入丁烷的一极是正极,电极反应为:2C4H10+26e+13O2=4CO2+5H2O C.通入空气的一极是负极,电极反应为:O2+4e=2O2 D.电池的总反应是:2C4H10+13O2 8CO2+10H2O
|
|
| 29. | 详细信息 | ||
|
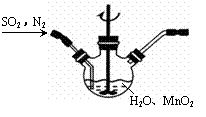
高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100℃开始分解。
(1)制备MnSO4溶液: ①主要反应装置如右图,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2 A.MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例 ②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓)
a b c d e f ③若用空气代替N2进行实验,会对实验中的SO2利用率 (选填“增大、无影响、减小”)。 (2)制备MnCO3固体: 实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;② ……;③在70-80℃下烘干得到纯净干燥的MnCO3固体。 步骤②需要用到的试剂有________。 Ⅱ.设计实验方案 (3)利用沉淀转化的方法证明KSP(MnCO3) < KSP(NiCO3):________。 (已知NiCO3为难溶于水的浅绿色固体)
|
|||
| 30. | 详细信息 |
|
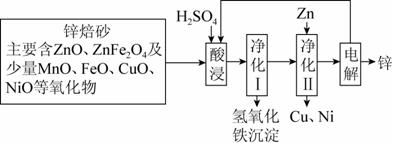
锌焙砂是锌精矿经焙烧后所得的产物,以锌焙砂为原料制取金属锌的流程如图所示。
已知:①当溶液中Zn2+浓度较大时,Zn2+优先于H+放电。 ②碱性条件下Mn(Ⅱ)可以被氧气氧化生成Mn(Ⅵ)。 请回答下列问题: (1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为_____________________________。 (2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。 ①写出酸性条件下H2O2与Fe2+反应的离子方程式:___________。 ②25 ℃时,pH=3的滤液(滤去氢氧化铁沉淀)中,c(Fe3+)=________mol·L-1(已知25 ℃时,Ksp[Fe(OH)3]=4.0×10-38)。 (3)电解硫酸锌溶液时阳极上有气体析出,写出阳极的电极反应式__________________________________________________________; 电解时不断补充电解液的目的是_________________________。 (4)电解时,阳极附近发生化学反应生成HMnO4,使得溶液变为紫红色,生成的HMnO4,又将Mn2+氧化生成MnO2,一部分二氧化锰沉于槽底形成阳极泥,另一部分附于阳极表面形成保护膜。写出HMnO4将Mn2+氧化生成MnO2的化学方程式__________________。
|
|
| 31. | 详细信息 |
|
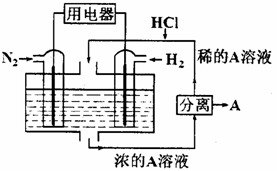
⑴己知:CH4、H2的燃烧热(△H)分别为-890.3 kJ/mol、-285.8kJ/mol,则CO2和H2反应生成CH4和H2O(l)的热化学方程式是 。 ⑵设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如右图所示。电池正极的电极反应式是_____________,A是______________。 ⑶25 ℃时,向含a mol NH4Cl的水溶液滴加b L氨水后溶液呈中性,则所滴加氨水的浓度为________mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5) ⑷甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇,反应方程式为CO(g)+2H2(g) 右下图是该反应在不同温度下CO的转化率随时间变化的曲线。 ①该反应的焓变△H_______0 (填“>”、“<”或“=”)。 ②T1和T2温度下的平衡常数大小关系是K1_______K2 (填“>”、“<”或“=”)。 ③若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离 C.使用合适的催化剂 D.充入He,使体系总压强增大
|
|
| 32. | 详细信息 |
|
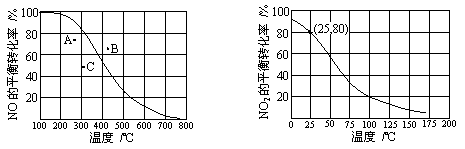
100kPa时,反应2NO(g)+O2(g)
图1 图2 ① 图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g) ② 100kPa、25℃时,2NO2(g)
|
|
| 33. | 详细信息 | ||||||
|
(1)相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、 = = 0.06(kPa)-1 p2(NO2) [100kPa×(1-66.7%)] 2 其中Ag+浓度最小的是____________。(填序号) (2)电解氯化钠可以得到多种化工原料。用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO
|
|||||||
| 34. | 详细信息 |
|
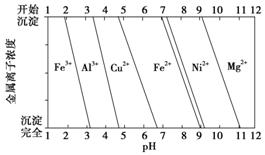
为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为 7.0、8.0 时过滤沉淀,结合下图信息推断该合金中除铜外一定含有________。
|
|