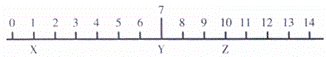2018福建高三上学期人教版高中化学高考模拟
| 1. | 详细信息 |
|
分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是( ) A.H2SO4是酸,因为H2SO4中含有氢元素
|
|
| 2. | 详细信息 |
|
下列说法不正确的是( ) A.钠、钾着火时,不能用干粉灭火器灭火 B.氧化铝是冶炼金属铝的原料,也是较好的耐火材料 C.石英是制造光导纤维的原料。也是常用的半导体材料 D.在汽车尾气系统中装催化转化器,可降低尾气中CO、NOX等的排放量
|
|
| 3. | 详细信息 |
|
现有一定量的气体如下:①标准状况下6.72LCH4、②3.01×1023个HCl分子、③13.6gH2S、④0.2molNH3,下列对这四种气体的关系从大到小排列的组合中正确的是( ) a.标况下体积:②>③>①>④ b.同温同压下的密度:②>③>④>① c.质量:②>③>①>④ d.氢原子个数:①>③>④>② A.abc B.abcd C.abd D.bcd
|
|
| 4. | 详细信息 |
|
一定条件下,中学化学常见物质甲、乙之间存在如下转化关系,则乙可能是
A.Al(OH)3 B.H2 SiO3 C.FeCl2 D.CH3 C1
|
|
| 5. | 详细信息 |
|
下列有关实验操作说法中,正确的是( ) A.配置1 L0.1 mol/L NaCl 溶液的实验中,用托盘天平称取 5.85g NaCl B.用广泛pH试纸测得橙汁pH为3.50 C.用酸式滴定管量取25.00 mL高锰酸钾溶液 D.
|
|
| 6. | 详细信息 |
|
下列有关元素性质比较正确的是( ) A.碱性:NaOH < Mg(OH)2< Al(OH)3 B.氢化物稳定性: HF>HCl>PH3 C.原子半径:S>F>O D.酸性:HClO > HNO3 > H2CO3
|
|
| 7. | 详细信息 |
|
下列关于有机物的说法,正确的是 A.将红热的铜丝迅速插入无水乙醇中可将乙醇氧化为乙醛 B.纤维素、橡胶和光导纤维都 C.乙烷、乙烯和苯都可发生加成反应 D.将乙醇和乙酸混合加热可以制备乙酸乙酯
|
|
| 8. | 详细信息 |
|
NA为阿伏伽德罗常数的值,下列说法正确的是( ) A.常温常压下28g N2所含电子数为10NA B.46g 钠充分燃烧时转移电子数 C.0.1mol/L NH4Cl溶液中NH4+离子数小于0.1NA D.密闭容器中3mol NO与1molO2充分反应,剩余气体的分子数为2NA
|
|
| 9. | 详细信息 |
|
X、Y均为元素周期表ⅦA族中的两种元素。下列叙述中,能够说明X的原子得电子能力 比Y强的是( ) A. 原子的电子层数:X> C. 气态氢化物的稳定性:X>Y D. 氧化物对应水化物的酸性:X>Y
|
|
| 10. | 详细信息 |
|
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-中的几种。①用pH试纸测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是( ) A.Na+ B.SO42- C.Ba2+ D.NH4+
|
|
| 11. | 详细信息 |
|
.向等物质的量浓度的Ba(OH)2 与BaCl2 的混合溶液中加入NaHCO3 溶液,下列离子方程式与事实相符的是( ) A.HCO3-+OH- =CO32-+H2O B.Ba2++OH-+HCO3-=BaCO3↓+H2O C.Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+H2O D.2Ba2++3OH-+3HCO3-=2BaCO3↓+CO32-+3H2O
|
|
| 12. | 详细信息 |
|
向含有5×10-3mol HIO3 与少量淀粉的溶液中通入H2S,溶液变蓝且有S析出,继续通入 H2S,溶液的蓝色褪去,则在整个过程中( ) A.共得到0.96g硫 B.通入H2S的体积为336 ml C.碘元素先被还原后被氧化 D.转移电子总数为3.0×10-2 NA
|
|
| 13. | 详细信息 |
|
侯氏制碱法中,对母液中析出NH4Cl无帮助的操作是( ) A.通入CO2 B.通入NH3 C.冷却母液 D.加入食盐
|
|
| 14. | 详细信息 | |||
|
下列装置或操作能达到实验目的的是 ( )
|
||||
| 15. | 详细信息 |
|
反应A+B →C分两步进 行:①A+B→X,②X →C,反应过程中能量变化如图所示,E1表示反应A+ B→X的活化能。下列有关叙述正确的是( ) A.E2表示反应X→C的活化能 B.X是反应A十B→C的催化剂 C.反应A十B→C的△H<0 D.加入催化剂可改变反应A十B→C的焓变
|
|
| 16. | 详细信息 |
|
汽车尾气净化中的一个反应如下:
在一容积为5L的恒容密闭容器中充人0.2 mol NO和0.5mol CO,5 min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是( ) A.达到平衡后,若只升高温度,化学平衡正向移动 B.达到平衡后,再通人稀有气体,逆反应速率增大 C.0~5 min内,NO的反应速率为2.4×1 0-3 mol·L一1·min一1 D.使用催化剂,平衡常数不变
|
|
| 17. | 详细信息 |
|
某些电子手表安装的纽扣电池由锌和氧化银、KOH溶液构成。放电时,电极反应分别为: Zn+20H--2e=Zn(OH)2 ; Ag2O+H20+2e-=2Ag+20H- 下列说法中,正确的是( ) A.锌为正极,电极上发生了氧化反应 B.放电过程中,电解质溶液的酸碱性基本保持不变 C.溶液中的OH-向正极移动,K+和H+向负极移动 D.常温下,该电池总反应为非自发的氧化还原反应
|
|
| 18. | 详细信息 |
|
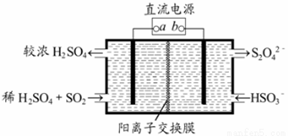
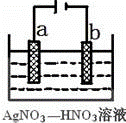
利用如图所示装置(电极均为惰性电极
A.a为直流电源的负极 B.阴极的电极反应式为:2HSO3-+2H2O+2e-=S2O42-+2OH- C.阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+ D.电解时,H+由阴极室通过阳离子交换膜到阳极室
|
|
| 19. | 详细信息 | |||
|
已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1mol·L—1的 Fe(NO3)3和Al(NO3)
A. B.
|
||||
| 20. | 详细信息 |
|
.下列说法错误的是( ) A.实验室配制FeCl3溶液时,需将FeCl3 (s)溶解在较浓盐酸中,然后加水稀释 B.反应2CO+2NO = N2+2CO2在常温下能自发进行,则反应的 C.0.1mol·L-1NH4Cl溶液加水稀释,c(H+)/c(NH4+)的值增大 D.反应CH3COOCH3+H2O
|
|
| 21. | 详细信息 |
|
铝、铍及其化合物具有相似的化学性质,已知反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是( ) A.Be (OH)2既能溶于盐酸,又能溶于NaOH溶液 B.BeCl2水溶液的导电性强,故BeCl2是离子化合物 C.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO D.BeCl2溶液的pH>7,将其蒸干并灼烧后得到的残留物是BeCl2
|
|
| 22. | 详细信息 |
|
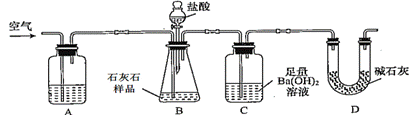
为测定石灰石样品中碳酸钙(含SiO2杂质)的含量。现利用下图所示装置进行实验,充分反应后,测定装置C中生成的BaCO3沉淀质量。下列说法正确的是( )
A.装置A中药品应为浓硫酸 B.在B—C之间应增添盛有饱和NaHCO3溶液的洗气装置,以除去氯化氢气体 C.为了测得C中生成的沉淀质量,需经过过滤、洗涤、干燥、称量等操作 D.只要测定装置C在吸收CO2前后的质量差,也可以确
|
|
| 23. | 详细信息 | |||
|
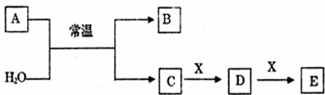
.A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色。写出C和E反应的离子方程式: __________________. (2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则: X可能为 (填代号)。 a.NaHCO3 b.Na2CO3 c.NaHSO3 d.Al(OH)3 (3)若A为淡黄色粉末,回答下列问题: ①A与水反应时形成的化学键类型有_____________________。 ②若X为一种造成温室效应的气体.则鉴别等浓度的D、E两种溶液,可选择的试剂为______(填代号)。 a.盐酸 b.加热溶液 c.NaOH溶液 d.Ca(OH)2溶液 (4)若A为气态氧化物,X是Fe,溶液D中加入KSCN溶液变红. 则A与H2O反应的化学反应方程式为_________________;E是 (填化学式)。
|
||||
| 24. | 详细信息 | ||||||||||||
|
(1)X、Y、Z三种液体的近似pH如图,下列判断正确的是___________。
A.X一定是酸或强酸弱碱盐溶液 B.Y一定是90℃时的纯水 C.Y液体一定呈中性 D.Z可能是Na2SiO3溶液 (2)物质的量浓度相同的三种溶液:①NH4Cl②氨水③NH4HSO4,c(NH4+)大小顺序正确的 是___________。 A.①>②>③ B.③>①>② C.②>③>① D.③>②>① (3)比较填空(选填“>"或“ <"或"=”) ①常温下两种溶液:a.pH=4盐酸 b.pH=4NH4Cl溶液,其中水的电离程度大小:a__________b。
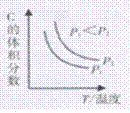
(4)在一定体积的密闭容器中加入1molCO2和1mol H2,进行如下化学反应:CO2(g)+ H2(g)
回答下列问题: ①该反应的化学平衡常数表达式为K=__________________________。 ②反应为___________反应(填“吸热”或“放热”)。 ③800℃,向容器内充入lmolCO2、lmolH2、lmol CO、lmolH2O,此刻反应的v正_______v逆(填“>"或“<”或“=”)
|
|||||||||||||
| 25. | 详细信息 | |||
|
砷为VA族元素,金属冶炼过程产生的含砷有毒废水需处理与检测。 I.已知:As(s)+ H2(g)+ 2As(s)+ 则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_______________。 II.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工
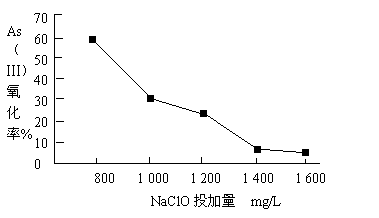
②亚砷酸盐的溶解性大于相应砷酸盐。 (1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为________________。 (2)“一级沉砷”中FeSO4的作用是 ______________________ ; “二级沉砷”中H2O2与含砷物质反应的化学方程式为 __________________ 。 III..去除水体中的砷,将As(Ⅲ)转化为As(Ⅴ),也可选用NaClO实现该转化。研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:
已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸。产生此结果的原因是 ________________________ 。
|
||||
| 26. | 详细信息 | |||||||||||
|
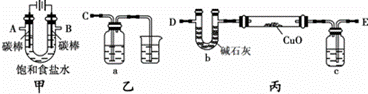
完成下列填空: 某化学小组拟采用如下装置(夹持和加热仪器等已略去)来电解饱和食盐水,并用电解产生的 H2 还原 CuO 粉末来测定 Cu 的相对原子质量,同时验证氯气的氧化性。
完成下列填空: (1) 写出甲装置中反应的化学方程式____________________________________________。 (2) 为完成上述实验,正确的连接顺序为 A 连___ (3)乙装 (4) 测定 Cu 的相对原子质量。将w g CuO 置于硬质玻璃管中,按以下两个方案测得的数据计算 Cu 的相对原子质量
你认为较佳方案是_____________,另一个方案得到的 Cu 的相对原子质量会__________(选填“偏低”、或“偏高”)
|
||||||||||||
| 27. | 详细信息 |
|
金属冶炼和处理常涉及氧化还原反应。
极为含有杂质的粗银,若b极有少量红棕色气体生成, 则生成该气体的电极反应式为 。
|
|