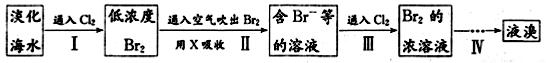2016江苏高三下学期苏教版高中化学月考试卷
| 1. | 详细信息 |
|
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是 A.植物油不能使溴水褪色 B.淀粉水解的最终产物是葡萄糖 C.葡萄糖、蔗糖都能水解 D.蛋白质溶液中滴加硝酸汞溶液后可发生盐析
|
|
| 2. | 详细信息 |
|
下列属于同位素的一组是 A. H2O和D2O B. 金刚石和石墨 C. 氕、氘、氚 D. 40K、40Ca
|
|
| 3. | 详细信息 |
|
下列关于油脂的叙述不正确的是( )。 A.油脂属于混合物 B.油脂密度比水小,不溶于水,会浮于水的上层 C.油脂在酸性或碱性条件下都比在纯水中难水解 D.各种油脂水解后的产物中都有甘油
|
|
| 4. | 详细信息 |
|
已知NO2和N2O4可以相互转化:2NO2
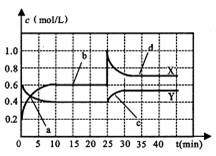
A.曲线Y表示NO2浓度随时间的变化 B.a点表示化学反应处于平衡状态 C.c点表示v生成(NO2)< v消耗(NO2) D.25min时,曲线发生变化的原因是缩小了容器的体积
|
|
| 5. | 详细信息 |
|
下列图示与对应的叙述相符的是( )
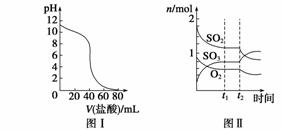
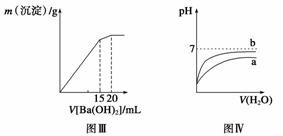
A.图Ⅰ表示常温下盐酸滴加到0.1 mol·L-1某碱溶液中得到的滴定曲线,由图Ⅰ可知二者恰好中和时,所得溶液的pH>7 B.图Ⅱ表示一定条件下进行的反应2SO2+O2 C.图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时,沉淀全部是BaSO4 D.图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸
|
|
| 6. | 详细信息 |
|
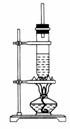
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115℃~125℃,反应装置如图。下列对该实验的描述错误的是
A.不能用水浴加热 B.长玻璃管起冷凝回流作用 C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 D.加入过量乙酸可以提高1-丁醇的转化率
|
|
| 7. | 详细信息 |
|
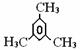
下列有机化合物中,其一氯代物种类最少的是 A. C.
|
|
| 8. | 详细信息 |
|
下列关于浓硝酸和浓硫酸说法不正确的是( ) A.浓硝酸和浓硫酸在空气中久置,酸溶液的浓度都会降低 B.和铜反应中都表现出强氧化性和酸性 C.浓硝酸常保存在棕色试剂瓶中 D.浓硫酸不可干燥氨气、二氧化硫等气体
|
|
| 9. | 详细信息 | |||||||||||||||
|
下列实验操作与预期实验目的或所得实验结论一致的是
|
||||||||||||||||
| 10. | 详细信息 |
|
1919年卢瑟福用α粒子( A.该过程属于化学变化 B.α粒子是He元素的一种核素 C.
|
|
| 11. | 详细信息 |
|
将一小块钠投入下列溶液中,既能产生气体又出现白色沉淀的是 A.稀硫酸 B.氢氧化钠溶液 C.硫酸铜溶液 D.氯化镁溶液
|
|
| 12. | 详细信息 |
|
对于可逆反应2A(g)+3B(g) A.各物质的量浓度之比为c(A) : c(B) : c(C)=2 : 3 : 3 B.平衡混合物体积是反应开始前的3/5 C.平衡混合物中各物质的量浓度相等 D.单位时间内,若消耗了a mol A物质,则同时也消耗了1.5a mol C物质
|
|
| 13. | 详细信息 |
|
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 D.氨气分子是极性分子而甲烷是非极性分子。
|
|
| 14. | 详细信息 |
|
下列涉及有机物的性质或应用的说法不正确的是 A.干馏煤可以得到甲烷、苯和氨等重要化工原料 B.用于奥运“祥云”火炬的丙烷是一种清洁燃料 C.葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 D.蛋白质和油脂都是能发生水解反应的高分子化合物
|
|
| 15. | 详细信息 |
|
下列离子方程式正确的是( ) A.向氢氧化钡溶液中加硫酸溶液 Ba2+ + SO42- B.用食醋与苏打溶液反应(主要成分是碳酸钠) 2CH3COOH + CO32- C.石灰乳与碳酸钠溶液混合Ca2+ + CO32- D.氧化铁溶于稀硝酸 Fe2O3 + 6H+
|
|
| 16. | 详细信息 |
|
用离子方程式表示下列变化过程 (1)除去铁粉中混有铝粉_____________________________________。 (2)除去二氧化碳中的氯化氢气体_____________________________。 (3)二氧化硅固体中含有碳酸钙_______________________________。 (4)盛放氢氧化钠溶液的试剂瓶不用玻璃塞原因_________________。 (5)用稀盐酸清洗铜器皿表面上的铜绿__________________________。
|
|
| 17. | 详细信息 |
|
常温下有浓度均为0.5 mol·L-1的四种溶液:①Na2CO3、②NaHCO3、③HCl、④NH3·H2O。 (1)上述溶液中,可发生水解的是_______(填序号,下同)。 (2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为__________。 (3)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填“增大”“减小”或“不变”)。 (4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是 ________ 。 (5)以10 mL溶液③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。
|
|
| 18. | 详细信息 |
|
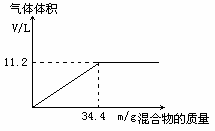
在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,下图表示加入的混合物的质量和产生气体的体积(标准状况)关系。
(1)试计算NaOH溶液的物质的量浓度。 (2)当NaOH溶液的体积为140mL,固体混合物的质量为51.6g,充分反应后,生成气体的体积(标准状况)为多少升? (3)当NaOH溶液的体积为180mL,固体混合物的质量仍为51.6g,充分反应后,生成气体的体积(标准状况)为多少升?
|
|
| 19. | 详细信息 |
|
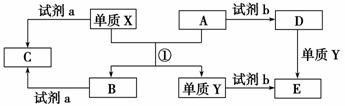
I.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X,Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。 (1)请写出M的元素符号: ____________,Z的原子结构示意图: ____________。M与X两元素可形成两种液态化合物,其化学式分别为 。 (2)请写出N元素在周期表中的位置 ;与N同族的短周期元素L,其最高价氧化物的电子式为 。 (3)Y与Z相比,非金属性较强的元素是________,(填元素符号)可以证明该结论的实验事实是 。 II.下列转化关系中,X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A为红棕色固体,C、D、E是中学常见的三种化合物。分析转化关系回答问题。
(1)请写出反应①的化学方程式:________________________________。 (2)由D到E的离子方程式_________________________________。 (3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式 。 (4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制取高效净水剂Y(OH)SO4,已知还原产物为NO,则该反应的化学方程式是________________________________。 (5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 L,则阴极产物的质量为______________。
|
|
| 20. | 详细信息 | ||||||||||||
|
(一)酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。某学生用0.1032 mol·L-1的氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: (A)移取25.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞 (B)用标准溶液润洗滴定管2-3次 (C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液 (D)取标准NaOH溶液注入碱式滴定管至0刻度以上2-3cm (E)调节液面至0或0刻度以下,记下读数 (F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度 完成以下填空: (1)正确操作的顺序是(用序号字母填写)______________________。 (2)重复三次的实验数据如下表所示:
则待测HCl的物质的量浓度是________mol·L-1。 (3)滴定至终点的现象是 。 (4)下列操作中可能使所测盐酸的浓度数值偏低的是 。 A.碱式滴定管未用标准溶液润洗就直接注入标准液 B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥 C.碱式滴定管在滴定前有气泡,滴定后气泡消失 D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数 (5)若用同浓度的氨水与同浓度的盐酸混合至二者恰好完全中和时,该溶液中离子浓度大小关系为 。 (二)从海水中提取溴的工业流程如图:
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是 。 (2)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式: 。
|
|||||||||||||
| 21. | 详细信息 |
|
工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝.工艺流程如下图所示: (已知:NaCl熔点为801℃;AlCl3在181℃升华)
(1)钢材镀铝后,抗腐蚀性能会大大增强,其原因是 . (2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去.气泡的主要成分除Cl2外还含有 ,固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在 . (3)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 . (4)向滤液中通入过量CO2所发生反应的离子方程式为 . (5)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4﹣形式存在,则阳极的电极反应式为 .
|
|
| 22. | 详细信息 |
|
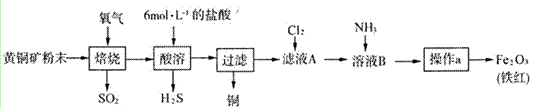
黄铜矿的主要成分是CuFeS2(硫元素显—2价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
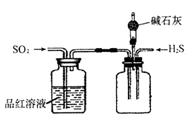
已知:CuFeS2+O2 (1)在实验室中,应将黄铜矿粉末放在_____(填仪器名称)中焙烧。 (2)将反应过程中产生的SO2和H2S通入下图所示装置中检验它们的性质。该实验证明SO2具有_________性和__________性。
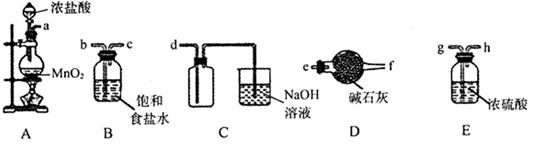
(3)欲选用下列部分装置在实验室中以MnO2和浓盐酸为原料制取纯净、干燥的氯气。
①圆底烧瓶中发生反应的离子方程式为_________________________________________。 ②按气流方向由左到右,导管口连接顺序为a→________________________________。 ③装置连接好后,需要进行的操作是_________________。 (4)若铁红Fe2O3样品中含有FeO,选用提供的试剂,设计实验验证铁红中含有FeO。写出有关实验操作、现象与结论。_____________________________________。 提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、氯水。
|
|
| 23. | 详细信息 |
|
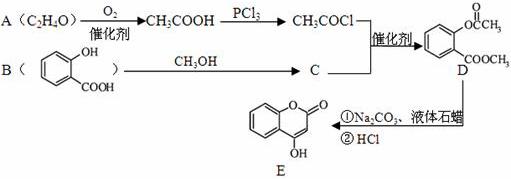
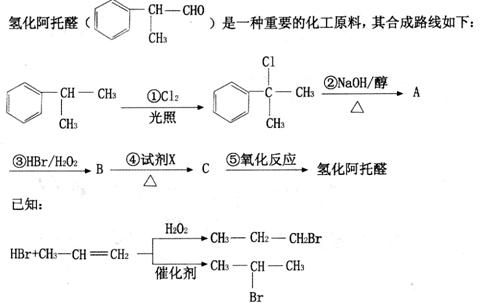
化合物E是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成:
(1)B中含有的含氧官能团名称为 。 (2)C转化为D的反应类型是 。 (3)写出D与足量NaOH溶液完全反应的化学方程式 。 (4)1molE最多可与 molH2加成。 (5)写出同时满足下列条件的B的一种同分异构体的结构简式 。 A.能发生银镜反应 B.核磁共振氢谱只有4个峰 C.能与FeCl3溶液发生显色反应,水解时1mol可消耗3molNaOH (6)已知工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化。甲苯可被酸性高锰酸钾溶液氧化为苯甲酸。 苯甲酸苯酚酯( 合成路线流程图示例如下:
|
|
| 24. | 详细信息 |
|
回答下列问题: (1)氢化阿托醛所含官能团的名称为____________。 (2)下列有关氢化阿托醛的说法正确的是_________。 A.分子式为C9H12O B.与新制Cu(OH)2悬浊液加热生成砖红色沉淀 C.能发生加成、取代、氧化反应 D.1 mol氢化阿托醛最多可与3 mol H2反应 (3)写出反应③的化学方程式:_____________。 (4)④中所用试剂X为____________,④的反应类型是_________________。 (5)氢化阿托醛具有多种同分异构体,写出符合下列特征的同分异构体的结构简式:_____________(写出一种即可)。 ①苯环上有两个取代基 ②苯环上的一溴代物只有两种 ③其水溶液遇FeCl3溶液呈特征颜色 ④能发生加聚反应
|
|
 B
B