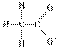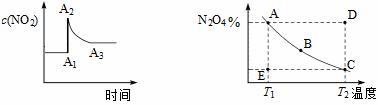2018福建高二上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列生活中的化学现象解释不正确的是 A.生石灰可作食品速热剂是利用原电池原理 B.泡沫灭火器是运用双水解原理产生CO2 C.铝盐可作净水剂是利用铝离子水解产生胶体 D.将煤气中毒的人移到通风处,是运用平衡理论
|
|
| 2. | 详细信息 |
|
下列数据不一定随着温度升高而增大的是 A.盐类水解常数Kh B.弱电解质的电离平衡常数K C.化学平衡常数K D.水的离子积Kw
|
|
| 3. | 详细信息 |
|
25℃时,纯水中存在的平衡:H2O A.将水加热,Kw增大,pH不变 B.加入稀盐酸,平衡逆向移动,c(H+)降低 C.加入氢氧化钠溶液,平衡逆向移动,Kw变小 D.加入少量固体CH3COONa,平衡正向移动,c(H+)降低
|
|
| 4. | 详细信息 |
|
下列叙述正确的是 A.金属腐蚀就是金属失去电子被还原的过程 B.铜板上的铁铆钉在潮湿的空气中直接发生反应:Fe- 3e- = Fe3+,继而形成铁锈 C.将水库中的水闸(钢板)与直流电源的负极相连接,可防止水闸被腐蚀 D.合金的熔点高于它的任何一种金属成分
|
|
| 5. | 详细信息 | |||
|
A.H+ B.26M3+ C. D.
|
||||
| 6. | 详细信息 |
|
常温下,将浓度为0.1mol/L NaF溶液加水稀释的过程中,下列各量始终保持增大的是 A.c(OH-) B.c(Na+) C.c(F-)/c(OH-)
|
|
| 7. | 详细信息 |
|
相同温度下,四种物质的量浓度相等的溶液中,c(NH A.NH3·H2O B.NH4Cl C.CH3COONH4 D.NH4Al(SO4)2
|
|
| 8. | 详细信息 |
|
25℃,由水电离产生的[H+]= 10-13mol/L的溶液中,下列各组离子一定能大量共存的是 A.Na+、Cu2+、NO3-、CH3COO- B. K+、Na+、Cl-、SO42- C.K+、CO32-、NO3-、[Al(OH)4]- D. Na+、Fe2+、NO3-、Cl-
|
|
| 9. | 详细信息 |
|
对于反应 A.恒容下通入He B.恒容下增大
|
|
| 10. | 详细信息 |
|
下列溶液蒸干并灼烧,最后得到固体是溶质本身的是 A.CuSO4 B.NaHCO3 C.KMnO4 D.FeCl3
|
|
| 11. | 详细信息 |
|
用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是 A.AgNO3[AgNO3] B.NaOH[NaOH] C.KCl[H2O] D.CuSO4[CuO]
|
|
| 12. | 详细信息 |
|
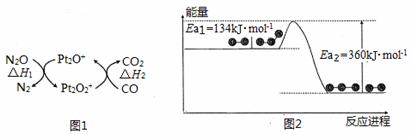
N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为: N2O(g)+CO(g)
A.由图1可知:△H1=△H+△H2 B.由图2可知△H = -226 kJ·mol-1 C.为了实现转化需不断向反应器中补充Pt2O+和Pt2O2+ D.由图2可知该反应正反应的活化能大于逆反应的活化能
|
|
| 13. | 详细信息 |
|
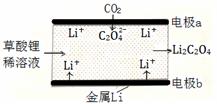
一种新型的“锂-呼吸CO2电池”,结构如图所示,下列说法不正确的是 A.该装置是化学能转变为电能 B.利用该技术可减少温室气体CO2的排放 C.正极的电极反应为:2CO2 + 2e- = C2O42- D.每生成10.2g Li2C2O4,有0.2mol Li+从正极迁移至负极
|
|
| 14. | 详细信息 |
|
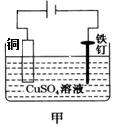
下列关于图示四个装置的叙述不正确的是
A.装置甲是可以在铁钉上镀铜的装置 B.装置乙若为电解精炼铜装置,则X电极为精铜 C.装置丙的a端产生的气体能使湿润的淀粉碘化钾试纸变蓝 D.装置丁可用于测定化学反应的反应热
|
|
| 15. | 详细信息 |
|
下列有关说法正确的是 A. 用广泛pH试纸测得某酸溶液的pH为2.3 B. 对于2HI(g) C. 在一定温度和压强下,将0.5mol N2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ,则其热化学方程式为N2(g)+3H2(g) D. 一定条件下2SO2(g)+O2(g) 则△H1>△H2
|
|
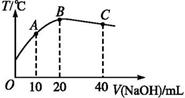
| 16. | 详细信息 | ||||||||||||
|
常温下,将一定浓度的HA和HB分别与0.10 mol·L-1的NaOH溶液等体积混合,记录数据如下表,下列说法中正确的是
A.HA是强酸,HB是弱酸 B.溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+) C.溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol·L-1 D.升高温度,溶液②中
|
|||||||||||||
| 17. | 详细信息 |
|
在密闭容器中,反应2NO2(g)
图a 图b A.图a 中,A1→A2变化的原因一定是充入了NO2 B.图b中,E点对应状态中,v(正)> v(逆) C.图b中,E→A所需的时间为x,D→C所需时间为y,则x < y D.依据图b分析可知,该化学反应△H>0
|
|
| 18. | 详细信息 |
|
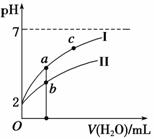
向20 mL 0.5 mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶的温度变化如图所示。下列关于混合溶液的相关说法中错误的是 A.醋酸的电离平衡常数:B点>A点 B.由水电离出的c(OH-):B点>C点 C.从A点到B点,混合溶液中可能存在: c(CH3COO-)=c(Na+) D.从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
|
|
| 19. | 详细信息 |
|
化学反应原理在生活及工业中运用广泛。 (1)氮氧化物排放是形成臭氧层空洞重要成因之一,氮氧化物破坏臭氧层原理为: i. NO+O3 则反应O3+O (2)N2H4是火箭发射的助燃剂。N2H4与氨气相似,溶于水生成弱碱N2H4·H2O,写出N2H4·H2O的电离方程式 。 (3)已知t ℃时,KW=1×10-13,则t ℃ 25℃(填“>”、“<”或“=”)。在t ℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=________。
|
|
| 20. | 详细信息 | ||||||||||
|
亚硝酸(HNO2)为一元弱酸,其性质与硝酸相似。 已知:298K时,四种物质的电离平衡常数(K)如下表。
(1)下列不能说明HNO2是弱电解质的是 。 A.常温下0.1 mol·L-1 NaNO2溶液的pH>7 B.用一定浓度HNO2溶液做导电实验,灯泡很暗 C.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多 D.常温下,0.1mol·L-1 HNO2溶液的pH=2.3 (2)298K时,将10mL 0.1mol·L-1的亚硝酸溶液与10mL 0.1mol·L-1氨水混合,所得溶液为 (填“酸性”、“碱性”或“中性”),原因是 。
(用a、b、c表示,下同);溶液中水的电离程度由强到弱的顺序是 。 (4)依据提供数据回答下列问题。 ①求298K时,NaHSO3溶液中HSO3-水解平衡常数Kh = ;由此可判断HSO3-水解程度 电离程度(填“>”、“<”或“=”)。 ②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。 (5)298K时,向含有2mol Na2CO3的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是 。
|
|||||||||||
| 21. | 详细信息 | ||||
|
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
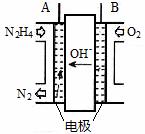
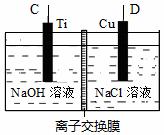
(1)已知:2Cu(s) + 1/2 O2(g) = Cu2O(s) △H = -169KJ/mol C(s) +1/2 O2(g) = CO(g) △H= -110.5kJ/mol Cu(s) + 1/2 O2(g) = CuO(s) △H = -157kJ/mol 则方法Ⅰ反应的热化学方程式为 。 (2)方法Ⅱ采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。
图甲 图乙 ①上述装置中D电极应连接肼燃料电池的 极(填“A”或“B”),该电解池中离子交换膜为 离子交换膜(填“阴”或“阳”)。 ②该电解池的阳极反应式为 ,肼燃料电池中A极发生的电极反应为 。 ③当反应生成14.4 g Cu2O时,至少需要肼______mol。
|
|||||
| 22. | 详细信息 | ||||||||||||
|
用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) (1)写出上述反应的平衡常数表达式 。 (2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
①结合表中数据,判断该反应的△H 0(填“>”或“<”),理由是 。 ②判断该反应达到平衡的依据是 。 A.容器内气体密度恒定 B.容器内各气体浓度恒定 C.容器内压强恒定 D.2v正(NO)= v逆(N2) (3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:
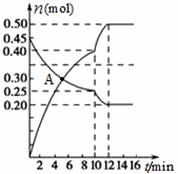
①0~10 min内的CO2平均反应速率v= 。 ②图中A点v(正) v(逆)(填“>”、“<”或“=”)。 ③第10 min时,外界改变的条件可能是 。 A.加催化剂 B.增大C的物质的量 C.减小CO2的物质的量 D.升温 E.降温
|
|||||||||||||