2018甘肃高二上学期人教版高中化学期末考试
| 1. | 详细信息 |
|
下列物质的水溶液因水解而呈碱性的是( ) A.NH3·H2O B.NaHCO3 C.Ba(OH)2 D.NH4Cl
|
|
| 2. | 详细信息 |
|
不能证明一元酸HA为弱酸的是( ) A.相同条件下HA溶液的导电性弱于盐酸 B.0.1mol/L的HA溶液pH为3 C.HA溶液中滴加石蕊显红色 D.NaA溶液显碱性
|
|
| 3. | 详细信息 |
|
碱性锌锰干电池的总反应方程式可以表示为:Zn+2MnO2+2H2O==Zn(OH)2+2MnOOH 此电池 放电时,正极上发生反应的物质是( ) A.碳棒 B.MnO2和H2O C.Zn D.MnO2
|
|
| 4. | 详细信息 |
|
如图是课外活动小组设计的用化学电源使LED灯发光装置。下列说法不正确的是( )
C.如果将硫酸换成橙汁,导线中不会有电子流动 D.装置中存在“化学能→电能→光能”的转换
|
|
| 5. | 详细信息 |
|
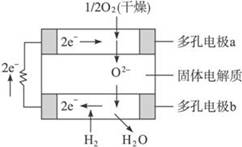
固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体 电解质在高温下允许O2-在其间通过。该电池的工作原理如下图所 示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
②a极对应的电极反应式为O2+2H2O+4e-==4OH- ③b极的电极反应式为H2-2e-+O2-==H2O ④该电池的总反应式为2H2+O2
|
|
| 6. | 详细信息 |
|
有等体积、等pH的Ba(OH)2、KOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
|
|
| 7. | 详细信息 |
|
如图所示,将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中, 最先观察到变为红色的区域为( ) A.Ⅰ和Ⅱ B.Ⅱ和Ⅲ C.Ⅰ和Ⅳ D.Ⅱ和Ⅳ
|
|
| 8. | 详细信息 |
|
有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3,下列各项排序正确的是( )
|
|
| 9. | 详细信息 |
|
已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是( )
|
|
| 10. | 详细信息 |
|
用惰性电极电解R(NO3)n的水溶液,当一个电极上增重m g时,在另一电极上产生V L(标准状况)气体,则R的相对原子质量为( ) A. B. C. D.
|
|
| 11. | 详细信息 | |||
|
室温下向10mL、0.1mol/L的NaOH溶液中加入0.1mol/L的HA溶液, 溶液pH的变化曲线如图所示。下列说法正确的是( ) A.pH=7时,c(Na+)= c(A-)+c(HA) B.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) C.b点所示溶液中:c(A-)>c(HA) D.a、b两点所示溶液中水的电离程度相同
|
||||
| 12. | 详细信息 |
|
下列叙述正确的是( ) A.工业上电解熔融的Al2O3冶炼铝用铁做阳极 B.用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1molNaOH
D.用碳棒做电极电解CuSO4溶液一段时间后,加入Cu(OH)2固体可以使CuSO4溶液恢复原来浓度
|
|
| 13. | 详细信息 |
|
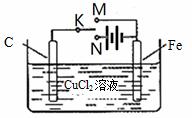
某学习小组为研究电化学原理,设计右图装置。下列叙述正确的是( ) A.K与M相连时,每转移1mol电子Fe表面生成32gCu B.K与N相连时,碳棒上产生使湿润的淀粉-KI试纸变蓝的气体 C.K分别与M、N相连时,铁均受到保护 D.K与M、N均断开,一段时间后电解质溶液质量变大
|
|
| 14. | 详细信息 |
|
常温下,下列溶液中各离子浓度关系表述正确的是( ) A.向NH4HSO4溶液中逐滴加入NaOH溶液至中性,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-) B.等物质的量浓度的Na2CO3和NaHCO3混合溶液中c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) C.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中c(Na+)-c(F-)<c(K+)-c(CH3COO-) D.在0.1mol/L的Na2S溶液中c(H+)+c(HS-)+c(H2S)=c(OH-)
|
|
| 15. | 详细信息 |
|
用石墨作电极电解100mLAgNO3溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原AgNO3溶液的物质的量浓度为( ) A.3mol·L-1 B.2mol·L-1 C.1.5mol·L-1 D.1mol·L-1
|
|
| 16. | 详细信息 |
|
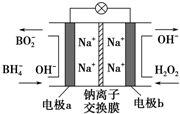
据报道,以NaBH4(B为+3价)和/H2O2做原料的新型燃料电池可用作
应式为:NaBH4+4H2O2=NaBO2+6H2O,下列的说法正确是( ) A.放电过程中,Na+从右向左迁移 B.a为正极,其电极反应为:BH4--8e-+8OH-=BO2-+6H2O C.b电极的电极反应式为:H2O2+2e-+2H+=2H2O D.每消耗300g、34%的H2O2溶液,理论上流过电路中的电子数为6NA个
|
|
| 17. | 详细信息 | |||
|
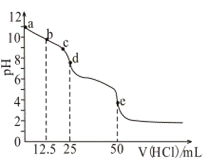
常温下,用0.1mol/L的盐酸滴定0.1mol/L的Na2CO3溶液25mL。
测得溶液pH变化曲线如图,下列说法正确的是( ) A.b点时,c(CO32-)>c(HCO3-)>c(OH-) B.d点时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) C.e点时,c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) D.c→d发生的主要离子反应:H++HCO3-=CO2↑+H2O
|
||||
| 18. | 详细信息 |
|
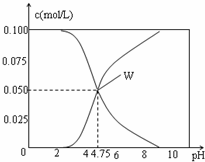
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组 CH3COOH、CH3COONa的混合溶液,溶液中c(CH3COOH)、 c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子 浓度关系的叙述正确的是( ) A.pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol/L B.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) C.W点所表示的溶液中:c(H+)=c(CH3COOH)+c(OH-) D.向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略): C(H+)=c(CH3COOH)+c(OH-)
|
|
| 19. | 详细信息 |
|
常温下,将0.1molCH3COONa和0.05molHCl溶于水配成1L溶液(pH<7). (1)用离子方程式表示该溶液中存在的三个平衡体系____ 、 、 (2)溶液中各离子的物质的量浓度由大到小顺序为 (3)溶液中粒子中浓度为0.1mol/L的是______ _,浓度为0.05mol/L的是 (4)物质的量之和为0.lmol的两种粒子是 与 (5)CH3COO-和OH-的物质的量之和比H+多 mol
|
|
| 20. | 详细信息 |
|
工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解 后,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.回答下列问题: (1)为除去溶液中的Fe2+,可先加入______(填化学式)将Fe2+氧化为Fe3+,反应的离子方程式为__________,然后然后再加入适量的__________调整溶液的pH到______,使Fe3+转化为Fe(OH)3。 (2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1×10-38,Cu(OH)2的溶度积 Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3mol•L-1,则Cu(OH)2开始沉淀时溶液的pH为______,Fe3+完全沉淀时溶液的pH为______,通过计算确定上述方案______ (填“可行”或“不可行”)。
|
|
| 21. | 详细信息 |
|
盐在化学工业中有重要的应用,请回答下列问题: (1)用化学方程式表示配制FeCl3溶液时常加入浓盐酸的原因 (2)常温下,在pH=3的Al2(SO4)3溶液与pH=11的Na2S溶液中,水电离出来的c(OH﹣)之比为 ,将两溶液混合后,产生白色沉淀和有臭鸡蛋味的气体,其反应的离子方程为 (3)c(NH4+)相等的下列溶液①NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4 ⑤NH3·H2O,溶液的物质的量浓度由小到大的顺序是 (用序号表示)
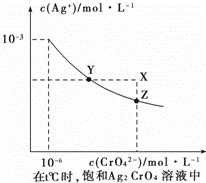
水中的沉淀溶解平衡曲线如图所示.下列正确的是 A.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点 B.在t℃时Ag2CrO4的Ksp为1×10-12 C.在t℃时反应:Ag2CrO4(s)+2Cl-(aq) 的平衡常数为2.5×107 0.01mol/L的KCl和K2CrO4的混合溶液,CrO42-先沉淀
|
|
| 22. | 详细信息 |
|
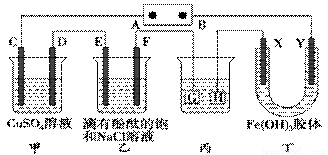
Y极附近的颜色逐渐变深,这表明Fe(OH)3胶体微粒带 荷。 量之比为 ,乙中发生反应的化学方程式为___ __, 若要使电解后的甲装置中的溶液恢复到原浓度则需加入一定量的______ (填化学式)。 甲、乙中溶液的pH分别为_____和_____
|
|
| 23. | 详细信息 |
|
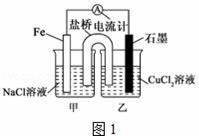
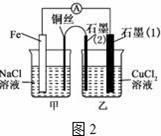
(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应 的离子方程为 反应前两电极质量相等,一段时间后,两电极质量相差15g,导线 中通过 mol电子. (2)如图1,其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨
(3)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成∩型,则 乙装置中石墨电极(1)为 极,甲装置中铜电极上电极反应式为 (4)如图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质 量增重1.28g,则此时溶液的pH为
|
|