2017河北高二下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
化学与生产生活密切相关,下列有关说法不正确的是 A. 大量使用含磷洗衣粉会造成生活污水的富营养化 B. 用未经处理的电镀厂废水灌溉农田,易造成土壤重金属污染 C. 臭氧一生物活性炭用于自来水深度处理,利用了活性炭的还原性 D. 纳米铁粉可将地下水中的NO3-转化为N2,是因为纳米铁具有还原性
|
|
| 2. | 详细信息 |
|
《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病。下列有关这三种气体的说法正确的是
A. 都是电解质 B. 都易溶于水... C. 都能与碱溶液反应 D. 都属于共价化合物
|
|
| 3. | 详细信息 |
|
下列反应的离子方程式书写正确的是 A. 金属铝溶于稀硫酸中:Al+2H+=Al3++H2↑ B. 铜片溶于稀硝酸产生无色气体:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O C. 向NaClO溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3- D. 用惰性电极电解CuSO4溶液:2Cu2++2H2O
|
|
| 4. | 详细信息 |
|
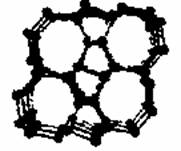
近年来美国研究人员合成了光伏电池新型硅材料——Si24(如图所示)。下列相关说法正确的是
A. Si24是一种新型化合物 B. Si24是硅的一种同素异形体 C. Si24易与稀硫酸反应生成氢气 D. 硅太阳能电池供电原理与原电池相同
|
|
| 5. | 详细信息 |
|
下列物质不能通过化合反应制得的是 A. NO2 B. Fe(OH)3 C. H2SiO3 D. Cu2S
|
|
| 6. | 详细信息 |
|
下列各组离子在溶液中能大量共存的是 A. H+、Fe2+、Cl-、NO3- B. Mg2+、K+、OH-、Cl- C. NH4+、Ca2+、NO3-、CO32- D. K+、H+、Cl-、SO42-
|
|
| 7. | 详细信息 | |||||||||||||||
|
下列物质的用途不正确的是
A. A B. B C. C D. D
|
||||||||||||||||
| 8. | 详细信息 |
|
下列过程没有发生化学反应的是 A. 用消毒液杀灭游泳池中的藻类 B. 用CaCl2融化路面的积雪 C. 用石灰修复被酸雨浸蚀的土壤 D. 用催化剂将汽车尾气中的CO和NO转化为无害物质
|
|
| 9. | 详细信息 |
|
设NA为阿伏加德罗常数的数值。下列有关叙述正确的是 A. 16g由O2和O3组成的混合气体中的氧原子数为2NA B. 1molN2与足量H2充分反应生成NH3的分子数为2NA C. 1mol Fe溶于过量稀硝酸,转移的电子数为3NA D. 标准状况下,2.24L苯中含有的原子数为1.2NA
|
|
| 10. | 详细信息 |
|
工业生产中需对空气中的CO进行监测,粉红色的PdCl2溶液可以检验空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀(反应中只有PdCl2作氧化剂)。每生成5.3gPd沉淀,反应转移的电子数为 A. 0.05 NA B. 0.1 NA C. 0.2 NA D. 0.4 NA
|
|
| 11. | 详细信息 |
|
明朝《菽园杂记》有海水提取食盐的记载:“烧草为灰,布在滩场,然后以海水渍之,俟晒结浮白,扫而复淋”。该过程中“灰”的作用是 A. 萃取 B. 吸附 C. 结晶 D. 蒸发
|
|
| 12. | 详细信息 | ||||||||||||||||||||
|
下列各组物质中,常温下Y既能与X反应又能与Z反应的是
A. A B. B C. C D. D
|
|||||||||||||||||||||
| 13. | 详细信息 |
|
Fe3+、SO42+、Mg2+、和X四种离子以物质的量之比2:3:2:4大量共存于同一种溶液中,X可能是 A. NH4+ B. OH- C. CO32- D. Cl-
|
|
| 14. | 详细信息 |
|
下列关于物质性质与应用因果关系的说法正确的是 A. 二氧化碳具有氧化性,在点燃的条件下能将金属镁氧化 B. 锌具有还原性和导电性,可作锌锰干电池的正极材料 C. 二氧化氯具有还原性,可用于自来水的杀菌消毒 D. 氧化铁具有较强的氧化性,可作H2O2分解的氧化剂
|
|
| 15. | 详细信息 |
|
O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2。下列说法正确的是 A. 氧气是氧化产物 B. O2F2既是氧化剂又是还原剂 C. 若生成0.1molHF,则转移0.8mol电子 D. 还原剂与氧化剂的物质的量之比为1:4...
|
|
| 16. | 详细信息 |
|
BaCl2溶液中通入SO2气体,没有沉淀生成。再通入或加入某物质后,有沉淀生成,则该物质不可能为 A. HCl B. NO2 C. NH3 D. FeC13
|
|
| 17. | 详细信息 |
|
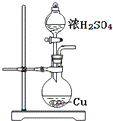
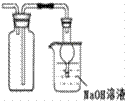
探究浓硫酸和铜的反应时,下列有关装置的说法中正确的是
甲 乙 丙 丁 A. 用装置甲进行铜和浓硫酸的反应 B. 用装置乙收集二氧化硫并吸收尾气 C. 用装置丙稀释反应后的混合液 D. 用装置丁测定余酸的浓度
|
|
| 18. | 详细信息 |
|
下列物质的转化在给定条件下能实现的是 A. Na C. SiO2
|
|
| 19. | 详细信息 |
|
下列关于实验的叙述中正确的是 A. 向某溶液中加入足量CaCl2溶液,产生白色沉淀,则溶液中一定含有大量的CO32- B. 在某试样中加入NaOH浓溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体,则试样中含有NH4+... C. 用Na2CO3溶液可以鉴别物质的量浓度之比为2:1的稀盐酸和稀硫酸 D. 分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
|
|
| 20. | 详细信息 |
|
某白色粉末由两种物质组成,为鉴定其成分进行如下实验: ①取少量样品,加入足量水,仍有部分固体未溶解;过滤后,向所得固体中加入足量氢氧化钠溶液,固体全部溶解; ②另取少量样品加入足量氢氧化钠溶液,振荡后仍有固体存在。 该白色粉末可能为 A. Ca(HCO3)2、Al (OH)3 B. Al(OH)3、NaHCO3 C. Na2SO3、Mg(OH)2 D. Na2CO3、CuSO4
|
|
| 21. | 详细信息 | |||||||||||||||
|
下列实验操作对应的实验现象正确的是
A. A B. B C. C D. D
|
||||||||||||||||
| 22. | 详细信息 |
|
建构数学模型来研究化学问题,既直观又简洁。下列建构的数轴模型正确的是 A. 钠在氧气中燃烧后得到的氧化产物: B. 铁在Cl2中燃烧后得到的氧化产物: C. FeBr2溶液中通入Cl2,铁元素存在形式: D. NH3与Cl2反应,反应产物:
|
|
| 23. | 详细信息 |
|
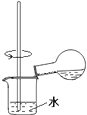
一种制取粗碘的工艺流程如图所示,下列有关说法不正确的是
A. 步骤②中的萃取过程为物理变化 B. 步骤③发生的反应中I2是氧化剂,NaOH是还原剂 C. 步骤④所加的试剂X可能是稀硫酸 D. 步骤⑤涉及的主要操作Y为分液和蒸馏
|
|
| 24. | 详细信息 | |||||||||||||||||||
|
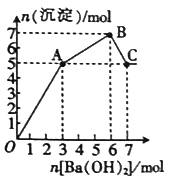
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2溶液,形成沉淀的情况如下图所示。Fe(OH)3、Al(OH)3沉淀的生成与溶解的pH列于下表。(已知:偏铝酸钡易溶于水)。以下推断正确的是
A. OA段产生的沉淀为:Fe(OH)3和Al(OH)3 B. AB段可能发生的反应是:Al3++3OH-=Al(OH)3↓ C. Al3+的物质的量浓度是2mol·L-1 D. C点沉淀的质量为806g
|
||||||||||||||||||||
| 25. | 详细信息 |
|
下列实验操作能达到相应实验目的的是 A. 向0.1 mol•L-1的硫酸中滴入几滴甲基橙溶液,溶液变黄 B. 将CH4和C2H4的混合气体通过酸性KMnO4溶液可得纯净的C2H4 C. 提纯混有乙酸和乙醇的乙酸乙酯,用饱和Na2CO3溶液洗涤、分液并干燥 D. 制备Fe(OH)3胶体时,可在FeCl3溶液中加入足量NaOH溶液并煮沸
|
|
| 26. | 详细信息 |
|
硫的多种化合物在工业中有重要的应用。 (1)连二亚硫酸钠(Na2S2O4)又称保险粉,是最适合木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。 ①Na2S2O4中S元素的化合价为__________。 ②Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为l:2时,产物为___________(填化学式)。 ③将甲酸和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2。该反应的化学方程式为____________________。 (2)铬会造成环境污染.某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52mg·L-1,达到排放标准。 ①Na2S2O5参加反应的离子方程式为____________。 ②处理后的废水中Cr3+的物质的量浓度为__________mol·L-1。...
|
|
| 27. | 详细信息 | |||||||||
|
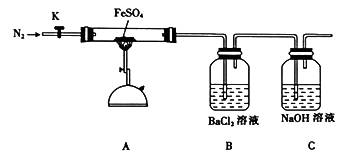
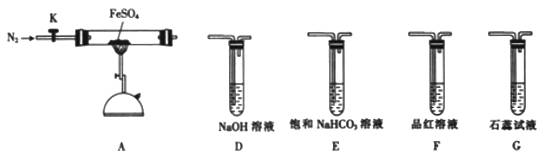
硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化物。某化学研究小组利用下列装置加热至高温使FeSO4分解。
实验步骤: 将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通入一段时间N2,关闭活塞K。加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却。 (1)已知M中铁元素的质量分数为70%,M的化学式为_______________。 (2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置进行实验。
(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N。
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A →____→ 。 ②能证明生成了非金属氧化物N的现象是_______________。
|
||||||||||
| 28. | 详细信息 |
|
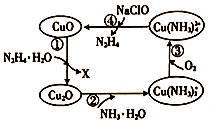
水合肼(N2H4·H2O)又称水合联氨,其纯净物为无色透明的油状液体,具有强碱性和吸湿性。将水合肼通入CuO胶体中,可发生如图所示的转化。
(1)图示的转化中,②属于_____________(填“非氧化还原反应”或“氧化还原反应”)。 (2)转化①中,氧化剂与还原剂的物质的量之比为4: l ,则X的化学式为_____。 (3)转化②中,反应一段时间后,溶液中n(OH-)____________(填“增大”“ 减小” 或“不变”)。 (4)若①中参加反应的CuO物质的量为0.4mol,按图示转化过程进行后,④中生成的CuO物质的量也等于0.4mol,则③中参加反应的O2的物质的量与④中今加反应的NaClO的物质的量之比为_________。
|
|
| 29. | 详细信息 |
|
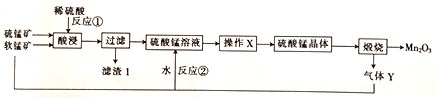
三氧化二猛(Mn2O3)在现代工业上应用广泛。以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料制备高纯度硫酸锰进而制备三氧化二锰的工艺流程如下(两种矿物中均不存在单质杂质):
(1)滤渣1中存在一种非金属单质,则“酸浸”时反应①的化学方程式为___________________。 (2)操作X为蒸发浓缩、____________、洗涤烘干。经操作X之后得到MnSO4•H2O。在洗涤操作中,常用酒精洗涤MnSO4•H2O晶体,主要目的是____________________。 (3)气体Y直接排放会污染空气,将Y的水溶液与软锰矿反应可得硫酸锰,反应②的化学方程式为______________。 (4)Mn2O3与MnO2类似,也能与浓盐酸反应,其反应的离子方程式为_______________________。 (5)用标准的BaCl2溶液测定样品中MnSO4•H2O的质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其原因可能是__________________ (任写一点)。
|
|