2019黑龙江高二上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
下列有关原子轨道的叙述中正确的是( ) A.氢原子的2s轨道能量较3p轨道高 B.锂原子的2s与5s 轨道均为球形 C.p能级的原子轨道呈哑铃形,随着能层序数的增加,p能级原子轨道也在增多 D.能层n=4的原子轨道最多可容纳16个电子
|
|
| 2. | 详细信息 |
|
下列叙述正确的是( ) A. 除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属族的族序数 B. 除短周期外,其他周期均为18种元素 C. 副族元素没有非金属元素 D. 碱金属元素是指ⅠA族的所有的元素
|
|
| 3. | 详细信息 | |||||||||||||||
|
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表数据判断,错误的是 ( )
A.元素X的常见化合价是+1价 B.元素Y是ⅢA族元素 C.元素X与氯形成化合物时,化学式可能是XCl D.若元素Y处于第三周期,它可与冷水剧烈反应
|
||||||||||||||||
| 4. | 详细信息 |
|
下列关于SO2与CO2分子的说法正确的是( ) A.都是直线形结构 B.中心原子都采取sp杂化 C.S原子和C原子上都没有孤对电子 D.SO2为V形结构,CO2为直线形结构
|
|
| 5. | 详细信息 |
|
通常状况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NCl3的有关叙述正确的是( ) A.NCl3分子中N—Cl键的键长比CCl4分子中C—Cl键的键长长 B.NCl3分子是非极性分子 C.分子中的所有原子均达到8电子稳定结构 D.NBr3比NCl3易挥发
|
|
| 6. | 详细信息 |
|
下列说法正确的是( ) A. HF、HCl、HBr、HI的熔沸点依次升高 B. CH4、CCl4都是含有极性键的非极性分子 C. CS2、H2S、C2H2都是直线形分子 D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
|
|
| 7. | 详细信息 |
|
下列各组中的X和Y两种原子,化学性质一定相似的是 ( ) A.X原子和Y原子最外层都只有1个电子 B.X原子的核外电子排布式为1s2,Y原子的核外电子排布式为1s22s2 C.X原子的2p能级上有3个电子,Y原子的3p能级上有3个电子 D.X原子核外M层上仅有2个电子,Y原子核外N层上仅有2个电子
|
|
| 8. | 详细信息 |
|
下列物质:①H3O+②[Cu(NH3)4]2+③CH3COO-④NH3⑤CH4中存在配位键的是( ) A.①② B.①③ C.④⑤ D.②④
|
|
| 9. | 详细信息 |
|
据报道,1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤-239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤—239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
|
|
| 10. | 详细信息 |
|
关于氢键,下列说法正确的是( ) A.含氢元素的化合物中一定有氢键 B.氢键比分子间作用力强,所以它属于化学键 C.DNA中的碱基互补配对是通过氢键来实现的 D.H2O是一种非常稳定的化合物,这是由于氢键所致
|
|
| 11. | 详细信息 |
|
已知X元素和Y元素同周期,且电负性X>Y,下列说法错误的是( ) A.X与Y形成化合物时:X可以显负价,Y显正价 B.第一电离能:Y可能小于X C.最高价含氧酸的酸性:X弱于Y D.气态氢化物的稳定性:Y小于X
|
|
| 12. | 详细信息 |
|
下列关于丙烯(CH3—CH =CH2)的说法正确的( ) A. 丙烯分子有7个σ键,1个π键 B. 丙烯分子中3个碳原子都是sp3杂化 C. 丙烯分子存在非极性键 D. 丙烯分子中3个碳原子在同一直线上
|
|
| 13. | 详细信息 |
|
下列说法正确的是( ) A.浓度为0.1 mol·L-1 CH3COOH溶液,加水稀释,则c(CH3COO-)/c(CH3COOH)减小 B.浓度为0.1 mol·L-1 CH3COOH溶液,升高温度,Ka(CH3COOH)不变,但醋酸的电离程度增大 C.浓度为0.1 mol·L-1 HA溶液pH为4,则HA为弱电解质 D.CH3COOH的浓度越大,CH3COOH的电离程度越大
|
|
| 14. | 详细信息 | |||||||||||||||
|
现有室温下四种溶液,有关叙述不正确的是( )
A.③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 B.②③两溶液等体积混合,所得溶液中c(H+)>c(OH-) C.分别加水稀释10倍,四种溶液的pH ①>②>④>③ D.V1 L ④与V2 L ①混合,若混合后溶液pH=7,则V1< V2
|
||||||||||||||||
| 15. | 详细信息 |
|
用盐酸标准液滴定未知浓度的NaOH溶液,下列各操作中会引起实验误差的是( ) A.滴定前酸式滴定管需用盐酸标准液润洗 B.用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定 C.往盛有20.00 mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定 D.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液
|
|
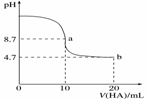
| 16. | 详细信息 |
|
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) B.a、b两点所示溶液中水的电离程度相同 C.pH=7时,c(Na+)=c(A-)+c(HA) D.b点所示溶液中c(A-)>c(HA)
|
|
| 17. | 详细信息 |
|
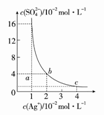
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法不正确的是( )
B.采取蒸发溶剂的方法可以使溶液从a点变到b点 C.该温度下,Ag2SO4的Ksp=1.6×10-5 D.0.02 mol·L-1的AgNO3溶液与0.2 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
|
|
| 18. | 详细信息 |
|
一定温度下,下列溶液的离子浓度关系式正确的是( ) A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1 B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O D.pH相同的①CH3COONa,②NaHCO3,③NaClO三种溶液的c(Na+):①>②>③
|
|
| 19. | 详细信息 |
|
.某兴趣小组进行下列实验: ①将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1 NaOH溶液等体积混合得到浊液 ②取少量①中浊液,滴加0.1 mol·L-1 FeCl3溶液,出现红褐色沉淀 ③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L-1 FeCl3溶液,白色沉淀变为红褐色沉淀 ④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解 下列说法中不正确的是( ) A.将①中所得浊液过滤,所得滤液中含少量Mg2+ B.①中浊液中存在沉淀溶解平衡:Mg(OH)2(s) C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶 D.NH4Cl溶液中的NH
|
|
| 20. | 详细信息 |
|
下列有关热化学方程式的叙述,正确的是( ) A.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 B.由N2O4(g) C.由:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ D.已知101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1,则1 mol碳完全燃烧放出的热量大于110.5 kJ
|
|
| 21. | 详细信息 |
|
下列叙述正确的是( ) A.电解质溶液导电是化学变化,金属导电是物理变化 B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液 C.因为镁的活泼性强于铝,所以将镁、铝用导线连接后放入氢氧化钠溶液中,镁作负极、铝作正极 D.不能自发进行的氧化还原反应,任何方法都不可以实现
|
|
| 22. | 详细信息 |
|
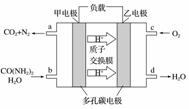
化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示,下列有关描述正确的是( ) A.电池工作时H+移向负极 B.该电池用的电解质溶液是KOH溶液 C.甲电极反应式:CO(NH2)2+H2O-6e-===CO2+N2+6H+ D.电池工作时,理论上每净化1 mol CO(NH2)2,消耗33.6 L O2
|
|
| 23. | 详细信息 |
|
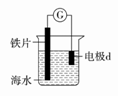
研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( ) A.d为石墨,铁片腐蚀加快 B.d为石墨,石墨上电极反应为:O2+2H2O+4e-===4OH- C.d为锌块,铁片不易被腐蚀 D.d为锌块,铁片上电极反应为:2H++2e-===H2↑
|
|
| 24. | 详细信息 |
|
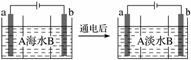
电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示,电极为惰性电极。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO
A.A膜是阳离子交换膜 B.通电后,海水中阴离子往b电极处移动 C.通电后,b电极上产生无色气体,溶液中出现白色沉淀 D.通电后,a电极的电极反应式为4OH--4e-===O2↑+2H2O
|
|
| 25. | 详细信息 |
|
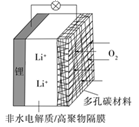
一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( ) A. 放电时,多孔碳材料电极为负极 B. 放电时,外电路电子由多孔碳材料电极流向锂电极 C. 充电时,电解质溶液中Li+向多孔碳材料区迁移 D. 充电时,电池总反应为Li2O2-x=2Li+(1-
|
|
| 26. | 详细信息 | ||||||||||||
|
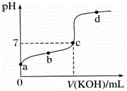
按要求填空: I.(1)AlCl3的水溶液 pH______7(填>、=、<=,其原因为______________(用离子方程式表示),将其溶液加热蒸干并灼烧最终得到物质是 (填化学式)。 (2)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至 。 (3)物质的量浓度相同的三种溶液:①NH4Cl ②氨水 ③NH4HSO4,c(NH4+)大小顺序正确的是______________。(用序号表示) (4)常温下两种溶液:a.pH=4 NH4Cl b.pH=4盐酸溶液,其中水电离出C(H+)之比为____________________。 II.室温下,某一元弱酸HA的电离常数K=1.6×10-6。 向20.00 mL 浓度约为0.1 mol·L-1 HA溶液中逐滴加入0.1000 mol·L-1 的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
(2)滴定过程中部分操作如下,下列各操作使测量结果偏高的是___________(填字母序号)。 A.滴定前碱式滴定管未用标准NaOH溶液润洗 B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定 C.滴定过程中,溶液出现变色后,立即停止滴定 D.滴定结束后,仰视液面,读取NaOH溶液体积 (3)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为 mol/L。(保留4位有效数字)
|
|||||||||||||
| 27. | 详细信息 |
|
为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。
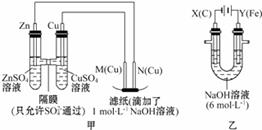
I.用图甲所示装置进行第一组实验时: (1)在保证电极反应不变的情况下,不能替代Cu作电极的是_____ (填字母)。 A石墨 B. 镁 C.银 D.铂 (2)实验过程中,SO42-____(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象是________________。 II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题: (3)电解过程中,X极处溶液的OH-浓度____(填“增大”“减小”或“不变)。 (4)电解过程中,Y极发生的电极反应为 , 。 (5)电解进行一段时间后,若在X极收集到672mL气体,Y电板(铁电极)质量减小0.28g,则在Y极收集到气体为____mL(均己折算为标准状况时气体体积)。 (6)K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应总反应式为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为 。
|
|
| 28. | 详细信息 |
|
某配位化合物为深蓝色晶体,由原子序数由小到大的A,B,C,D,E五种元素组成,其原子个数比为14∶4∶5∶1∶1。其中C,D同主族且原子序数D为C的2倍,E元素的外围电子排布式为(n-1)dn+6ns1,试回答下列问题: (1)该配位化合物的化学式为 ,配合物中采取sp3杂化的原子按第一电离能由大到小排列顺序为 (用元素符号表示),1mol配离子中含有的σ键数目为 。 (2)D元素基态原子的最外层电子排布图为 。 (3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可以任意比互溶,解释其主要原因为_________________________________。 (4)A元素与B元素可形成分子式为B2A2的某化合物,该化合物的分子具有平面结构,则其结构式为________,该分子中B元素的杂化方式为________。 (5)该配合物溶于水得深蓝色溶液,加入乙醇溶剂,将析出深蓝色的晶体,则加入乙醇的作用是 。
|
|
| 29. | 详细信息 |
|
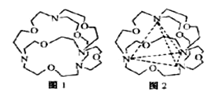
碳、氮、氧、氟、硫是中学常见的非金属元素,铁离子可与由它们组成的SCN﹣,CN﹣, F﹣等形成很多的配合物。 (1)基态Fe原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 ,电子数为 。 (2)已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为 ,在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是 。 (3)配合物K4[Fe(CN)6]中不存在的作用力 (填序号)。 A.共价键 B.离子键 C.非极性键 D.配位键 (4)写出一种与SCN﹣互为等电子体的分子 (用化学式表示),该分子的空间构型为 。 (5)肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1,若该反应中有4mol N-H键断裂,则形成的π键有________mol。 (6)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点 (见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
下列分子或离子中,能被该有机化合物识别的是_________(填标号)。 a. CF4 b. CH4 c. NH4+ d. H2O
|
|
 室温下向
室温下向