2019天津高三上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
化学与日常生活密切相关,下列说法错误的是( ) A.碘酒是指单质碘的乙醇溶液 B.84消毒液的有效成分是NaClO C.浓硫酸可刻蚀石英制艺术品 D.装饰材料释放的甲醛会造成污染
|
|
| 2. | 详细信息 |
|
用化学用语表示 NH3+ HCl A. 中子数为8 的氮原子: C. NH3的结构式:
|
|
| 3. | 详细信息 |
|
化学与生活密切相关。下列说法错误的是( ) A.碳酸钠可用于去除餐具的油污 B.漂白粉可用于生活用水的消毒 C.碳酸氢钠可用于中和过多胃酸 D.碳酸钡可用于胃肠X射线造影检查
|
|
| 4. | 详细信息 |
|
在配制一定物质的量浓度的硫酸溶液时,下列错误操作可使所配溶液浓度偏低的是( ) A.用量筒量取浓硫酸时俯视读数 B.用量筒量取浓硫酸后用适量水洗涤量筒 C.定容时,俯视容量瓶瓶颈刻度线 D.稀释浓硫酸后,未冷却至室温就转移定容了
|
|
| 5. | 详细信息 |
|
NA是阿伏加德罗常数的值,下列说法正确的是( ) A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA B.22.4 L(标准状况)氩气含有的质子数为18NA C.92.0 g甘油(丙三醇)中含有羟基数为1.0 NA D.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
|
|
| 6. | 详细信息 |
|
下列有关溶液组成的描述合理的是( ) A.无色溶液中可能大量存在Al3+、NH4+、Cl‾、S2‾ B.酸性溶液中可能大量存在Na+、ClO‾、SO42‾、Fe2+ C.弱碱性溶液中可能大量存在Na+、K+、Cl‾、HCO3‾ D.中性溶液中可能大量存在Fe3+、K+、Cl‾、SO42‾
|
|
| 7. | 详细信息 |
|
化学概念在逻辑上存在如下关系,对下列概念的说法正确的是( )
A.化合物与纯净物属于重叠关系 B.化合物与碱性氧化物属于交叉关系 C.分解反应与复分解反应属于并列关系 D.硫酸与硝酸只有交叉关系
|
|
| 8. | 详细信息 |
|
下列化学用语对事实的表述不正确的是( ) A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH B.常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O
D.电解精炼铜的阴极反应:Cu2+ + 2e−
|
|
| 9. | 详细信息 |
|
下列指定反应的离子方程式正确的是( ) A.饱和Na2CO3溶液与CaSO4固体反应:CO32−+CaSO4 B.酸化NaIO3和NaI的混合溶液:I− + IO3−+ 6 H+ C.KClO碱性溶液与Fe(OH)3反应:3ClO−+2Fe(OH)3 D.电解饱和食盐水:2Cl−+2H+
|
|
| 10. | 详细信息 |
|
下列离子方程式错误的是( ) A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42 -=BaSO4↓+2H2O B.酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2 +6H+== 2Mn2++5O2↑+ 8H2O C.等物质的量的MgCl2、Ba(OH)2 和 HCl溶液混合:Mg2++2OH-= Mg(OH)2↓ D.石灰水中通入过量的CO2气体:CO2 + OH- == HCO3 -
|
|
| 11. | 详细信息 | |||||||||||||||
|
下列实验中的颜色变化,与氧化还原反应无关的是( )
|
||||||||||||||||
| 12. | 详细信息 |
|
下列变化中,气体被氧化的是( ) A.二氧化碳使Na2O2固体变白 B.SO2 气体使高锰酸钾酸性溶液褪色 C.氯气通入碘化钾溶液,使溶液呈棕黄色 D.氨气使AlCl3溶液产生白色沉淀
|
|
| 13. | 详细信息 | ||||||||||||||||||||
|
下列条件中关于粒子组共存的评价不正确的是( )
|
|||||||||||||||||||||
| 14. | 详细信息 | ||||||||||||||||||||
|
下列离子组在一定条件下能大量共存,且加入试剂后发生反应的离子方程式正确的是( )
|
|||||||||||||||||||||
| 15. | 详细信息 |
|
下列反应中,氧化剂与还原剂物质的量之比为1∶2的是 ( ) A.3S+6NaOH B.2CH3COOH+Ca(ClO)2 C.I2+2NaClO3 D.4HCl(浓)+MnO2
|
|
| 16. | 详细信息 |
|
O2F2可以发生反应:H2S + 4 O2F2 → SF6 + 2 HF + 4 O2,下列说法正确的是( ) A.还原剂与氧化剂的物质的量之比为1 :4 B.O2F2既是氧化剂又是还原剂 C.若生成4.48 L HF,则转移0.8 mol电子 D.氧气是氧化产物
|
|
| 17. | 详细信息 |
|
NA表示阿伏加德罗常数,下列叙述正确的是( ) A. lmol Fe I 2 与足量氯气反应时转移的电子数为2NA B. 2 L 0.5 mol • L-1硫酸钾溶液中阴离子所带电荷数为NA C. 1 mol Na2O2固体中含离子总数为4NA D.乙烯和环丁烷组成的14 g混合气体中原子总个数为3 NA
|
|
| 18. | 详细信息 |
|
室温下,下列各组离子在指定溶液中能大量共存的是( ) A.0.1 mol·L−1 KI 溶液: Na+、K+、ClO− 、OH− B.0.1 mol·L−1 Fe2(SO4)3溶液: Cu2+、NH4+ 、NO3−、SO42− C.0.1 mol·L−1 HCl 溶液: Ba2+、K+、CH3COO−、NO3− D.0.1 mol·L−1 NaOH溶液: Mg2+、Na+、SO42−、HCO3−
|
|
| 19. | 详细信息 |
|
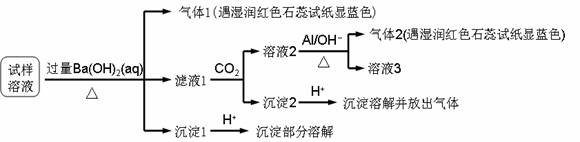
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
已知:3NO3-+ 8Al + 5OH- + 2H2O 根据以上的实验操作与现象,该同学得出的结论不正确的是( ) A.试样中肯定存在NH4+、Mg2+、SO42-和NO3- B.试样中一定不含Al3+ C.试样中可能存在Na+、Cl- D.该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
|
|
| 20. | 详细信息 |
|
某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。 (1) 若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是________。 A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液 (2) 写出制备Fe(OH)3胶体的化学反应方程式___________________________________ 。 (3) 检验制得的物质是胶体的实验方法是_____________________(不必叙述操作方法)。 (4) 取少量制得的胶体加入试管中,加入(NH4)2SO4溶液,现象是_______________, 这种现象称为胶体的________。 (5) Fe(OH)3胶体稳定存在的主要原因是________。 A.胶粒直径小于1 nm B.胶粒带正电荷 C.胶粒作布朗运动 D.胶粒能透过滤纸 (6) Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。 A.Fe(OH)3胶体粒子的直径在1~100 nm之间 B.Fe(OH)3胶体具有丁达尔效应 C.Fe(OH)3胶体是均一的分散系 D.Fe(OH)3胶体的分散质能透过滤纸
|
|
| 21. | 详细信息 |
|
请按要求书写下列离子方程式: ①将NaHSO4溶液滴加到Ba(OH)2溶液中,当溶液恰好呈中性时,反应的离子方程式为:__________________________________________ __。 ② 向NaS2O3溶液中滴加盐酸: ___________________ _。 ③ 向NH4HCO3溶液中加入少量的NaOH溶液: 。 ④ 0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合: 。 ⑤ 在酸性条件下,向含铬废水中加入FeSO4,将Cr2O72-还原为Cr3+,该过程的离子方程式为: 。 ⑥ 200mL2 mol / L的FeI2溶液中,通入11.2L(标况)氯气:
|
|
| 22. | 详细信息 |
|
生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、嗅和味等。目前城市自来水处理过程中所使用的主要药剂仍是Cl2(消毒剂)和FeSO4(沉降剂),但由于种种原因,用这两种物质处理水质总有缺陷。因此,有资料报道:Na2FeO4是一种强氧化剂,可作为一种新型净水剂,在反应中被还原为Fe3+,使用该物质可代替Cl2和FeSO4 (1) 配平工业上制备高铁酸钠的化学方程式:
(2) 当反应物中含有1.4 mol钠离子,上述反应恰好完全进行时,电子转移总数为________NA。 (3) Na2FeO4代替Cl2是因为它具有________性,还原为Fe3+后,能净水的原理为(用文字说明原 因)_______________________________________________________________ _。 (4) 某厂制备高铁酸钠后的废液中含NaNO2溶液,直接排放会造成污染,在下列试剂中: ①NaCl ②NH4Cl ③KMnO4 ④浓H2SO4, 能使NaNO2转化为N2 (不引起二次污染)的是________(选填编号),反应的离子方程式为: _______________________________________________________________________。
|
|
| 23. | 详细信息 |
|
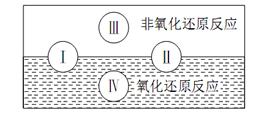
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。 (1) 下列生产、生活中的事例中没有发生氧化还原反应的是________(填写字母代号)。 A.铝的表面生成致密的薄膜 B.大理石雕像被酸雨腐蚀毁坏 C.食物腐败 D.燃放烟花 (2) 水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还
试写出有水参加的符合反应类型Ⅳ的 一个化学方程式: _____________________________________; 其中水为________剂。 (3) 过氧化氢水溶液俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答 下列问题: A.Na2O2+2HCl === 2NaCl+H2O2 B.Ag2O+H2O2 === 2Ag+O2↑+H2O C.2H2O2 === 2H2O+O2↑ D.3H2O2+Cr2(SO4)3+10KOH === 2K2CrO4+3K2SO4+8H2O ①上述反应中,H2O2仅体现氧化性的反应是(填代号,下同)________, H2O2既体现氧化性又体现还原性的反应是________。 ② 保存过氧化氢的试剂瓶上最适合贴上的一个标签是________(填序号)。 ③ H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O === A+NH3↑(已配平) , 试指出生成物A的化学式为________ ,并阐明H2O2被称为绿色氧化剂的理由是: _____________________________________________________。 (4) 氯化铵常用于焊接金属。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为: ____CuO+____NH4Cl ① 配平此氧化还原反应方程式。 ② 该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。 ③ 反应中若产生0.2 mol的气体,则有________mol的电子转移。
|
|
| 24. | 详细信息 |
|
Ⅰ.实验室用密度为1.25 g·mL-1,质量分数为36.5%的浓盐酸配制240 mL 0.1 mol·L-1的盐酸, 请回答下列问题: (1) 浓盐酸的物质的量浓度为____________。 (2) 配制240 mL 0.1 mol·L-1的盐酸应量取浓盐酸体积_______ 。 (3) 配制该溶液时除了使用烧杯、玻璃棒、量筒,还需要的玻璃仪器为_______________________。 Ⅱ、在下列溶液的配制过程中,会引起浓度偏高的是_____________ ①用1 g 98%的浓硫酸加4 g水配制成19.6%的硫酸; ②配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线; ③10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液; ④向容量瓶中转移溶液时,有少量洒漏出容量瓶; ⑤质量分数为5x%和x%的两种氨水等体积混合配制成3x%的氨水
|
|