2016陕西高三下学期人教版高中化学开学考试
| 1. | 详细信息 |
|
化学与环境、工农业生产等密切相关,下列叙述正确的是( ) A.光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 B.将草木灰和硫酸铵混合施用,肥效更高 C.棉花的主要成分是纤维素,石英玻璃、陶瓷和水泥均属于硅酸盐产品 D.硫酸工业尾气未经处理就直接排放,将直接导致“温室效应”
|
|
| 2. | 详细信息 |
|
设NA代表阿伏加德罗常数的数值。下列有关叙述正确的是( ) ①标准状况下,2.24LH2O含有的分子数等于0.1NA ②23gNa在氧气中完全燃烧失电子数为NA ③1 mol 硫酸钾中阴离子所带电荷数为NA ④常温常压下,32gO2-离子中所含电子的数目为16 NA ⑤由CO2和O2组成的混合物中共有个NA分子,其中的氧原子数为2 NA A.①②⑤ B.②⑤ C.③④⑤ D.②④
|
|
| 3. | 详细信息 |
|
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中,正确的是( ) A.1mol该物质分别与浓溴水和H2反应时最多消耗和分别为4mol和7mol B.滴入酸性溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 C.该物质与苯酚属于同系物,遇溶液呈紫色 D.该分子中的所有碳原子不可能共平面
|
|
| 4. | 详细信息 |
|
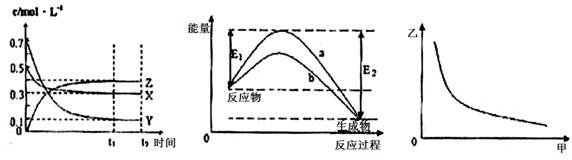
X、Y、Z是三种气态物质,在一定温度下其变化符合下图。下列说法不正确的是( ) A.该反应的化学方程式为X(g) +3Y(g) B.若升高温度,该反应的平衡常数减小,Y的转化率降低。 C.图II中曲线b是加入催化剂时的能量变化曲线,曲线a是没有加入催化剂时的能量变化曲线。 D.若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线。
|
|
| 5. | 详细信息 |
|
加热条件下,将24g CuO、Fe2O3的混合物与充足的CO完全反应,并将反应后的气体全部通入到澄清石灰水中,得到白色沉淀40g。下列有关叙述中不正确的是( ) A.原混合物中CuO与Fe2O3物质的量的比为l︰l B.反应后所得CO2的质量为40g C.参加反应的CO的质量为11.2g D.原混合物中CuO与Fe2O3的质量比为1︰2
|
|
| 6. | 详细信息 |
|
下列表示溶液中发生反应的化学方程式错误的是 ( ) A.100 mL 0.1 mol/L的Na2CO3溶液中加入0.01 molCH3COOH: CO32- + CH3COOH === HCO3- + CH3COO- B.向HCOOK和KOH的混合溶液中加入KMnO4 2KMnO4+HCOOK+KOH=2K2MnO4+CO2↑+H2O C.4 mol/L的NaAlO2溶液和7 mol/L的盐酸等体积均匀混合:
D.在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色: 5PbO2 + 2Mn2+ + 4H+ ===5Pb2+ + 2MnO4- + 2H2O
|
|
| 7. | 详细信息 | |||||||||||||||
|
几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
A.X、Y元素的金属性X<Y B.一定条件下,Z单质与W的常见单质直接生成ZW2 C.Y的最高价氧化物对应的水化物能溶于稀氨水 D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
|
||||||||||||||||
| 8. | 详细信息 |
|
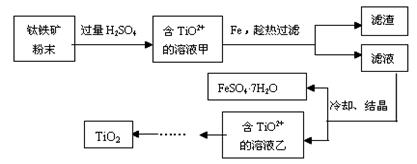
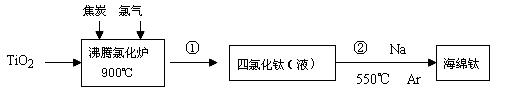
Ⅰ.用钛铁矿制取二氧化钛,(钛铁矿主要成分为FeTiO3,其中Ti元素化合价为+4价,含有Fe2O3杂质。)主要流程如下: (1)Fe2O3与H2SO4反应的离子方程式_________________________________。 (2)加Fe的作用是_________________________________。 Ⅱ.由金红石(含TiO2大于96%)为原料生产钛的流程如下:
(3)反应②的方程式是 ,该反应需要在Ar气氛中进行的原因是 。 Ⅲ.科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺。
(5)阳极产生的CO2经常用氢氧化钠溶液来吸收,现有0.4mol CO2用200ml 3mol/L的NaOH溶液将其完全吸收,溶液中的离子浓度由大到小的顺序为 。
|
|
| 9. | 详细信息 | ||||||||
|
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。 (1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式: ___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O (2)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为 。 (3)工业上在恒容密闭容器中用下列反应合成甲醇: 下表所列数据是反应在不同温度下的化学平衡常数(K)。
①判断反应达到平衡状态的依据是 A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的平均相对分子质量不变 C.混合气体的密度不变 D.CH3OH、CO、H2的浓度都不再发生变化 ②借助上表数据判断,要同时提高CO的转化率和反应的速率,可采取的措施是 A.升温 B.充入H2 C.分离出甲醇 D.加入催化剂 ③某温度下,将2 mol CO和一定量的H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c (4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和Na2CO3 的熔融盐混合物作电解质, CO 为负极燃气,空气与 CO2 的混和气为正极助燃气,制得在 650 ℃下工作的燃料电池,其正极反应式: O2 + 2CO2 +4e- =2 CO32- ,则 负极反应式:___ ____ (5)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq)
|
|||||||||
| 10. | 详细信息 | ||||||||||||||||||||||||
|
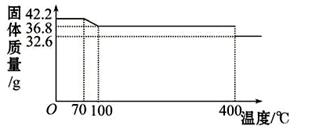
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6] •3H2O。 42.2g K4[Fe(CN)6] •3H2O(M=422g/mol)样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。 (1)试确定150℃时固体物质的化学式为_______________。 (2)在25℃下,将a mol•L-1的KCN(pH>7)溶液与0.01mol•L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol•L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=______________。 (3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
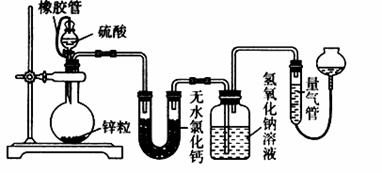
(I)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中n(H2)=_______________(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,n(SO2)/n(H2)的数值将 (填偏大、偏小或无影响) (II)在硫酸中加入硫酸铜可以加快氢气的生成速率的原因:_____________________ (III) 为进一步探究硫酸铜的量对氢气生成速率的影响,某同学设计如下一系列实验,将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中。
①完成此实验设计,其中V5 = ______V7 =________ ②为探究氢气生成速率要收集产生的气体,还需记录:___________________
|
|||||||||||||||||||||||||
| 11. | 详细信息 |
|
迷迭香酸是从蜂花属植物中获取的一种酸性物质,它是一种具有广泛应用的化工原料,用于合成医药药品、香料等,其结构简式如右图所示:
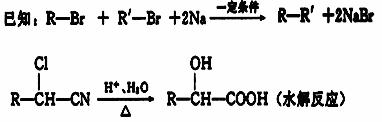
下列是由苯酚与某有机物A为主要原料合成迷迭香酸的过程,已知B的分子式为C2H4O,能发生银镜反应。 (1) C的结构简式为 (2)上述①~⑤反应中没有出现的反应类型有 (填代号)。 A.加成反应 B.氧化反应 C.消去反应 D.聚合反应 E.酯化反应 (3)写出B发生银镜反应的化学方程式 。 (4) 反应③的化学方程式为: (5) 已知有机物H只比G少2个氧原子,H分子中苯环上只有2个侧链且处于对位,其分子中含有-OH、-COOH的同分异构体有 种,请任写出其中一种同分异构体的结构简式 。 (6)若用Pt作电极,将G、O2、NaOH溶液组成一个燃料电池,则其电池负极电极反应为 。(有机物用分子式表示)
|
|