2018江西高二上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青 睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并 加快向产业化的目标迈进。氢能具有的优点包括 ①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行 A.①② B.①③ C.③④ D.②④ |
|
| 2. | 详细信息 |
|
已知:H2(g)+F2(g) A.2L氟化氢气体分解成1L氢气好1L氟气吸收270KJ B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270KJ |
|
| 3. | 详细信息 |
|
已知(1)H2(g)+1/2O2(g)=H2O(g) ΔH1=aKJ/mol (2)2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ/mol (3)H2(g)+1/2O2(g)===H2O(l) ΔH3=c kJ/mol (4)2H2(g)+O2(g)===2H2O(l) ΔH4=d kJ/mol 下列关系式中正确的是 A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0 |
|
| 4. | 详细信息 |
|
下列说法不正确的是 A.任何化学反应都伴随有能量变化 B.化学反应中的能量变化都表现为热量的变化 C.反应物的总能量高于生成物的总能量时,发生放热反应 D.反应物的总能量低于生成物的总能量时,发生吸热反应 |
|
| 5. | 详细信息 |
|
已知葡萄糖的燃烧热是-2804KJ/mol,当它氧化生成1g 液态水时放出的热量是 A.26.0kJ B.51.9kJ C.155.8kJ D.467.3kJ |
|
| 6. | 详细信息 |
|
已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol和-1366.8kJ/mol,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为A.-44.2kJ/mol B.+44.2kJ/mol C.-330kJ/mol D.+330kJ/mol |
|
| 7. | 详细信息 |
|
已知:①1molH2分子中化学键断裂时需要吸收436KJ的能量②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量 ③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量 下列叙述正确的是 A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g)+Cl2(g)=2HCl(g) B.氢气和氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol C.氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183kJ/mol D.氢气和氯气反应生成1mol氯化氢气体,反应的△H=-183kJ/mol |
|
| 8. | 详细信息 |
|
将V1 mL1.00mol/L HCl 溶液V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。 下列叙述正确的是
A.做该实验时环境温度为22 ℃ B.该实验表明化学能可以转化为热能 C.NaOH溶液的浓度约是1.00 mol·L-1 D.该实验表明有水生成的反应都是放热反应 |
|
| 9. | 详细信息 |
|
.对处于化学平衡的体系,以化学平衡与化学反应速率的关系可知 A.正反应进行的程度大,正反应速率一定大 B.化学平衡发生移动时,化学反应速率一定变化 C.化学反应速率变化时,化学平衡一定发生移动 D.只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况 |
|
| 10. | 详细信息 |
|
已知:4NH3+5O2 A.4v(NH3)=5v(O2) B.5 v(O2)=6v(H2O) C.2 v(NH3)=3v(H2O) D.4 v(O2)=5v(NO) |
|
| 11. | 详细信息 |
|
可逆反应:A+3B ①v(A )=0.15mol/(L·s) ②v(B )=0.6mol/(L·s) ③v(C )=0.4mol/(L·s) ④v(D )=0.45mol/(L·s) 该反应进行速率最快的是 A..① B.②和③ C.④ D.①和④ |
|
| 12. | 详细信息 |
|
对处于平衡状态的反应2A(g)+B(g) A.增大压强,v(正)增大,v(逆)减小 B.升高温度,v(正)减小,v(逆)增大 C.增大A浓度的瞬间,v(正)增大,v(逆)不变 D.增大A浓度的瞬间,v(正)增大而v(逆)减小 |
|
| 13. | 详细信息 |
|
恒温恒压下,在容积可变的器皿中,反应2NO2(气) A.不变 B.增大 C.减小 D.无法判断 |
|
| 14. | 详细信息 |
|
在某温度下,可逆反应Ma(g)+nB(g) A.K越大,达到平衡时,反应进行的程度越小 B.K越小,达到平衡时,反应物的转化率越大 C.K随反应物浓度改变而改变 D.K随温度改变而改变 |
|
| 15. | 详细信息 |
|
对于可逆反应A2(g)+3B2(g)
|
|
| 16. | 详细信息 |
|
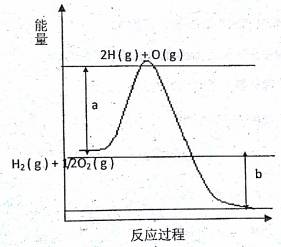
(12分)(1)比较下列各组热化学方程式中△H的大小关系: ①S(s)+O2(g)═SO2(g)△H1 S(g)+O2(g)═SO2(g)△H2 △H1 △H2(填><或“=”,下同); ②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1 CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2 △H1 △H2; ③4Al(s)+3O2(g)═2Al2O3(s)△H1 4Fe(s)+3O2(g)═2Fe2O2(s)△H2 △H1 △H2 (2)已知H2(g)+1/2O2(g)=2H2O(g),反应过程中能量变化如下图:请回答下列问题:
①图中a,b分别代表什么意义? a. ; b. 。 ②该反应是 反应(填“吸热”或“放热”), △H (填“< 0”或“> 0”) |
|
| 17. | 详细信息 | ||||||||||||||||||
|
下表是几种常用燃料(1mol)完全燃烧时放出的热量:
(1)从热量角度分析,目前最适合家庭使用的优质气体燃料是___________。 (2)写出管道煤气中的一氧化碳燃烧的化学方程式___________。 (3)充分燃烧1mol表中各种燃料,排放出二氧化碳的量最多的是___________。 (4)矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有氢能、___________等。 |
|||||||||||||||||||
| 18. | 详细信息 |
|
在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的的氮气和水蒸气,并放出大量的热量.已知0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量. (1)写出肼和过氧化氢的结构式 肼 ,过氧化氢 . (2)上述反应应用于火箭推进剂,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是 . (3)写出肼和双氧水反应的热化学方程式 . (4)已知H2O(l)═H2O(g);△H=+44KJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是 . (5)已知: N2 (g)+2O2(g)=2NO2 (g)△H=+67.7kJ/mol N2H4(g)+O2 (g)=N2(g)+2H2O (g)△H=-543kJ/mol 则肼与NO2完全反应的热化学方程式为 . |
|
| 19. | 详细信息 |
|
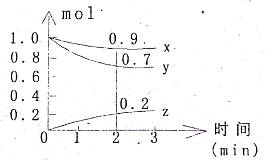
某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
(1)计算反应开始2min内的Vx= ,Vy= ,Vz= 。 (2)容器内的反应物是 。 (3)写出该反应的化学方程式 。 |
|
| 20. | 详细信息 |
|
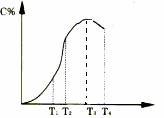
有可逆反应A+B
(1)反应在___________________温度下达到化学平衡; (2)此反应在正反应为______________________热反应; (3)由T1向T2变化时,V正____________V逆(填>、<、=); (4)由T3向T4变化时,V正_____________V逆(填>、<、=). |
|
| 21. | 详细信息 |
|
将1molCO和1molH2O(g)充入某固定容积的反应器中,在某条件下达到平衡: CO+H2O(g) (1)该平衡混合物中CO2的物质的量分数为 。 (2)温度不变的条件下向该平衡体系中再充入一定量的氩气,CO的转化率 (填“增大”、“减小”、“不变”) (3)温度不变的条件下向该平衡体系中再充入1mol CO2和1mol H2,则达到平衡时CO2的物质的量分数为 。 (4)若在相同条件下,向容器中充入1mol CO2、1mol H2和1mol H2O,则达到平衡时,混合物中CO2的物质的量分数可能是下列各值中的 (填编号) A.16.67% B.22.2% C.33.3% D.36.8% |
|