2019жұҹиӢҸй«ҳдәҢдёҠеӯҰжңҹиӢҸж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜ В AпјҺй“…и“„з”өжұ ж”ҫз”өиҝҮзЁӢдёӯпјҢжӯЈжһҒиҙЁйҮҸеўһеҠ пјҢиҙҹжһҒиҙЁйҮҸеҮҸе°ҸВ В В BпјҺиӢҘз”өе·Ҙж“ҚдҪңдёӯе°Ҷй“қзәҝдёҺй“ңзәҝзӣҙжҺҘзӣёиҝһпјҢдјҡеҜјиҮҙй“қзәҝжӣҙеҝ«иў«ж°§еҢ– CпјҺдёҖе®ҡжқЎд»¶дёӢпјҢдҪҝз”ЁеӮ¬еҢ–еүӮиғҪеҠ еҝ«еҸҚеә”йҖҹзҺҮ并жҸҗй«ҳеҸҚеә”зү©зҡ„е№іиЎЎиҪ¬еҢ–зҺҮ DпјҺ0.1 molВ·LпјҚ1CH3COOHжә¶ж¶ІеҠ ж°ҙзЁҖйҮҠеҗҺпјҢжә¶ж¶Ідёӯc(OHпјҚ)гҖҒCH3COOHжө“еәҰеқҮеҮҸе°‘
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
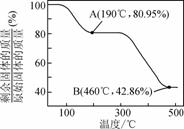
д»ҘзӮјй”ҢеҺӮзҡ„зғҹйҒ“зҒ°(дё»иҰҒжҲҗеҲҶдёәZnOпјҢеҸҰеҗ«е°‘йҮҸFe2O3гҖҒCuOгҖҒSiO2гҖҒMnOзӯү)дёәеҺҹж–ҷеҸҜз”ҹдә§иҚүй…ёй”Ңжҷ¶дҪ“(ZnC2O4В·2H2O)гҖӮ
жңүе…іж°ўж°§еҢ–зү©ејҖе§ӢжІүж·Җе’ҢжІүж·Җе®Ңе…Ёзҡ„pHеҰӮдёӢиЎЁпјҡ
иҜ·й—®зӯ”дёӢеҲ—й—®йўҳпјҡ (1) ж»ӨжёЈBзҡ„дё»иҰҒжҲҗеҲҶдёә________ гҖӮ (2) йҷӨй”°иҝҮзЁӢдёӯдә§з”ҹMnO(OH)2жІүж·Җзҡ„зҰ»еӯҗж–№зЁӢејҸдёә________гҖӮ (3) в‘ йҷӨй“Ғ(йғЁеҲҶCu2пјӢеҸҜиғҪиў«йҷӨеҺ»)ж—¶еҠ е…ҘZnOжҺ§еҲ¶еҸҚеә”ж¶ІpHзҡ„иҢғеӣҙдёә________________гҖӮ в‘Ў дёҠиҝ°жөҒзЁӢдёӯйҷӨй“ҒдёҺйҷӨй“ңзҡ„йЎәеәҸдёҚиғҪйў еҖ’пјҢеҗҰеҲҷйҷӨй“ҒзҺҮдјҡеҮҸе°ҸпјҢе…¶еҺҹеӣ жҳҜ________гҖӮ (4) иӢҘжІүж·ҖиҝҮзЁӢйҮҮз”ЁNa2C2O4д»ЈжӣҝиҚүй…ёй“өжҷ¶дҪ“з”ҹдә§иҚүй…ёй”ҢпјҢеҗҲзҗҶзҡ„еҠ ж–ҷж–№ејҸжҳҜ________гҖӮ
|
||||||||||||||||
| 3. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||
|
дәҢзўіеҢ–еӯҰзҡ„з ”з©¶еңЁе·Ҙдёҡз”ҹдә§дёӯе…·жңүйҮҚиҰҒж„Ҹд№үгҖӮ (1)еңЁдёҖе®ҡжё©еәҰе’ҢеҺӢејәдёӢпјҢе·ІзҹҘпјҡ
в‘ CH3CH2OH(g)пјӢ в‘ЎиӢҘеҸҚеә”2CH3CHO(g)пјӢO2(g) (2)е°ҶдёҖе®ҡйҮҸзҡ„CH3CH2OHе’ҢO2е……е…ҘжҒ’жё©гҖҒжҒ’еҺӢеҜҶй—ӯе®№еҷЁдёӯпјҢеҸ‘з”ҹеҸҚеә”2CH3CH2OH(g)пјӢO2(g)
(3)е·ІзҹҘпјҡ25 в„ғпјҢKa(CH3COOH)пјқ1.75Г—10пјҚ5пјҢKb(NH3В·H2O)пјқ1.75Г—10пјҚ5пјҢ в‘ 25 в„ғпјҢ0.1 molВ·LпјҚ1CH3COOHжә¶ж¶Ізҡ„pHпјқ______пјӣе°Ҷ0.1 molВ·LпјҚ1CH3COOHжә¶ж¶ІдёҺ0.1 molВ·LпјҚ1зҡ„ж°Ёж°ҙзӯүдҪ“з§Ҝж··еҗҲпјҢжүҖеҫ—жә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰеӨ§е°Ҹе…ізі»дёә____________________________________гҖӮ в‘Ў25 в„ғпјҢ0.2 molВ·LпјҚ1NH4Clжә¶ж¶ІдёӯNH в‘ў25 в„ғпјҢеҗ‘0.1 molВ·LпјҚ1ж°Ёж°ҙдёӯеҠ е…Ҙе°‘йҮҸNH4ClеӣәдҪ“пјҢNH3В·H2OоҲҘоҲҰNH
|
|||||||||||||||
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
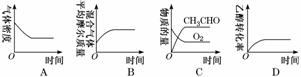
дёӢеҲ—еӣҫзӨәдёҺеҜ№еә”зҡ„еҸҷиҝ°зӣёз¬Ұзҡ„жҳҜ
A. еӣҫ1иЎЁзӨә1 L pHпјқ2зҡ„CH3COOHжә¶ж¶ІеҠ ж°ҙзЁҖйҮҠиҮіV LпјҢpHйҡҸlg Vзҡ„еҸҳеҢ– B. еӣҫ2иЎЁзӨәдёҚеҗҢжё©еәҰдёӢж°ҙжә¶ж¶ІдёӯHпјӢе’ҢOHпјҚжө“еәҰзҡ„еҸҳеҢ–зҡ„жӣІзәҝпјҢеӣҫдёӯжё©еәҰT2>T1 C. еӣҫ3иЎЁзӨәдёҖе®ҡжқЎд»¶дёӢзҡ„еҗҲжҲҗж°ЁеҸҚеә”дёӯпјҢNH3зҡ„е№іиЎЎдҪ“з§ҜеҲҶж•°йҡҸH2иө·е§ӢдҪ“з§ҜеҲҶж•°(N2зҡ„иө·е§ӢйҮҸжҒ’е®ҡ)зҡ„еҸҳеҢ–пјҢеӣҫдёӯaзӮ№N2зҡ„иҪ¬еҢ–зҺҮе°ҸдәҺbзӮ№ D. еӣҫ4иЎЁзӨәеҗҢдёҖжё©еәҰдёӢпјҢеңЁдёҚеҗҢе®№з§Ҝзҡ„е®№еҷЁдёӯиҝӣиЎҢеҸҚеә”2BaO2(s)
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©дёӢпјҢдёӢеҲ—еҗ„з»„зҰ»еӯҗеңЁжҢҮе®ҡжә¶ж¶ІдёӯдёҖе®ҡиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ A. дҪҝй…ҡй…һеҸҳзәўзҡ„жә¶ж¶ІдёӯпјҡMg2пјӢгҖҒAl3пјӢгҖҒNO B. дёҺAlеҸҚеә”иғҪж”ҫеҮәH2зҡ„жә¶ж¶ІдёӯпјҡNaпјӢгҖҒCu2пјӢгҖҒNO C. 0.1 molВ·LпјҚ1 Na2CO3жә¶ж¶ІдёӯпјҡNH D. c(HпјӢ)/c(OHпјҚ)пјқ1Г—1012зҡ„жә¶ж¶ІдёӯпјҡCa2+гҖҒNa+гҖҒSiO32-гҖҒHCO3-
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖз§ҚеҹәдәҺй…ёжҖ§зҮғж–ҷз”өжұ еҺҹзҗҶи®ҫи®Ўзҡ„й…’зІҫжЈҖжөӢд»ӘпјҢиҙҹжһҒдёҠзҡ„еҸҚеә”дёәпјҡ В CH3CH2OHп№Ј4e-+H2Oв•җCH3COOH+4H+пјҺдёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺз”өжұ еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡCH3CH2OH+O2в•җCH3COOH+H2O BпјҺиӢҘжңү0.4molз”өеӯҗиҪ¬з§»пјҢеҲҷеңЁж ҮеҮҶзҠ¶еҶөдёӢж¶ҲиҖ—4.48 Lж°§ж°” CпјҺжЈҖжөӢж—¶пјҢз”өи§ЈиҙЁжә¶ж¶Ідёӯзҡ„H+еҗ‘иҙҹжһҒ移еҠЁ DпјҺжӯЈжһҒдёҠеҸ‘з”ҹзҡ„еҸҚеә”дёәпјҡO2+4e-+2H2Oв•җ4OH-
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
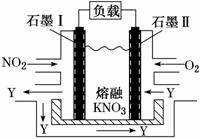
NO2гҖҒO2е’ҢзҶ”иһҚKNO3еҸҜеҲ¶дҪңзҮғж–ҷз”өжұ пјҢе…¶еҺҹзҗҶеҰӮеӣҫжүҖзӨәгҖӮиҜҘз”өжұ еңЁж”ҫз”өиҝҮзЁӢдёӯзҹіеўЁв… з”өжһҒдёҠз”ҹжҲҗж°§еҢ–зү©YпјҢYеҸҜеҫӘзҺҜдҪҝз”ЁгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺж”ҫз”өж—¶пјҢNO BпјҺзҹіеўЁв…Ўйҷ„иҝ‘еҸ‘з”ҹзҡ„еҸҚеә”дёәNOпјӢO2пјӢeпјҚ===NO CпјҺиҜҘз”өжұ жҖ»еҸҚеә”ејҸдёә4NO2пјӢO2===2N2O5 DпјҺеҪ“еӨ–з”өи·ҜйҖҡиҝҮ4 mol eпјҚж—¶пјҢиҙҹжһҒдёҠе…ұдә§з”ҹ2mol N2O5
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘ1gж°ўж°”е®Ңе…ЁзҮғзғ§з”ҹжҲҗж°ҙи’ёж°”ж—¶ж”ҫеҮәзғӯйҮҸ121kJпјҺдё”1mol ж°§ж°”еҲҶеӯҗдёӯзҡ„еҢ–еӯҰй”®е®Ңе…Ёж–ӯиЈӮж—¶ еҗёж”¶зғӯйҮҸ496kJпјҢж°ҙи’ёж°”дёӯ1mol Hп№ЈOй”®еҪўжҲҗж—¶ж”ҫеҮәзғӯйҮҸ463kJпјҢеҲҷж°ўж°”дёӯ1mol Hп№ЈHй”®ж–ӯиЈӮВ ж—¶еҗёж”¶зғӯйҮҸдёә AпјҺ920 kJ В В В В В BпјҺ557 kJВ В В В В В В CпјҺ436 kJВ В В В В В В DпјҺ188 kJ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
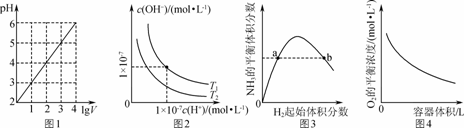
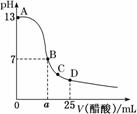
25 в„ғж—¶пјҢеҗ‘25 mL 0.1 molВ·LпјҚ1 NaOHжә¶ж¶ІдёӯйҖҗж»ҙеҠ е…Ҙ0.2 molВ·LпјҚ1йҶӢй…ёжә¶ж¶ІпјҢж»ҙе®ҡжӣІзәҝеҰӮеӣҫжүҖзӨәпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
BпјҺз”Ёеҗ«aзҡ„д»Јж•°ејҸиЎЁзӨәCH3COOHзҡ„з”өзҰ»еёёж•°Kпјқ CпјҺCзӮ№еҜ№еә”зҡ„жә¶ж¶ІдёӯпјҢж°ҙз”өзҰ»еҮәзҡ„HпјӢжө“еәҰеӨ§дәҺ10пјҚ7 molВ·LпјҚ1 DпјҺDзӮ№еҜ№еә”зҡ„жә¶ж¶ІдёӯпјҢеӯҳеңЁеҰӮдёӢе…ізі»пјҡ c(CH3COOпјҚ)пјҚc(CH3COOH)пјқ2c(HпјӢ)пјҚc(OHпјҚ)
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
В дёҖе®ҡжё©еәҰж—¶пјҢеҗ‘2.0 LжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯе……е…Ҙ2 mol SO2е’Ң1 mol O2пјҢеҸ‘з”ҹеҸҚеә”пјҡ 2SO2(g)пјӢO2(g)
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺеҸҚеә”еңЁеүҚ2 s зҡ„е№іеқҮйҖҹзҺҮv(O2) пјқ 0. 4 molВ·LпјҚ1В·sпјҚ1 BпјҺдҝқжҢҒе…¶д»–жқЎд»¶дёҚеҸҳпјҢдҪ“з§ҜеҺӢзј©еҲ°1.0 LпјҢе№іиЎЎеёёж•°е°ҶеўһеӨ§ CпјҺзӣёеҗҢжё©еәҰдёӢпјҢиө·е§Ӣж—¶еҗ‘е®№еҷЁдёӯе……е…Ҙ4 mol SO3пјҢиҫҫеҲ°е№іиЎЎж—¶пјҢSO3зҡ„иҪ¬еҢ–зҺҮеӨ§дәҺ10% DпјҺдҝқжҢҒжё©еәҰдёҚеҸҳпјҢеҗ‘иҜҘе®№еҷЁдёӯеҶҚе……е…Ҙ2 mol SO2гҖҒ1 mol O2пјҢеҸҚеә”иҫҫеҲ°ж–°е№іиЎЎж—¶n(SO3)/n(O2)еўһеӨ§
|
|||||||||||||
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
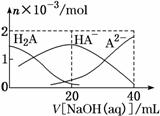
25 в„ғж—¶пјҢеҗ‘20 mL 0.1 molВ·LпјҚ1 H2Aжә¶ж¶Ідёӯж»ҙеҠ 0.1 molВ·LпјҚ1 NaOHжә¶ж¶ІпјҢжңүе…ізІ’еӯҗзү©иҙЁзҡ„йҮҸзҡ„еҸҳеҢ–еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜ
AпјҺH2AеұһдәҺејәй…ё B. CпјҺV[NaOH(aq)]пјқ20 mLж—¶пјҢжә¶ж¶ІдёӯеӯҳеңЁе…ізі»пјҡc(HAпјҚ)пјӢc(A2пјҚ)пјӢc(H2A)пјқ0.05 molВ·LпјҚ1 DпјҺV[NaOH(aq)]пјқ20 mLж—¶пјҢжә¶ж¶ІдёӯеӯҳеңЁе…ізі»пјҡc(NaпјӢ)>c(HAпјҚ)>c(HпјӢ)>c(A2пјҚ)>c(OHпјҚ)
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
25в„ғж—¶пјҢдёӢеҲ—жңүе…іжә¶ж¶Ідёӯеҫ®зІ’зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰе…ізі»жӯЈзЎ®зҡ„жҳҜ AпјҺжө“еәҰеқҮдёә0.1 mol/Lзҡ„Na2CO3дёҺNaHCO3ж··еҗҲжә¶ж¶Іпјҡ c(NaпјӢ)пјһc(CO BпјҺ0.1molВ·LпјҚ1CH3COOHдёҺ0.05molВ·LпјҚ1NaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲ(pHпјң7)пјҡ c(CH3COOпјҚ)пјһc(NaпјӢ)пјһcCH3COOH)пјһc(HпјӢ) CпјҺ0.1 molВ·LпјҚ1Na2CO3дёҺ0.05molВ·LпјҚ1 NaHCO3жә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲпјҡ 5c(NaпјӢ)пјқ3[c(CO DпјҺеңЁ0.1 molВ·LпјҚ1 NaHC2O4жә¶ж¶ІпјҲpHпјң7пјүдёӯпјҡc(OHпјҚ)пјӢc(C2O
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||
|
дёҖе®ҡжё©еәҰдёӢпјҢеңЁдёүдёӘе®№з§ҜеқҮдёә2.0 Lзҡ„жҒ’е®№еҜҶй—ӯе®№еҷЁдёӯеҸ‘з”ҹеҸҚеә”пјҡ 2NO(g)пјӢ2CO(g)
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺиҜҘеҸҚеә”зҡ„жӯЈеҸҚеә”дёәеҗёзғӯеҸҚеә” BпјҺиҫҫеҲ°е№іиЎЎж—¶пјҢд№ҷдёӯCO2зҡ„дҪ“з§ҜеҲҶж•°жҜ”з”Ідёӯзҡ„е°Ҹ CпјҺT1в„ғж—¶пјҢиӢҘиө·е§Ӣж—¶еҗ‘з”Ідёӯе……е…Ҙ0.40 mol NOгҖҒ0.40mol COгҖҒ0.40mol N2е’Ң0.40mol CO2пјҢеҲҷеҸҚеә”иҫҫеҲ°ж–°е№іиЎЎеүҚv(жӯЈ)пјңv(йҖҶ) DпјҺT2в„ғж—¶пјҢиӢҘиө·е§Ӣж—¶еҗ‘дёҷдёӯе……е…Ҙ0.06molN2е’Ң0.12 molCO2пјҢеҲҷиҫҫе№іиЎЎж—¶N2зҡ„иҪ¬еҢ–зҺҮеӨ§дәҺ40%
|
|||||||||||||||||||
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҢҮе®ҡеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜ AпјҺNa2CO3ж°ҙи§ЈпјҡCO BпјҺNaHSO4жә¶ж¶Ідёӯж»ҙеҠ Ba(OH)2жә¶ж¶ІиҮідёӯжҖ§пјҡBa2пјӢ+2OHпјҚ+2HпјӢ+SO42пјҚпјқBaSO4вҶ“+2H2O CпјҺCuдёҺзЁҖHNO3еҸҚеә”пјҡCuпјӢ4HпјӢпјӢ2NO DпјҺйҶӢй…ёйҷӨж°ҙеһўпјҡCO
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
В еңЁеҜҶй—ӯе®№еҷЁдёӯпјҢm A(g)+n B(g) AпјҺе№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁВ В В В В В В В В В В В В В BпјҺзү©иҙЁBзҡ„иҪ¬еҢ–зҺҮеҮҸе°Ҹ CпјҺ m + n <pВ В В В В В В В В В В В В В В В В В В В В В В В DпјҺзү©иҙЁCзҡ„дҪ“з§ҜеҲҶж•°еўһеҠ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘеёёжё©дёӢKsp(AgCl)пјқ1.6Г—10пјҚ10гҖҒKsp(AgI)пјқ2.0Г—10пјҚ16пјҢдёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺеҗ«жңүеӨ§йҮҸClпјҚзҡ„жә¶ж¶ІдёӯиӮҜе®ҡдёҚеӯҳеңЁAgпјӢ BпјҺеҗ‘AgIжӮ¬жөҠж¶ІдёӯеҠ е…Ҙе°‘йҮҸKIзІүжң«пјҢе№іиЎЎAgI(s) CпјҺеҗ‘AgClжӮ¬жөҠж¶ІдёӯйҖҗжёҗеҠ е…ҘKIеӣәдҪ“иҮіc(IпјҚ)пјқ DпјҺеҗ‘жө“еәҰеқҮдёә0.01 molВ·LпјҚ1зҡ„KClе’ҢKIзҡ„ж··еҗҲжә¶ж¶Ідёӯж»ҙеҠ AgNO3жә¶ж¶ІпјҢеҪ“ClпјҚејҖе§ӢжІүж·Җж—¶пјҢжә¶ж¶ІдёӯIпјҚзҡ„жө“еәҰдёә1.25Г—10пјҚ8 molВ·LпјҚ1
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
В ж‘©е°”зӣҗ[xFeSO4В·y(NH4)2SO4В·zH2O]жҳҜдёҖз§ҚйҮҚиҰҒеҢ–е·ҘеҺҹж–ҷгҖӮе…¶з»„жҲҗеҸҜйҖҡиҝҮдёӢеҲ—е®һйӘҢжөӢе®ҡпјҡ в‘ з§°еҸ–1.5680 gж ·е“ҒпјҢеҮҶзЎ®й…ҚжҲҗ100 mLжә¶ж¶ІAгҖӮ в‘Ў йҮҸеҸ–25.00 mLжә¶ж¶ІAпјҢеҠ е…Ҙзӣҗй…ёй…ёеҢ–зҡ„BaCl2жә¶ж¶ІиҮіжІүж·Җе®Ңе…ЁпјҢиҝҮж»ӨгҖҒжҙ—ж¶ӨпјҢе№ІзҮҘиҮіжҒ’йҮҚпјҢеҫ—еҲ°зҷҪиүІеӣәдҪ“0.4660 gгҖӮ в‘ў еҶҚйҮҸеҸ–25.00 mLжә¶ж¶ІAпјҢж»ҙеҠ йҖӮйҮҸзЁҖзЎ«й…ёпјҢз”Ё0.0200 molВ·LпјҚ1KMnO4жә¶ж¶Іж»ҙе®ҡиҮіз»ҲзӮ№пјҢз”ҹжҲҗMn2пјӢпјҢж¶ҲиҖ—KMnO4жә¶ж¶І10.00 mLгҖӮ пјҲ1пјүе·ІзҹҘе®Өжё©дёӢBaSO4зҡ„Kspпјқ1.1Г—10пјҚ10пјҢж¬ІдҪҝжә¶ж¶Ідёӯc(SO пјҲ2пјүв‘ўдёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәВ В В В В В пјҢж»ҙе®ҡз»ҲзӮ№зҡ„зҺ°иұЎжҳҜВ В В В В В гҖӮ пјҲ3пјүйҖҡиҝҮи®Ўз®—зЎ®е®ҡж ·е“Ғзҡ„з»„жҲҗ(еҝ…йЎ»еҶҷеҮәи®Ўз®—иҝҮзЁӢ)гҖӮ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
В ж №жҚ®дёӢеҲ—е®һйӘҢж“ҚдҪңе’ҢзҺ°иұЎжүҖеҫ—еҮәзҡ„з»“и®әй”ҷиҜҜзҡ„жҳҜ
|
|||||||||||||||||||||
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
В 1909е№ҙеҢ–еӯҰ家е“ҲдјҜеңЁе®һйӘҢе®ӨйҰ–ж¬ЎеҗҲжҲҗдәҶж°ЁгҖӮ2007е№ҙеҢ–еӯҰе®¶ж је“Ҳеҫ·В·еҹғзү№е°”еңЁе“ҲдјҜз ”з©¶жүҖиҜҒе®һдәҶж°ўж°”дёҺж°®ж°”еңЁеӣәдҪ“иЎЁйқўеҗҲжҲҗж°Ёзҡ„еҸҚеә”иҝҮзЁӢпјҢзӨәж„ҸеҰӮдёӢеӣҫпјҡ
пјҲ1пјүеӣҫв‘ӨиЎЁзӨәз”ҹжҲҗзҡ„NH3зҰ»ејҖеӮ¬еҢ–еүӮиЎЁйқўпјҢеӣҫв‘Ўе’Ңеӣҫв‘ўзҡ„еҗ«д№үеҲҶеҲ«жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҢВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ2пјүе·ІзҹҘпјҡ4NH3(g) + 3O2(g) = 2NВӯВӯ2(g) + 6H2O(g);В В О”H=В - 1266.8 kJ/mol N2(g) + O2(g) = 2NO(g) ;В О”H = + 180.5kJ/molпјҢ ж°ЁеӮ¬еҢ–ж°§еҢ–зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸдёә В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ3пјү500в„ғдёӢпјҢеңЁAгҖҒBдёӨдёӘе®№еҷЁдёӯеқҮеҸ‘з”ҹеҗҲжҲҗж°Ёзҡ„еҸҚеә”гҖӮйҡ”жқҝв… еӣәе®ҡдёҚеҠЁпјҢжҙ»еЎһв…ЎеҸҜиҮӘз”ұ移еҠЁгҖӮ
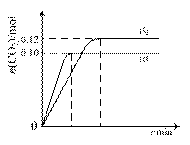
в‘ еҪ“еҗҲжҲҗж°ЁеңЁе®№еҷЁBдёӯиҫҫе№іиЎЎж—¶пјҢжөӢеҫ—е…¶дёӯеҗ«жңү1.0molN2пјҢ0.4molH2пјҢ0.4molNH3пјҢжӯӨж—¶е®№з§Ҝдёә2.0LгҖӮеҲҷжӯӨжқЎд»¶дёӢзҡ„е№іиЎЎеёёж•°дёәВ В В В В В В В В В В В В В В пјӣдҝқжҢҒжё©еәҰе’ҢеҺӢејәдёҚеҸҳпјҢеҗ‘жӯӨе®№еҷЁдёӯйҖҡе…Ҙ0.36molN2пјҢе№іиЎЎе°ҶВ В В В В В В В В В В В В пјҲеЎ«вҖңжӯЈеҗ‘вҖқгҖҒвҖңйҖҶеҗ‘вҖқжҲ–вҖңдёҚвҖқпјү移еҠЁгҖӮ в‘Ўеҗ‘AгҖҒBдёӨе®№еҷЁдёӯеқҮйҖҡе…ҘxmolN2е’ҢymolH2пјҢеҲқе§ӢAгҖҒBе®№з§ҜзӣёеҗҢпјҢ并дҝқжҢҒжё©еәҰдёҚеҸҳгҖӮиӢҘиҰҒе№іиЎЎж—¶дҝқжҢҒN2еңЁAгҖҒBдёӨе®№еҷЁдёӯзҡ„дҪ“з§ҜеҲҶж•°зӣёеҗҢпјҢеҲҷxдёҺyд№Ӣй—ҙеҝ…йЎ»ж»Ўи¶ізҡ„е…ізі»ејҸдёәВ В В В В В В В В В В В В В В В В В В гҖӮ (4) д»ҘCOе’ҢO2дёәз”өжһҒзҮғж–ҷпјҢд»ҘзҶ”иһҚK2CO3дёәз”өи§ЈиҙЁз»„жҲҗзҮғж–ҷз”өжұ пјҢиҜ·еҶҷеҮәиҜҘз”өжұ зҡ„иҙҹжһҒеҸҚеә”ж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
I. H2AеңЁж°ҙдёӯеӯҳеңЁд»ҘдёӢе№іиЎЎпјҡH2A пјҲ1пјүNaHAжә¶ж¶Іжҳҫй…ёжҖ§пјҢеҲҷжә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰзҡ„еӨ§е°ҸйЎәеәҸдёә_____гҖӮ пјҲ2пјүеёёжё©ж—¶пјҢиӢҘеҗ‘0.1 mol/Lзҡ„NaHAжә¶ж¶ІдёӯйҖҗж»ҙж»ҙеҠ 0.1mol/L KOHжә¶ж¶ІиҮіжә¶ж¶Іе‘ҲдёӯжҖ§гҖӮжӯӨж—¶иҜҘж··еҗҲжә¶ж¶Ізҡ„дёӢеҲ—е…ізі»дёӯпјҢдёҖе®ҡжӯЈзЎ®зҡ„жҳҜ_____гҖӮ AпјҺc(Na+ )пјһc(K+)В В В В BпјҺc(H +)вҖўc(OH)пјқ1Г—10-14 CпјҺc(Na+ )пјқc(K+)В В В В DпјҺc(Na+ )пјӢc(K+ )пјқc(HAпјҚ)пјӢc(A2- ) пјҲ3пјүе·ІзҹҘеёёжё©дёӢH2Aзҡ„й’ҷзӣҗ(CaA)йҘұе’Ңжә¶ж¶ІдёӯеӯҳеңЁд»ҘдёӢе№іиЎЎпјҡCaA(s) в…Ў.еҗ«жңүCr2O72-зҡ„еәҹж°ҙжҜ’жҖ§иҫғеӨ§пјҢжҹҗе·ҘеҺӮеәҹж°ҙдёӯеҗ«4.00Г—10-3 mol/Lзҡ„Cr2O72пјҚгҖӮдёәдҪҝеәҹж°ҙиғҪиҫҫж ҮжҺ’ж”ҫпјҢдҪңеҰӮдёӢеӨ„зҗҶпјҡ пјҲ4пјүиҜҘеәҹж°ҙдёӯеҠ е…ҘFeSO4В·7H2Oе’ҢзЁҖзЎ«й…ёпјҢеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҡ_____гҖӮ В В В пјҲ5пјүж¬ІдҪҝ25 LиҜҘеәҹж°ҙдёӯCr2O72- иҪ¬еҢ–дёәCr3+пјҢзҗҶи®әдёҠйңҖиҰҒеҠ е…Ҙ_____g FeSO4В·7H2OгҖӮ В В В пјҲ6пјүиӢҘеӨ„зҗҶеҗҺзҡ„еәҹж°ҙдёӯж®Ӣз•ҷзҡ„c(Fe)пјқ1Г—10-13mol/LпјҢеҲҷж®Ӣз•ҷзҡ„ Cr3+ зҡ„жө“еәҰдёә_____гҖӮпјҲе·ІзҹҘпјҡKsp[Fe(OH)3]вүҲ1.0Г—10-38mol/LпјҢKsp[Cr(OH)3]вүҲ1.0Г—10-31 mol/L пјү
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ғзҙ XдҪҚдәҺ第еӣӣе‘ЁжңҹпјҢе…¶еҹәжҖҒеҺҹеӯҗжңү4дёӘжңӘжҲҗеҜ№з”өеӯҗгҖӮYеҺҹеӯҗжңҖеӨ–еұӮз”өеӯҗж•°жҳҜе…¶еҶ…еұӮз”өеӯҗжҖ»ж•°зҡ„3еҖҚпјҢе…ғзҙ ZеҹәжҖҒеҺҹеӯҗзҡ„3pиҪЁйҒ“дёҠжңү4дёӘз”өеӯҗгҖӮ (1) YдёҺZеҸҜеҪўжҲҗеӨҡз§ҚеҢ–еҗҲзү©гҖӮ в‘ е…ғзҙ YдёҺZдёӯз”өиҙҹжҖ§иҫғеӨ§зҡ„жҳҜ________(з”Ёе…ғзҙ з¬ҰеҸ·жҸҸиҝ°)гҖӮ в‘Ў зҰ»еӯҗZY
(2) Yзҡ„ж°ўеҢ–зү©(H2Y)еңЁд№ҷйҶҮдёӯзҡ„жә¶и§ЈеәҰеӨ§дәҺH2ZпјҢе…¶еҺҹеӣ жҳҜ________гҖӮ (3) еҗ«X2пјӢзҡ„жә¶ж¶ІдёҺKCNгҖҒж°Ёж°ҙеҸҚеә”еҸҜеҫ—еҲ°еҢ–еҗҲзү©K3[X(CN)5(NH3)]гҖӮ В 1 molй…ҚеҗҲзү©K3[X(CN)5(NH3)]дёӯеҗ«Пғй”®зҡ„ж•°зӣ®дёә________гҖӮ (4) еҸіеӣҫдёәXдёҺZжүҖеҪўжҲҗзҡ„дёҖз§ҚеҢ–еҗҲзү©зҡ„еҹәжң¬з»“жһ„еҚ•е…ғпјҢжҺЁжөӢиҜҘеҢ–еҗҲзү©зҡ„еҢ–еӯҰејҸдёә________гҖӮ
|
|
- 2019-2020е№ҙй«ҳдёҖеүҚеҚҠжңҹ12жңҲжңҲиҖғеҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲжІіеҚ—зңҒе®үйҳіеёӮжһ—е·һеёӮ第дёҖдёӯеӯҰпјү
- 2018-2019е№ҙй«ҳдәҢдёҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲзҰҸе»әзңҒе…«еҺҝдёҖдёӯпјү
- жҷҜеҫ·й•ҮдёҖдёӯй«ҳдәҢеҢ–еӯҰ2019е№ҙдёҠеҚҠжңҹжңҹдёӯиҖғиҜ•зҪ‘дёҠеңЁзәҝеҒҡйўҳ
- 2019-2020е№ҙй«ҳдёҖеүҚеҚҠжңҹ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰиҖғйўҳпјҲжІіеҚ—зңҒеҚ—йҳіеёӮй•Үе№іеҺҝ第дёҖй«ҳзә§дёӯеӯҰпјү
- 2019-2020е№ҙй«ҳдёҖдёҠеҚҠе№ҙжңҹжң«иҖғиҜ•еҢ–еӯҰиҜ•еҚ·пјҲе®ҒеӨҸеҗҙеҝ дёӯеӯҰпјү
- еҢ—дә¬еёӮй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•еҗҢжӯҘиҖғиҜ•жЈҖжөӢ
- 2018-2019е№ҙй«ҳдәҢдёҠеҶҢжңҹжң«иҖғиҜ•еҢ–еӯҰиҖғиҜ•е®Ңж•ҙзүҲпјҲеҗүжһ—зңҒй•ҝжҳҘеёӮ第еҚҒдёҖй«ҳдёӯпјү
- 2018иҮі2019е№ҙй«ҳдёҖдёӢеҚҠжңҹ第дәҢж¬Ўи°ғз ”иҖғиҜ•еҢ–еӯҰйўҳејҖеҚ·жңүзӣҠпјҲе®үеҫҪзңҒйҳңйҳіеёӮ第дёүдёӯеӯҰпјү