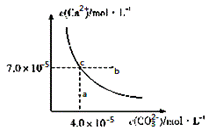2020甘肃高二上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
下列说法不正确的是( ) A.化学反应除了生成新物质外,还伴随着能量的变化 B.化学反应是放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量 C.吸热反应在一定条件(如高温、加热等)下也能发生 D.放热的反应在常温下一定很容易发生
|
|
| 2. | 详细信息 |
|
下列说法正确的是( ) A.由“C(石墨)=C(金刚石) ΔH= +1.9kJ·mol-1”可知,金刚石比石墨稳定 B.500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ D.X(g)+Y(g)
|
|
| 3. | 详细信息 |
|
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O A.放电时电解质溶液中的OH-向正极移动 B.充电过程是化学能转化为电能的过程 C.放电时负极附近溶液的碱性增强 D.充电时阳极反应:Ni(OH)2-e- + OH- = NiOOH + H2O
|
|
| 4. | 详细信息 |
|
设C+CO2 A.同时增大 B.同时减小 C.v1增大,v2减小 D.v1减小,v2增大
|
|
| 5. | 详细信息 |
|
一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)
A.t1 min时正、逆反应速率相等 B.X曲线表示NH3的物质的量随时间变化的关系 C.0~8min,H2的平均反应速率v(H2)=3/4mol·L-1·min-1 D.10min,改变条件为升温
|
|
| 6. | 详细信息 |
|
下列过程一定不能自发进行的是( ) A.2N2O5(g)=4NO2(g)+O2(g) ΔH>0 B.2H2(g)+O2(g)=2H2O(l) ΔH<0 C.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ΔH>0 D.2CO(g)=2C(s)+O2(g) ΔH>0
|
|
| 7. | 详细信息 |
|
稀氨水中存在着下列平衡:NH3·H2O ①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgCl2固体。 A.①②③⑤ B.③⑥ C.③ D.③⑤
|
|
| 8. | 详细信息 |
|
下列溶液肯定显酸性的是( ) A. C.
|
|
| 9. | 详细信息 |
|
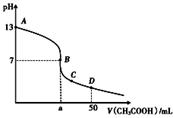
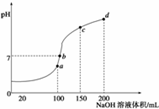
在25mL0.1mol·L-1某一元碱中,逐滴加入0.1mol·L-1醋酸,滴定曲线如图所示。则下列说法不正确的是( ) A.该碱溶液可以溶解Al(OH)3 B.a点对应的体积值大于25mL C.C点时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) D.D点时,c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH)
|
|
| 10. | 详细信息 |
|
下列事实:①NaHSO4溶液呈酸性;②长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结;③配制CuCl2溶液,用稀盐酸溶解CuCl2固体;④NaHS溶液中c(H2S)>c(S2-);⑤氯化铵溶液可去除金属制品表面的锈斑;⑥加热FeCl3·6H2O晶体,往往得不到FeCl3固体。 其中与盐类的水解有关的叙述有( ) A.6项 B.5项 C.3项 D.4项
|
|
| 11. | 详细信息 |
|
下列有关实验操作的叙述正确的是( ) A.中和滴定实验中指示剂不宜加入过多,通常控制在 1mL 至 2mL B.在50mL碱式滴定管中装氢氧化钠溶液至5mL刻度处,把液体全部放入烧杯,液体体积为 45mL C.碱式滴定管可以用来装碱性和氧化性的溶液 D.用标准盐酸测定未知浓度NaOH结束实验时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡,所测结果偏低
|
|
| 12. | 详细信息 |
|
下列离子组因发生双水解反应而不能大量共存的是( ) A.Ba2+、NH4+、SO42-、OH- B.H+、Na+、NO3-、I- C.Al3+、K+、HCO3-、NO3- D.H+、Ca2+、CO32-、Cl-
|
|
| 13. | 详细信息 |
|
. A. B. C. D.
|
|
| 14. | 详细信息 |
|
在 A.除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除 B.图中b点碳酸钙的结晶速率小于其溶解速率 C.通过蒸发,可使溶液由a点变化到c点 D.在25℃时,反应
|
|
| 15. | 详细信息 |
|
下图是一套电化学装置,对其有关说法错误的是( )
A.装置A是原电池,装置B是电解池 B.反应一段时间后,装置B中溶液pH增大 C.a若消耗1mol CH4,d可产生4mol气体 D.a通入C2H6时的电极反应为 C2H6-14e-+ 18OH-= 2CO32-+ 12H2O
|
|
| 16. | 详细信息 |
|
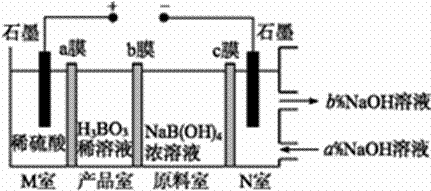
现代膜技术可使某种离子具有单向通过能力,常用于电解池、原电池中。电解NaB(OH)4溶液可制备H3BO3,其工作原理如图。下列叙述错误的是( )
A.M室发生的电极反应式:2H2O-4e- B.N室:a<b C.产品室发生的反应是B(OH)4- +H+ D.理论上每生成1 mol产品,阴极室可生成标准状况下5.6 L气体
|
|
| 17. | 详细信息 | |||||||||||||||
|
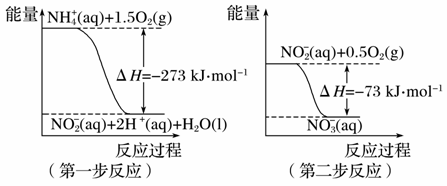
I. 在微生物作用的条件下,NH
(1)第一步反应是________(填“放热”或“吸热”)反应。 (2)1molNH II 甲醇作为可再生能源,越来越受到人们的关注。已知甲醇制备的有关化学反应的平衡常数及焓变数据如下
(1)反应③的K3=__________________,ΔH3=__________________。 (2)500℃时,将2molCO和2molH2充入2L的恒容密闭容器中发生反应②,5min后达到平衡后,则0~5min内,用H2表示的反应速率v(H2)=________。 (3)500℃时,测得反应③在某时刻CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.1、0.8、0.3、0.15,则此时v正_________v逆(填“>”“<”或“=”)。 (4) 若一定量的CO2和H2在绝热恒容的条件下发生上述反应②,下列可以作为判断该反应达到平衡的标志有 。 a.混合气体的平均相对分子质量不再改变 b.混合气体中CO2、H2、H2O、CO(g)的含量相等 c. v(CO2)生成=v(CO)消耗 d.容器内温度不再变化
|
||||||||||||||||
| 18. | 详细信息 |
|
某兴趣小组为研究原电池原理,设计如图甲乙两个原电池装置。
(1)如图甲,a和b用导线连接,Cu电极的电极反应式为:________,溶液中SO42-移向______(填“Cu”或“Fe”)极。 (2) 如图乙所示的原电池装置中,负极材料是_____。正极上能够观察到的现象是_______________。 负极的电极反应式是_________________。原电池工作一段时间后,若消耗负极5.4g ,则放出气体______mol。 (3) 将反应Cu + Fe2(SO4)3=2FeSO4 + CuSO4设计成盐桥电池并画图
(4)依据Ba(OH)2·8H2O与NH4Cl晶体的反应原理设计原电池,你认为是否可行并说明理由______。
|
|
| 19. | 详细信息 | ||||||||
|
请按要求回答下列问题: (1) 25 ℃时,向纯水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为_____________,由水电离出的c(OH-)=________mol·L-1。 (2)电离常数是衡量弱电解质电离程度强弱的物理量。已知:
①25 ℃时,有等pH的a.NaCN溶液、b.Na2CO3溶液和c.CH3COONa溶液,三溶液的浓度由大到小的顺序为___________________________。(用a b c表示) ②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为_________。
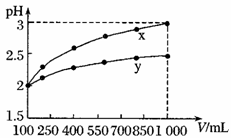
试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是_____________________________。
|
|||||||||
| 20. | 详细信息 |
|
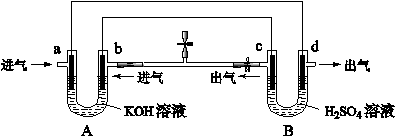
(1)实验一:将开关K与a连接,则乙为________极,电极反应式为 ____________________________________________________________。 (2)实验二:开关K与b连接,则乙________极,总反应的离子方程式为 ____________________________________________________________。 (3)对于实验二,下列说法正确的是________(填字母编号)。 A.溶液中Na+向甲极移动 B.从甲极处逸出的气体能使湿润的淀粉-KI试纸变蓝 C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 D.相同条件下,电解一段时间后,甲电极和乙电极上收集到的气体体积一定相等 (4)该研究小组的同学在进行实验二结束的溶液中滴加酚酞溶液,发现________(填“甲”或“乙”)极附近变红。若标准状况下乙电极产生22.4 mL气体,剩余溶液体积为200 mL,则该溶液的pH为_____。
|
|