2019安徽高一上学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
下列做法不能体现低碳生活的是( ) A. 注意节约用水 B. 减
|
|
| 2. | 详细信息 |
|
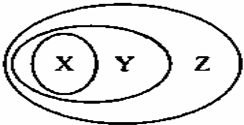
下图所表示的一些物质或概念间的从属关系不正确的是( )
|
|
| 3. | 详细信息 |
|
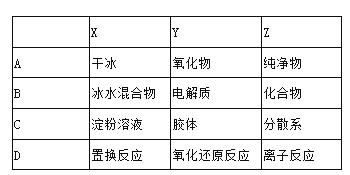
下列说法中正确的是( ) A. 1 L 水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L B. 从1 L 2 mol/L的H2SO4 溶液中取出0.5 L,取出溶液的浓度为1 mol/L C. 配制500 mL 0.2 mol/L的CuSO4溶液,需25.0 g CuSO4·5H2O D. 中和100 mL 1 mol/L的H2SO4溶液,需NaOH 4.0 g
|
|
| 4. | 详细信息 |
|
在透明溶液中能大量共存的是( ) A. OH-、K+、NO3-、HCO3- B. Na+、Fe3+、K+、Cl- C. Ca2+、H+、NO3-、CO32- D. Cu2+、Na+、OH-、SO42-
|
|
| 5. | 详细信息 |
|
下列离子方程式正确的是( ) A. 稀盐酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑ B. 硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaS04↓ C. 足量盐酸滴在石灰石上:CaCO3+2H+=Ca2++CO2↑+H2O D. 物质的量相等的MgCl2、Ba(OH)2、HC1三种溶液混合:Mg2++2OH-═Mg(OH)2↓
|
|
| 6. | 详细信息 |
|
用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( ) A. 标况下,22.4 L氧气的分子 B. 100 g质量分数为49%的浓硫酸中所含氧原子数为2NA C. 常温常压下,92 g NO2和N2O4的混合气体含有的原子数为6NA D. 标况下,22.4L氯气溶于足量的水中,其中含有的Cl-数小于NA
|
|
| 7. | 详细信息 |
|
《美国化学会志》报道了中国科学家以CO2和Na在一定条件下制得金刚石,该反应的化学方程式为:3CO2+4Na=2X+C(金刚石)。设NA为阿伏加德罗常数的数值,下列有关此反应的叙述中不正确的是( ) A. X的化学式为Na2CO3 B. 在该反应中Na C. 当有0.4 mol Na参加反应时,消耗的CO2的体积为6.72 L D. 当有3 molCO2参加反应时,生成的金刚石中含有的电子数目为6NA
|
|
| 8. | 详细信息 |
|
下列叙述中不正确的是( ) A. Na2O2是淡黄色固体,Na2O是白色固体,二者与水反应都能生成NaOH B. Na2O和Na2O2阴阳离子配比相同,均为1:2 C. lmol H2充分燃烧后,产物被Na2O2完全吸收,Na2O2固体增重18g D. 120℃时,0.5mol CO2和水蒸气的混合气体与足量Na2O2充分反应后,剩余气体质量为8g
|
|
| 9. | 详细信息 |
|
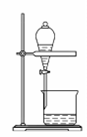
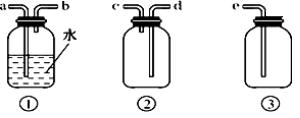
用下图所示装置进行如下实验,能达到实验目的的是 A. 瓶中盛满水,从B口进气,用排水法收集HCl气体 B. 瓶中盛适量浓硫酸,从B口进气来干燥Cl2 C. 从B口进气,用排空气法收集CO2 D. 瓶中盛满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
|
|
| 10. | 详细信息 |
|
下列关于Na2CO3、NaHCO3说法正确的是( ) A. 受热时Na2CO3较NaHCO3更不稳定,更易分解产生CO2 B. 等质量的Na2CO3、NaHCO3与足量盐酸反应,前者产生的CO2更多 C. 向Na2CO3、NaHCO3溶液中分别滴加澄清石灰水,前者产生白色沉淀,后者无沉淀 D. 等物质的量的两种盐与足量盐酸完全反应,所消耗HCl的物质的量Na2CO3是NaHCO3的两倍
|
|
| 11. | 详细信息 |
|
当不慎有大量氯气扩散到周围空间时,处在该环境中的人可以用浸有一定浓度某物质水溶液的毛巾捂住鼻子,以防中毒,最适合采用的是( ) A. NaOH B. NaCl C. NaHCO3 D. NH3·H2O
|
|
| 12. | 详细信息 |
|
下列叙述正确的是( ) A. 金属阳离子被还原后,一定得到该元素的单质 B. 元素由化合态变成游离态时,它可能被氧化,也可能被还原 C. 失电子难的原子,获得电子的能力一定强 D. 有单质参加或生成的反应一定属于氧化还原反应
|
|
| 13. | 详细信息 |
|
重金属离子具有毒性。实验室中有甲、乙两种含有重金属离子的废液,甲废液经化验呈碱性,主要为有毒离子为Ba2+,如将甲、乙两废液按一定比例混合,毒性明显降低。则乙废液中可能含有的离子是( ) A. Cu2+和SO42- B. Cu2+和Cl C. K+和SO42- D. Ag+和NO3
|
|
| 14. | 详细信息 |
|
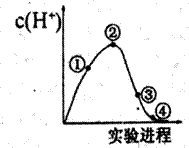
常温常压下,将C12缓慢通入100 mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1 mol·L-1 NaOH溶液,整个过程溶液中H+的浓度变化如图所示。(已知常温常压下C12溶于水时,只有部分C12会和水发生反应
B. 依据②处c(H+)可计算溶解的C12的物质的量 C. 整个实验过程中,溶液的颜色先变深后变浅,最后变为无色 D. ④处表示C12与NaOH溶液恰好完全反应,共转移了0.1mol电子
|
|
| 15. | 详细信息 |
|
完成下列各题.(1)下列实验装置一般用于什么实验操作(填实验操作名称)
① ② ③ ④ (2)标准状况下,2.24 L Cl2的质量为__________;有__________个氯原子。 (3)10.8g R2O5中氧原子的数目为3.01×1023, 则元素R的相对原子质量为________;R元素名称是_______。 (4)如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(设NA为阿伏加德罗常数)______________。 (5)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。则该混合气体中CH4和O2的体积比为_______。 (6)物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为5∶3∶2时,三种溶液中c(Cl−)之比为____________ 。
|
|
| 16. | 详细信息 |
|
下列判断正确的是( ) A. 酸性氧化物一定是非金属氧化物 B. 碱性氧化物一定是金属氧化物 C. SO2 溶于水能导电所以SO2 是电解质 D. Na2O是非电解质
|
|
| 17. | 详细信息 |
|
分类是化学研究中常用的方法,下列分类方法中,不正确的是( A. 依据分子中含有的氢原子的数目,将酸分为一元酸、二元酸等 B. 依据在水溶液中或熔融状态下能否导电,将化合物分为电解质和非电解质 C. 依据分散质粒子的大小,将分散系分为溶液、胶体、浊液 D. 依据组成的元素的种类,将纯净物分为单质和化合物
|
|
| 18. | 详细信息 |
|
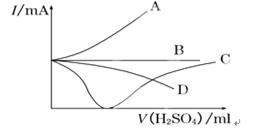
向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度Ⅰ表示)近似的用下图中的曲线表示是( )
|
|
| 19. | 详细信息 |
|
下列各组中的两种物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是( ) A. Na2O2和H2O B. Na和O2 C. Ca(OH)2和CO2 D. C和O2
|
|
| 20. | 详细信息 |
|
下列分离物质的方法正确的是( ) A. 用萃取的方法 C. 用酒精萃取碘水中的碘 D. 用蒸馏的方法除去水中的不挥发性杂质
|
|
| 21. | 详细信息 |
|
下列反应中,水既不做氧化剂,又不做还原剂的是( ) A. Cl2+H2O=HCl+HClO B. 2H2O
|
|
| 22. | 详细信息 |
|
(1)仪器P的名称是______。 (2)写出装置A中烧瓶内发生反应的化学方程式:_____________________,在该反应中氧化剂是 ,还原剂是 ,用双线桥法标出电子转移的方向和数目 。
(4)F为ClO2收集装置,应选用的装置是______________(填序号),其中与E装置导管相连的导管口是__________(填接口字母)。 (5)若用100 mL 12 mol·L-1的浓盐酸与足量的MnO2制备Cl2,则生成Cl2的物质的量是________(填序号)。 A.>0.3 mol B.0.3mol C.<0.3 mol D.无法判断
|
|
| 23. | 详细信息 | |||||||||||||||
|
.某实验小组设计实验证明某碳酸钠粉末中混有硫酸钠和氯化钠,请完成下列空白:
|
||||||||||||||||
| 24. | 详细信息 |
|
取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出。试计算: (1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度分别为____________、___________; (2)产生的气体在标准状况下的体积_____________。 (3)已知t℃时Na2CO3的溶解度为Sg,该温度
|
|