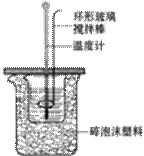2020甘肃高二上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
在中和反应反应热的测定实验中,不需要用到的仪器是 A.玻璃棒 B.烧杯 C.温度计 D.环形玻璃搅拌棒
|
|
| 2. | 详细信息 |
|
下列说法或表示不正确的是 A.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 B.C(金刚石,s)=C(石墨,s) △H=−1.19kJ·mol−1,所以石墨比金刚石稳定 C.含1m D.在101 kPa下,2 g H2 完全燃烧生成液态水放出285.8kJ热量,其热化学方程式为H2(g)+
|
|
| 3. | 详细信息 |
|
关于中和热测定实验的下列说法不正确的
A.烧杯间填满碎泡沫塑料是减少实验过程中的热量损失 B.向盛装酸的烧杯中加碱时要小心缓慢 C.使用环形玻璃棒既可以搅拌又避免损坏温度计 D.测定酸后的温度计要用蒸馏水清洗干燥后再测碱的温度
|
|
| 4. | 详细信息 |
|
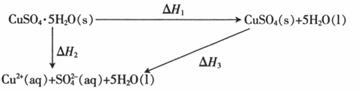
室温下,CuSO4·5H2O(s)、CuSO4(s)与其水溶液之间转化的焓变关系如图:
已知CuSO4·5H2O(s)溶于水,溶液温度降低;CuSO4(s)溶于水,溶液温度升高。 下列有关说法正确的是 A.从硫酸铜溶液中析出CuSO4·5H2O(s)的反应焓变△H>0 B.1mol CuSO4(s)的总能量大于1mol Cu2+(aq)与1mol SO42−(aq)的总能量 C.△H2<△H1 D.△H1=△H2+△H3
|
|
| 5. | 详细信息 |
|
一定条件下,发生反应:①M(s)+N(g) A.1mol R(g)的能量总和大于1mol M(s)与1mol N(g)的能量总和 B.将2mol R(g)与1mol N(g)在该条件下反应,可以放出热量Q2 kJ C.当1mol M(s)完全转化为T(g)时(假定无热量损失),放出热量 D.M(g)+N(g)
|
|
| 6. | 详细信息 |
|
已知:2H2(g)+O2(g)=2H2O(l) ΔH=−571.6kJ·mol−1 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=−1452kJ·mol−1 H+(aq)+OH−(aq)=H2O(l) ΔH=−57.3kJ·mol−1 下列说法正确的是 A.H2(g)的燃烧热为571.6kJ·mol−1 B.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) ΔH=−57.3 kJ·mol−1 C.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol−1 D.等质量的H2(g)和CH3OH(l)完全燃烧,H2(g)燃烧放出的热量多
|
|
| 7. | 详细信息 |
|
同体积的1mol/L的HCl、H2SO4、CH3COOH、HNO3分别加入过量的Mg。下列叙述正确的是 A.HNO3、HCl、H2SO4中放出H2的速率相同 B.HCl、HNO3中放出H2的量相等 C.HCl、CH3COOH中放出H2的量相等 D.H2SO4中放出H2的量最多,其余的
|
|
| 8. | 详细信息 |
|
在密闭容器中,一定条 A.加催化剂同时升高温度 B.加催化剂同时增大压强 C.升高温度同时充入N2 D.降低温度同时增大压强
|
|
| 9. | 详细信息 |
|
某恒容密闭容器中充入1molPCl5气体,发生反应:PCl5(g)
A.继续通入1mol PCl5气体 B.继续通入1mol PCl3气体 C.升高 D.加入催化剂
|
|
| 10. | 详细信息 |
|
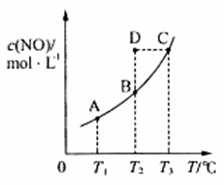
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g) N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是
A.该反应的ΔH>0 B.若该反应在T1、T2℃时的平衡常数分别为K1、K2,则K1<K2 C.在T2℃时,若反应体系处于状态D,则此时v正>v逆 D.若状态B、C、D的压强分别为p(B)、p(C)、p(D),则p(C)=p(D)>p(B)
|
|
| 11. | 详细信息 |
|
工业生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2++MnS===CuS+Mn2+,下列说法错误的是 A.该反应达平衡时c(Mn2+)=c(Cu2+) B.MnS的Ksp比CuS的Ksp大 C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 D.该反应的平衡常数K=
|
|
| 12. | 详细信息 |
|
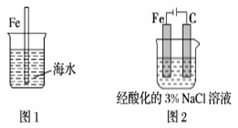
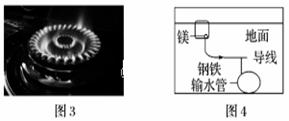
.下列与金属腐蚀有关的说法,正确的是
A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 B.图2中,插入溶液中的铁棒容易溶解,主要是发生电化学腐蚀 C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生电化学腐蚀 D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的负极
|
|
| 13. | 详细信息 |
|
现有物质的量浓度均为0.1 mol/L的溶液①NH3·H2O ②CH3COOH ③KHSO4。下列有关离子浓度分析一定不正确的是 A.向①中逐滴加入少量②, B.①、③等体积混合后溶液中存在:NH4+ +H2O C.①、②任意比混合:c(CH3COO−)+c(OH−)=c(H+)+c(NH4+ ) D.①、③按体积比2:1混合:c(NH4+)>c(NH3·H2O)>c(SO42−)>c(OH−)>c(H+)
|
|
| 14. | 详细信息 |
|
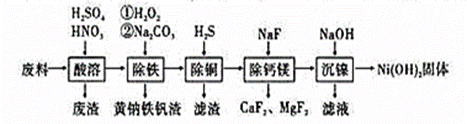
一种废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,由该废料制备的纯度较高的氢氧化镍,工艺流程如下,已知常温下Ksp[Ni(OH)2]=1.0×10−15,则下列说法错误的是
A.废渣中含有二氧化硅和硫酸钙 B.加热煮沸可以提高除铁效率 C.除铜过程中,溶液酸性增强 D.“沉镍”过程中为了将镍沉淀完全,需要调节pH>9
|
|
| 15. | 详细信息 | ||||||||
|
在常温时,下列说法正确的是
B.向0.1mol·L−1的H2C2O4溶液中滴加NaOH溶液恰好至中性,此时溶液中各离子浓度大小关系是:c(Na+)>c(HC2O4−)>c(C2O42−)>c(OH−)= c(H+) C.向0.1mol·L−1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO−)=5:9,此时溶液pH=5 D.0.1mol·L−1的醋酸钠溶液20mL与0.1mol·L−1盐酸10mL混合后溶液显酸性,则有c(CH3COO−)>c(Cl−)>c(H+)>c(CH3COOH)
|
|||||||||
| 16. | 详细信息 |
|
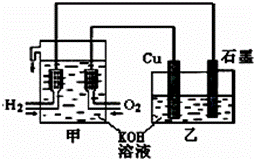
利用如图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是
A.乙中Cu电极的电极反应式是:2Cu+2OH−−2e−=Cu2O+H2O B.甲中通入氧气的电极为负极 C.乙中阴离子向石墨电极移动 D.电路上通过0.5mol电子,可制得0.5molCu2O
|
|
| 17. | 详细信息 |
|
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量 (1)写出该反应的热化学方程式_______________________________________。 (2)已知H2O(l)═H2O(g);△H=+44kJ·mol−1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。 (3)丙烷燃烧可以通过以下两种途径: 途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=−a kJ·mol−1 途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol−1 2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=−c kJ·mol−1 2H2(g)+O2 (g)═2H2O(l)△H=−d kJ·mol−1 (abcd均为正值) ①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______(填“大于 ②在C3H8(g)═C3H6(g)+H2(g) 的反应中,反应物具有的总能量________(填“大于”、“等于”或“小于”)生成物具有的总能量。 ③b 与a、c、d的数学关系式是_____________。
|
|
| 18. | 详细信息 | ||||||||||
|
Na2S可用于制造硫化染料、沉淀水体中的重金属等。 (1)Na2S溶液中S2−水解的离子方程式为_________。 (2)室温时,几种重金属离子的硫化物的溶度积常数如下表:
①向物质的量浓度相同的Fe2+、Pb2+、Cu2+、Hg2+的混合稀溶液中,逐滴加入Na2S稀溶液,首先沉淀的离子是____。 ②用Na2S溶液沉淀废水中Pb2+,为使Pb2+沉淀完全[c(Pb2+)≤1×10−6mol/L],则应满足溶液中c(S2−)≥_____mol/L。 ③反应Cu2+(aq)+FeS(s) (3)测定某Na2S和NaHS混合样品中两者含量的实验步骤如下: 步骤1.准确称取一定量样品于烧杯中,加入少量蒸馏水溶解,转移至500mL容量瓶中定容。 步骤2.准确移取25.00mL上述溶液于锥形瓶中,加入茜
|
|||||||||||
| 19. | 详细信息 | |||||||||||||||||||||||||||||||||||||||||||||
|
某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
(1)写出反应的离子方程式_____________________。 (2)根据你所掌握的知识判断,在上述实验中,反应速率最快的可能是______(填实验序号)。 (3)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中: ①能说明温度对该反应速率影响的组合是__________(填实验序号); ②A和B、A和C的组合比较,所研究的问题是________________________________; ③B和C组合比较,所研究的问题是________________________________________。 (4)教材中利用了出现黄色沉淀的快慢来比较
|
||||||||||||||||||||||||||||||||||||||||||||||
| 20. | 详细信息 |
|
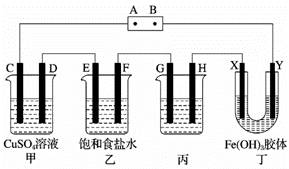
某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
(1)电源A极的名称是________。 (2)甲装置中电解反应的总化学方程式为(电解质溶液是足量的):_ (3)如果收集乙装置中产生的气体,两种气体的体积比是(忽略气体的溶解)________。ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂。制备ClO2的新工艺是电解法。若调控合适的电压可以利用乙装置制备ClO2,写出阳极产生ClO2的电极反应式__________ClO2对污水中Fe2+、Mn2+、S2−、CN−等有明显去除效果,某工厂污水中含CN−,现用ClO2把CN−氧化成两种无毒气体,写出该反应的离子方程式:_____________。 (4)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”),电镀液的主要成分是________(填化学式)。 (5)装置丁中的现象是_______。
|
|
| 21. | 详细信息 | ||||||||||||||||
|
Ⅰ.含有弱酸 HA 和其钠盐 NaA 的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。 (1)向该溶液中加入少量盐酸时,发生反应的离子方程式是_____;向其中加入少量KOH溶液时,发生反应的离子方程式是_________。 (2)现将0.04mol·L−1HA 溶液和0.02mol·L−1NaOH 溶液等体积混合,得到缓冲溶液。 ①若 HA为HCN,该溶液显碱性,则溶液中 c(Na+)____c(CN−)(填“<”“=”或“>”)。 ②若 HA为CH3COOH,该溶液显酸性,溶液中所有的离子按浓度由大到小排列的顺序是____。 II.(3)常温下,将NH3·H2O与盐酸等体积混合,实验数据如下:
针对甲、乙、丙三组实验,回答下列问题: ①甲组反应后,溶液中离子浓度的大小顺序为__________________; ②乙组b_____7(填“>”、“<”或“=”); ③丙组溶液混合后c=7,A___0.1mol·L−1(填“>”、“<”或“=”); ④甲中a=6,混合溶液中c(Cl−)−c(NH4+)= ____________mol·L−1 (列式表示结果,不能做近似计算)。
|
|||||||||||||||||