乌鲁木齐市2019年高三上册化学月考测验在线做题
| 1. 选择题 | 详细信息 |
|
下列 关于煤、石油、天然气等资源的说法正确的是 A. 煤的气化和液化过程属于物理变化 B. 塑料、合成橡胶、合成纤维都主要是以石油、煤、天然气为原料生产的 C. 石油分馏的目的是生产乙烯、丙烯、甲烷等化工原料 D. 天然气和液化石油气的主要成分是甲烷 |
|
| 2. 选择题 | 详细信息 |
|
NA代表阿伏加德罗常数的值。下列说法正确的是 A. 常温常压下,124 g P4中所含P—P键数目为4NA B. 将含0.1mol FeCl3的饱和溶液滴入沸水中,形成的胶体粒子的数目为0.1NA C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA D. 含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA |
|
| 3. 选择题 | 详细信息 |
|
下列说法中错误的是 A. 原子及其离子的核外电子层数等于该元素所在的周期数 B. 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 C. 除氦外的稀有气体原子的最外层电子数都是8 D. 第1周期元素、第ⅦA族元素和稀有气体元素都是非金属元素 |
|
| 4. 选择题 | 详细信息 | |||||||||||||||
如表中评价合理的是
|
||||||||||||||||
| 5. 选择题 | 详细信息 |
|
下列各组物质的分类正确的是 ①混合物:花生油、铝热剂、水玻璃、水银、福尔马林、聚乙烯 ②电解质:明矾、冰醋酸、石膏、纯碱 ③酸性氧化物不一定是非金属氧化物. ④同位素:1H+、2H2、3H ⑤按照纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是CuSO4·5H2O、盐酸、苛性钾、次氯酸、氯气 ⑥根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸 ⑦在熔化状态下能导电的化合物为离子化合物 A. 3个 B. 4个 C. 5个 D. 6个 |
|
| 6. 选择题 | 详细信息 |
|
在反应11P+15CuSO4+2H2O===5Cu3P+6H3PO4+15H2SO4中,每3摩尔CuSO4能氧化P的物质的量为 A. 1/5 mol B. 2/5 mol C. 3/5 mol D. 11/5 mol |
|
| 7. 选择题 | 详细信息 |
|
下列有关电解质的叙述中错误的是 A. KClO3和SO3溶于水后能导电,故KClO3和SO3均为电解质 B. 弱电解质溶液可能比强电解质溶液的导电性强 C. HCl是强电解质,它只能在水溶液里才能电离 D. 电解质溶液导电过程中必然伴随化学变化 |
|
| 8. 选择题 | 详细信息 |
|
下列古代文献涉及的化学研究成果,对其说明不合理的是 A. “绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒,在酿酒过程中,萄萄糖发生了氧化还原反应 B. “试玉要烧三日满,辨材须待七年期”中“玉”的成分是硅盐酸,该句诗表明玉的硬度很大 C. “火树银花合,星桥铁索开” “火树银花”涉及到焰色反应 D. “日照香炉生紫烟,遥看瀑布挂前川”,其中生紫烟包含了物理变化 |
|
| 9. 选择题 | 详细信息 |
短周期主族元素a、b、c、d 的原子序数依次增大,这四种元素形成的单质依次为m、n、p、q;x、y、z是由这些元素组成的二元化合物,其中z 为形成酸雨的主要物质之一;25℃时,0.01mol·L-l w溶液中, A. 原子半径的大小:a<b<c<d B. 简单氢化物的沸点:b>d C. y 的电子式: D. y、w 含有的化学键类型完全相同 |
|
| 10. 选择题 | 详细信息 |
|
下列有关化学键的叙述,正确的是 A. 离子化合物中一定含有离子键 ,可能含共价键 B. 单质分子均不存在化学键 C. 含有共价键的分子一定是共价化合物 D. 含有共价键的化合物一定是共价化合物 |
|
| 11. 选择题 | 详细信息 | ||||||||||||||||||||
下表中实验操作、现象和所得出的结论正确的是( )
|
|||||||||||||||||||||
| 12. 选择题 | 详细信息 |
|
下列各组物质稀溶液相互反应.无论前者滴入后者,还是后者滴入前者,反应现象相同,且离子方程式也相同的是 A. Ba(HCO3)2溶液与Ba(OH)2溶液 B. NaAlO2溶液与稀硫酸溶液 C. Ca(HCO3)2溶液与NaOH溶液 D. 氨水与硝酸银溶液 |
|
| 13. 选择题 | 详细信息 |
|
已知HCO3-+AlO2-+H2O==CO32-+Al(OH)3↓。将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为 A.  B. B.  C. C. 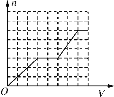 D. D.  |
|
| 14. 选择题 | 详细信息 |
|
下列说法正确的是 A. 土壤表面积巨大且一般带正电,能吸收NO3-等营养离子,使土壤具有保肥能力 B. 在Fe(OH)3胶体中滴加稀硫酸的现象为:先沉淀后溶解 C. 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)===Fe(OH)3↓+3H+ D. 在Fe(OH)3胶体中插入两电极通电,在阳极附近颜色加深 |
|
| 15. 选择题 | 详细信息 |
|
对相同状况下的12C18O和14N2两种气体,下列说法正确的是 A. 若质量相等,则质子数相等 B. 若原子数相等,则中子数相等 C. 若分子数相等,则体积相等 D. 若体积相等,则密度相等 |
|
| 16. 选择题 | 详细信息 |
|
配制100mL 1.0mol·L-1Na2CO3溶液,下列情况会导致溶液浓度偏高的是 A. 容量瓶使用前用1.0mol·L-1Na2CO3溶液润洗 B. 配置过程中,未用蒸馏水洗涤烧杯和玻璃棒 C. 仰视确定凹液面与刻度线相切 D. 定容时,滴加蒸馏水超过刻度线 |
|
| 17. 选择题 | 详细信息 |
|
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是 A. 60mL B. 45mL C. 30mL D. 15mL |
|
| 18. 选择题 | 详细信息 |
|
甲、乙、丙、丁、戊是中学化学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法不正确的是 ( )。 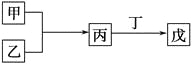 A. 若组成甲、乙的元素位于同一周期,则戊可能是一种弱酸 B. 若组成甲、乙的元素位于同一主族,则戊可能是一种弱酸 C. 若甲为短周期中原子半径最大的主族元素形成的单质,且戊为碱,则丙只能为Na2O2 D. 若丙、丁混合生成白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用 |
|
| 19. 选择题 | 详细信息 |
|
下列各组离子在指定溶液中一定能大量共存的是 ①c(H+)/c(OH-)=1012的溶液:K+、Fe3+、Cl-、SO42- ②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32- ③水电离的H+浓度c(H+)=10-12 mol·L-1的溶液中:Cl-、CO32-、NO3-、NH4+、SO32- ④加入铝片能放出H2的溶液:Na+、CH3COO-、Cu2+、SO42- ⑤使石蕊变红的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42- ⑥中性溶液中:Fe3+、Al3+、NO3-、I-、Cl-、S2- A. 1组 B. 2组 C. 3组 D. 4组 |
|
| 20. 选择题 | 详细信息 |
|
标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是 A. ρ= C. w= |
|
| 21. 选择题 | 详细信息 |
|
下列离子反应方程式正确的是 A. 向NH4HCO3溶液中加过量的NaOH溶液:NH4++OH-=NH3↑+H2O B. 将氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ C. 在碳酸氢镁溶液中加入足量Ca(OH)2溶液: Mg2++HCO3-+Ca2++2OH-===MgCO3↓+CaCO3↓+2H2O D. 向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+刚好沉淀完全Al3++SO42-+Ba2++3OH-===BaSO4↓+Al(OH)3↓ |
|
| 22. 选择题 | 详细信息 |
|
在常温下发生下列反应: (1)16H+ +10Z-+ 2XO-4 ===2X2++ 5Z2+ 8H2O (2) 2A2十+B2==2A3++ 2B- (3) 2B- +Z2==B2+2Z- 根据上述反应,判断下列结论中错误的是( ) A. 溶液中可能发生:Z2+2A2+==2A3++2Z- B. Z2在①、③反应中均为氧化剂 C. 氧化性强弱顺序为:XO-4>Z2>B2>A3+ D. X2+是XO-4的还原产物 |
|
| 23. 选择题 | 详细信息 |
|
VmLAl2(SO4)3溶液中含Al3+ag,取0.2VmL溶液稀释到5Vml,则稀释后溶液中SO42-的物质的量浓度是 A. 125a/(9V)mol·L-1 B. 125a/(18V)mol·L-1 C. 20a/(9V)mol·L-1 D. 20a/(18V)mol·L-1 |
|
| 24. 选择题 | 详细信息 |
|
已知氯气与NaOH溶液反应可生成NaCl、NaClO、NaClO3,NaClO在加热条件下分解生成NaCl和NaClO3,现向氢氧化钠溶液中通入一定量的氯气,加热少许时间后溶液中形成混合体系。下列判断不正确的是( ) A. 若反应过程中消耗1 mol氯气,则1 mol<转移电子数< B. 反应停止后n(NaClO)∶n(NaCl)∶n(NaClO3)(物质的量之比)可能为1∶11∶2 C. 反应过程中消耗氯气与NaOH的物质的量之比为1∶2 D. 氧化产物为NaClO和NaClO3,反应过程中n(NaClO)∶n(NaClO3)为1∶1 |
|
| 25. 综合题 | 详细信息 | ||||||||
下表为元素周期表的一部分。
|
|||||||||
| 26. 实验题 | 详细信息 |
|
二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定。温度过高,二氧化氯的水溶液有可能爆炸。其制备方法有: (1)方法一:用氯酸钠(NaClO3)和硫酸酸化的H2O2反应生成ClO2。请写出该反应的化学方程式___________________________________________。 (2)方法二:用氯酸钠氧化浓盐酸,生成二氧化氯的同时会有氯气产生。请写出该反应的化学方程式_____________________________________。  (3)方法三、 ①如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4), 然后再加入足量的稀硫酸,水浴加热。反应后产物中有 ClO2、CO2和一种酸式盐,该反应的化学方程式为:__________________________________, 氧化产物与还原产物的物质的量之比为____________。 ②控制水浴温度在60~80℃之间的目的是_______________________, 图示装置中缺少的一种必须的玻璃仪器是____________。 ③A装置用于吸收产生的二氧化氯,其中最好盛放________。(填序号)①60 ℃的温水 ②冰水 ③饱和食盐水 ④将足量二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量氯化钡溶液,有白色沉淀生成。请写出二氧化氯溶液和硫化氢溶液反应的离子方程式_______________________。 |
|
| 27. 综合题 | 详细信息 | ||||||||||||
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下: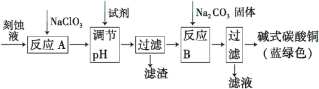 查阅资料知,通过调节溶液的酸碱性可使Cu2+,Fe2+,Fe3+生成沉淀的pH如下:
|
|||||||||||||
| 28. 实验题 | 详细信息 |
|
某研究性学习小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查): (1)装置A中反应的化学方程式是________. (2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是 ______。  (3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中,向第1支试管中滴加适量氨水出现白色沉淀___________(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是______。 (4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有___ 性. (5)装置D的作用是______。 (6)另一小组利用装置E进行实验:SO2性质实验之后,用注射器对实验室内空气进行取样.并向装置E中共注入V mL(已折算为标况下体积)的空气,当溶液刚好褪色时,停止实验.请计算该空气中SO2的体积分数(用含V的代数式表示)______。 |
|



