2019зҰҸе»әй«ҳдәҢдёӢеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰдёҺз”ҹдә§гҖҒз”ҹжҙ»гҖҒ科жҠҖгҖҒзҺҜеўғзӯүеҜҶеҲҮзӣёе…ігҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В ) A. вҖңеҚҺдёәйә’йәҹ980вҖқжүӢжңәдёӯиҠҜзүҮзҡ„дё»иҰҒжҲҗеҲҶжҳҜдәҢж°§еҢ–зЎ… B. й«ҳй“ҒвҖңеӨҚе…ҙеҸ·вҖқиҪҰеҺўиҝһжҺҘе…ій”®йғЁдҪҚдҪҝз”Ёзҡ„еўһејәиҒҡеӣӣж°ҹд№ҷзғҜжқҝеұһдәҺй«ҳеҲҶеӯҗжқҗж–ҷ C. еҢ»з”ЁеҸҢж°§ж°ҙе’Ңй…’зІҫеқҮеҸҜз”ЁдәҺдјӨеҸЈжё…жҙ—пјҢдёӨиҖ…ж¶ҲжҜ’еҺҹзҗҶзӣёеҗҢ D. вҖңзўід№қвҖқ(зҹіжІ№зӮјеҲ¶дёӯиҺ·еҸ–зҡ„д№қдёӘзўіеҺҹеӯҗзҡ„иҠізғғ)еқҮеұһдәҺиӢҜзҡ„еҗҢзі»зү©пјҢжі„жјҸдёҚдјҡжұЎжҹ“ж°ҙдҪ“
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В ) A. еҗ‘йёЎиӣӢжё…зҡ„жә¶ж¶ІдёӯеҠ е…Ҙжө“зҡ„зЎ«й…ёй’ жә¶ж¶ІжҲ–зҰҸ尔马жһ—пјҢиӣӢзҷҪиҙЁзҡ„жҖ§иҙЁеҸ‘з”ҹж”№еҸҳ并еҮқиҒҡ B. е°ҶзүӣжІ№е’Ңзғ§зўұжә¶ж¶Іж··еҗҲеҠ зғӯпјҢе……еҲҶеҸҚеә”еҗҺеҠ е…ҘйЈҹзӣҗж°ҙпјҢдёҠеұӮжһҗеҮәз”ҳжІ№ C. ж°Ёеҹәй…ёеҲҶеӯҗдёӯйғҪеҗ«жңүвҖ”COOHе’ҢвҖ”NH2 пјҢз§Қзұ»иҫғеӨҡпјҢдёәй«ҳеҲҶеӯҗеҢ–еҗҲзү© D. ж·ҖзІүгҖҒзәӨз»ҙзҙ гҖҒйәҰиҠҪзі–еңЁдёҖе®ҡжқЎд»¶дёӢеҸҜе’Ңж°ҙдҪңз”ЁиҪ¬еҢ–дёәи‘Ўиҗ„зі–
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗй“ҫзҠ¶зғ·зғғзҡ„дёҖдёӘеҲҶеӯҗйҮҢеҗ«жңү9дёӘзўіеҺҹеӯҗпјҢе…¶дёҖж°Ҝд»Јзү©еҸӘжңүдёӨз§ҚпјҢиҜҘзғ·зғғзҡ„еҗҚз§°жҳҜ(В В В В ) A. жӯЈеЈ¬зғ·В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В B. 2,6вҖ”дәҢз”Іеҹәеәҡзғ· C. 2,3,4вҖ”дёүз”Іеҹәе·ұзғ·В В В В В В В В В В В В В В В В В В В В В В В В В D. 2,2,4,4вҖ”еӣӣз”ІеҹәжҲҠзғ·
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
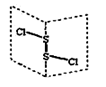
дәҢж°ҜеҢ–дәҢзЎ«(S2Cl2)жҳҜе№ҝжіӣз”ЁдәҺж©Ўиғ¶е·Ҙдёҡзҡ„зЎ«еҢ–еүӮпјҢе…¶еҲҶеӯҗз»“жһ„еҰӮдёӢеӣҫжүҖзӨәгҖӮеёёжё©дёӢS2Cl2жҳҜдёҖз§Қж©ҷй»„иүІзҡ„ж¶ІдҪ“пјҢйҒҮж°ҙжҳ“ж°ҙи§ЈпјҢ并дә§з”ҹиғҪдҪҝе“ҒзәўиӨӘиүІзҡ„ж°”дҪ“гҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ(В В В В )
A. 第дёҖз”өзҰ»иғҪгҖҒз”өиҙҹжҖ§еқҮжҳҜ Cl > S B. S2Cl2дёәеҗ«жңүжһҒжҖ§й”®е’ҢйқһжһҒжҖ§й”®зҡ„жһҒжҖ§еҲҶеӯҗ C. S2Br2дёҺS2Cl2з»“жһ„зӣёдјјпјҢз”ұдәҺSвҖ”Clй”®й”®иғҪжӣҙеӨ§пјҢS2Cl2зҶ”жІёзӮ№жӣҙй«ҳ D. S2Cl2дёҺH2OеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸеҸҜиғҪдёәпјҡ2S2Cl2+2H2O=SO2вҶ‘+3SвҶ“+4HCl
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—и„ұж°ҙиҝҮзЁӢдёӯдёҚеұһдәҺеҸ–д»ЈеҸҚеә”зҡ„жҳҜ в‘ й«ҳзә§и„ӮиӮӘй…ёдёҺз”ҳжІ№и„ұж°ҙеҪўжҲҗжІ№и„ӮВ В В В В В В В В В в‘Ўд№ҷйҶҮеңЁжө“H2SO4дҪңз”ЁдёӢи„ұж°ҙеҲ¶д№ҷзғҜв‘ўж°Ёеҹәй…ёеңЁй…¶зҡ„дҪңз”ЁдёӢи„ұж°ҙеҪўжҲҗдәҢиӮҪВ В В В В В В В в‘Ји‘Ўиҗ„зі–еңЁжө“H2SO4дҪңз”ЁдёӢи„ұж°ҙжҲҗз„ҰзӮӯ A. в‘ в‘ЎВ В В В В В В В В В В В В В В B. в‘Ўв‘ўВ В В В В В В В В В В В В В В C. в‘Ўв‘ЈВ В В В В В В В В В В В В В В D. в‘ в‘Ј
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
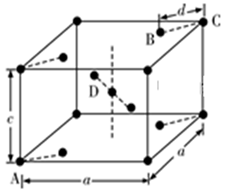
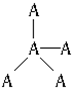
еҰӮдёӢеӣҫжҳҜжҹҗеҺҹеӯҗжҷ¶дҪ“Aз©әй—ҙз»“жһ„дёӯзҡ„дёҖдёӘеҚ•е…ғгҖӮAдёҺжҹҗзү©иҙЁBеҸҚеә”з”ҹжҲҗCпјҢе…¶е®һиҙЁжҳҜеңЁжҜҸдёӘAвҖ”Aй”®дёӯй—ҙжҸ’е…ҘдёҖдёӘBеҺҹеӯҗгҖӮеҲҷCзү©иҙЁзҡ„еҢ–еӯҰејҸдёәВ (гҖҖгҖҖ)
A. ABВ В В В В В В В В В В В В В В В В B. AB2В В В В В В В В В В В В В В В В В C. A5B4В В В В В В В В В В В В В В В В D. A2B5
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A. ж ҮеҮҶзҠ¶еҶөдёӢпјҢ11.2 LCH3Clеҗ«жһҒжҖ§й”®ж•°зӣ®дёә2NA B. з”Іеҹәзҡ„зўіеҺҹеӯҗжқӮеҢ–иҪЁйҒ“зұ»еһӢжҳҜsp2пјҢжҜҸж‘©е°”з”Іеҹәеҗ«9NAз”өеӯҗ C. зӯүиҙЁйҮҸзҡ„и‘Ўиҗ„зі–е’Ңд№ҷй…ёжүҖеҗ«зўіеҺҹеӯҗж•°еқҮдёәNA/30 D. жңүжңәзү©(
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ | ||||||||
|
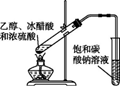
дёӢеҲ—е®һйӘҢиЈ…зҪ®еӣҫеҸҠе®һйӘҢз”Ёе“ҒеқҮжӯЈзЎ®зҡ„жҳҜпјҲйғЁеҲҶеӨ№жҢҒд»ӘеҷЁжңӘз”»еҮәпјүпјҲгҖҖгҖҖпјү
A. AВ В В В В В В В В В В В В В В В В В B. BВ В В В В В В В В В В В В В В В В В C. CВ В В В В В В В В В В В В В В В В В D. D
|
|||||||||
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В ) A. д№ҷзғҜе’ҢиҒҡд№ҷзғҜеқҮиғҪдҪҝжәҙж°ҙеҸҚеә”иӨӘиүІ B. д№ҷиӢҜзҡ„еҗҢеҲҶејӮжһ„дҪ“еӨҡдәҺдёүз§Қ C. з”Ізғ·гҖҒиӢҜе’ҢжІ№и„ӮеқҮдёҚиғҪдҪҝй…ёжҖ§KMnO4жә¶ж¶ІиӨӘиүІ D. и‘Ўиҗ„зі–дёҺжһңзі–гҖҒж·ҖзІүдёҺзәӨз»ҙзҙ еҲҶеӯҗејҸзӣёеҗҢпјҢеқҮдә’дёәеҗҢеҲҶејӮжһ„дҪ“
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүжңәзү©е…·жңүжүӢжҖ§(иҝһжҺҘзҡ„еӣӣдёӘеҺҹеӯҗжҲ–еҺҹеӯҗеӣўйғҪдёҚзӣёеҗҢзҡ„зўіеҺҹеӯҗеҸ«жүӢжҖ§зўіпјҢеҲҷиҜҘеҲҶеӯҗе…·жңүжүӢжҖ§)пјҢеҸ‘з”ҹдёӢеҲ—еҸҚеә”еҗҺпјҢеҲҶеӯҗдёҖе®ҡиҝҳжңүжүӢжҖ§зҡ„жҳҜ(гҖҖгҖҖ)
в‘ еҸ‘з”ҹеҠ жҲҗеҸҚеә”В В гҖҖв‘ЎеҸ‘з”ҹй…ҜеҢ–еҸҚеә”гҖҖВ В в‘ўеҸ‘з”ҹж°ҙи§ЈеҸҚеә”В В В гҖҖв‘ЈеҸ‘з”ҹеҠ иҒҡеҸҚеә” A. в‘Ўв‘ўВ В В В В В В В В В В В В В В B. в‘ в‘Ўв‘ЈВ В В В В В В В В В В В В C. в‘Ўв‘ўв‘ЈВ В В В В В В В В В В В В D. в‘ в‘Ўв‘ўв‘Ј
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүXгҖҒYгҖҒZгҖҒWгҖҒMдә”з§Қзҹӯе‘Ёжңҹе…ғзҙ пјҢеҺҹеӯҗеҚҠеҫ„дҫқж¬ЎеҮҸе°ҸпјҢе…¶дёӯеҸӘжңүдёҖз§ҚйҮ‘еұһе…ғзҙ пјӣX+дёҺM2вҖ”е…·жңүзӣёеҗҢзҡ„з”өеӯҗеұӮз»“жһ„пјӣзҰ»еӯҗеҚҠеҫ„пјҡZ2вҖ”>WвҖ”пјӣYзҡ„еҚ•иҙЁжҷ¶дҪ“зҶ”зӮ№й«ҳгҖҒзЎ¬еәҰеӨ§гҖӮдёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A. XгҖҒMдёӨз§Қе…ғзҙ еҸӘиғҪеҪўжҲҗX2MеһӢеҢ–еҗҲзү© B. X зҡ„ж°ўеҢ–зү©зҶ”зӮ№жҜ”W зҡ„ж°ўеҢ–зү©дҪҺ C. е…ғзҙ Wе’ҢMзҡ„жҹҗдәӣеҚ•иҙЁеҸҜдҪңдёәж°ҙеӨ„зҗҶдёӯзҡ„ж¶ҲжҜ’еүӮ D. ZM2гҖҒYM2жҷ¶дҪ“зұ»еһӢзӣёеҗҢпјҢжҷ¶дҪ“дёӯеҗ«жңүеҢ–еӯҰй”®зұ»еһӢд№ҹзӣёеҗҢ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
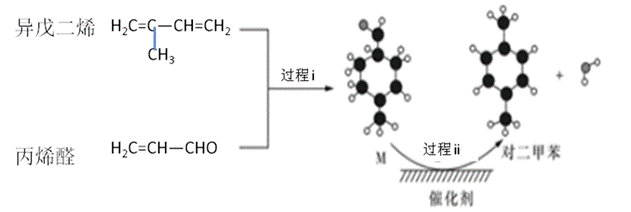
жҲ‘еӣҪиҮӘдё»з ”еҸ‘еҜ№дәҢз”ІиӢҜзҡ„з»ҝиүІеҗҲжҲҗи·ҜзәҝеҸ–еҫ—ж–°иҝӣеұ•пјҢе…¶еҗҲжҲҗзӨәж„ҸеӣҫеҰӮдёӢпјҡ
дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ A. иҝҮзЁӢ i еҸ‘з”ҹдәҶеҠ жҲҗеҸҚеә” B. еҲ©з”ЁзӣёеҗҢеҺҹзҗҶд»ҘеҸҠзӣёеҗҢеҺҹж–ҷпјҢд№ҹиғҪеҗҲжҲҗй—ҙдәҢз”ІиӢҜ C. дёӯй—ҙдә§зү©Mзҡ„з»“жһ„з®ҖејҸдёә D. иҜҘеҗҲжҲҗи·ҜзәҝзҗҶи®әдёҠзўіеҺҹеӯҗ100пј…еҲ©з”ЁпјҢдё”жңҖз»Ҳеҫ—еҲ°зҡ„дә§зү©еҸҜз”Ёи’ёйҰҸж–№жі•еҲҶзҰ»еҫ—еҲ°еҜ№дәҢз”ІиӢҜзІ—дә§е“Ғ
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
XгҖҒYдёәеҗҢе‘ЁжңҹжҲ–еҗҢдё»ж—Ҹзҹӯе‘Ёжңҹе…ғзҙ пјҢиӢҘXзҡ„еҺҹеӯҗеҚҠеҫ„еӨ§дәҺYзҡ„еҺҹеӯҗеҚҠеҫ„пјҢеҲҷдёӢеҲ—еҲӨж–ӯжӯЈзЎ®зҡ„жҳҜ(В В В ) A. 第дёҖз”өзҰ»иғҪдёҖе®ҡX< Y B. Xзҡ„зҰ»еӯҗеҚҠеҫ„дёҖе®ҡеӨ§дәҺYзҡ„зҰ»еӯҗеҚҠеҫ„ C. иӢҘXгҖҒYеқҮдёәйқһйҮ‘еұһе…ғзҙ пјҢеҲҷXгҖҒYе…ғзҙ зҡ„з®ҖеҚ•ж°”жҖҒж°ўеҢ–зү©зҶ”жІёзӮ№дёҖе®ҡHnY < HmX D. иӢҘXгҖҒYеқҮдёәйҮ‘еұһе…ғзҙ пјҢеҲҷXеӨұз”өеӯҗзҡ„иғҪеҠӣдёҖе®ҡејәдәҺY
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
T-carbon(еҸҲеҗҚT-зўі)пјҢжҳҜдёӯеӣҪ科еӯҰйҷўеӨ§еӯҰиӢҸеҲҡж•ҷжҺҲз ”з©¶еӣўйҳҹдәҺ2011е№ҙйҖҡиҝҮзҗҶи®әи®Ўз®—йў„иЁҖзҡ„дёҖз§Қж–°еһӢдёүз»ҙзўіз»“жһ„пјҢз»ҸиҝҮдёҚжҮҲзҡ„еҠӘеҠӣжҺўзҙўпјҢ2017е№ҙз»ҲдәҺиў«иҘҝе®үдәӨеӨ§е’Ңж–°еҠ еқЎеҚ—жҙӢзҗҶе·ҘеӨ§еӯҰиҒ”еҗҲз ”з©¶еӣўйҳҹеңЁе®һйӘҢдёҠжҲҗеҠҹеҗҲжҲҗпјҢиҜҒе®һдәҶзҗҶи®әйў„иЁҖгҖӮT-зўізҡ„з»“жһ„жҳҜе°Ҷз«Ӣж–№йҮ‘еҲҡзҹідёӯзҡ„жҜҸдёӘзўіеҺҹеӯҗз”ЁдёҖдёӘз”ұ4дёӘзўіеҺҹеӯҗз»„жҲҗзҡ„жӯЈеӣӣйқўдҪ“з»“жһ„еҚ•е…ғеҸ–д»ЈеҪўжҲҗзўізҡ„дёҖз§Қж–°еһӢдёүз»ҙз«Ӣж–№жҷ¶дҪ“жҷ¶иғһз»“жһ„пјҢеҰӮеӣҫгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ(гҖҖ)
A. жҜҸдёӘT-зўіжҷ¶иғһдёӯеҗ«32дёӘзўіеҺҹеӯҗ B. T-зўіеҜҶеәҰжҜ”йҮ‘еҲҡзҹіе°Ҹ C. T-зўідёӯзўідёҺзўізҡ„жңҖе°ҸеӨ№и§’дёә109.5В° D. з”ұдәҺT-зўіжҳҜдёҖз§Қ蓬жқҫзҡ„зўіжқҗж–ҷпјҢе…¶еҶ…йғЁжңүеҫҲеӨ§з©әй—ҙеҸҜдҫӣеҲ©з”ЁпјҢеҸҜиғҪеҸҜд»Ҙз”ЁдҪңеӮЁж°ўжқҗж–ҷ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
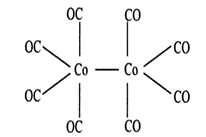
й…ҚеҗҲзү©Co2(CO)8зҡ„з»“жһ„еҰӮдёӢеӣҫ(е·ІзҹҘCoжҳҜ0д»·)пјҢиҜҘй…ҚеҗҲзү©дёӯеӯҳеңЁзҡ„дҪңз”ЁеҠӣзұ»еһӢе…ұжңү(В В )
в‘ йҮ‘еұһй”®В В В в‘ЎзҰ»еӯҗй”®В В в‘ўе…ұд»·й”®В В в‘Јй…ҚдҪҚй”®В В в‘Өж°ўй”®В В в‘ҘиҢғеҫ·еҚҺеҠӣ A. в‘Ўв‘ўв‘ЈВ В В В В В В В В В В В В B. в‘Ўв‘ўв‘Јв‘ҘВ В В В В В В В В В В C. в‘ в‘ўв‘Јв‘ҘВ В В В В В В В В В В D. в‘Ўв‘ўв‘Јв‘Өв‘Ҙ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
зғӯж’ӯз”өи§Ҷеү§гҖҠз ҙеҶ°иЎҢеҠЁгҖӢдёӯжӣҫз»ҸеӨҡж¬ЎжҸҗеҲ°дёҖз§ҚеҸ«дёңиҺЁиҸӘзўұ(Scopolamine)зҡ„еҢ–еӯҰзү©иҙЁгҖӮдёңиҺЁиҸӘзўұжҳҜ1892е№ҙз”ұE.ж–ҪеҜҶзү№йҰ–е…Ҳд»ҺдёңиҺЁиҸӘдёӯеҲҶзҰ»еҮәжқҘпјҢеҸҜз”ЁдәҺйә»йҶүгҖҒй•Үз—ӣгҖҒжӯўе’ігҖҒе№іе–ҳпјҢеҜ№еҠЁжҷ•з—Үжңүж•ҲгҖӮдҪҶе…¶жҜ’жҖ§иҫғејәпјҢзЁҚдёҖиҝҮйҮҸжңҚз”ЁеҚіеҸҜиҮҙе‘ҪпјҢе…·жңүжһҒй«ҳзҡ„иҮҙе№»дҪңз”ЁпјҢз§°дёәвҖңйӯ”й¬је‘јеҗёвҖқгҖӮе…¶з»“жһ„еҰӮдёӢеӣҫпјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ(В В В )
A. еҲҶеӯҗй—ҙеҸҜд»ҘеҪўжҲҗеҲҶеӯҗй—ҙж°ўй”® B. дёңиҺЁиҸӘзўұзҡ„еҢ–еӯҰејҸдёәC17H21NO4 C. иҜҘзү©иҙЁиғҪеҸ‘з”ҹеҠ жҲҗгҖҒеҸ–д»Је’Ңж°§еҢ–еҸҚеә” D. еҸҜдҪҝз”ЁиҙЁи°ұд»ӘжөӢеҮәиҝҷдёӘеҲҶеӯҗзҡ„зӣёеҜ№еҲҶеӯҗиҙЁйҮҸпјҢд№ҹеҸҜз”Ёж ёзЈҒе…ұжҢҜж°ўи°ұзЎ®е®ҡиҝҷдёӘеҲҶеӯҗзҡ„зҺҜзҠ¶з»“жһ„
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
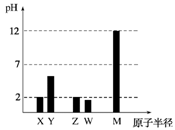
е·ІзҹҘXгҖҒYгҖҒZгҖҒWгҖҒMеқҮдёәзҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ гҖӮ25в„ғж—¶пјҢеҗ„е…ғзҙ жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©жә¶ж¶І(жө“еәҰеқҮдёә0.01mol/L)зҡ„pHе’ҢеҺҹеӯҗеҚҠеҫ„зҡ„е…ізі»еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ(В )
A. д»Һеӣҫдёӯеҫ—еҮәеҗҢжө“еәҰдёӢWзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©зҡ„pHжҜ”Zе°ҸпјҢж•…йқһйҮ‘еұһжҖ§:W>Z B. XгҖҒZзҡ„жңҖз®ҖеҚ•ж°”жҖҒж°ўеҢ–зү©еңЁеёёжё©дёӢеҸҜд»ҘеҸҚеә”з”ҹжҲҗзҰ»еӯҗеҢ–еҗҲзү© C. XгҖҒYгҖҒZгҖҒWгҖҒMдә”з§Қе…ғзҙ еҚ•иҙЁдёӯYеёёи§ҒеҚ•иҙЁзҶ”зӮ№жңҖй«ҳ D. з®ҖеҚ•зҰ»еӯҗеҚҠеҫ„еӨ§е°ҸйЎәеәҸ:X>M
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
дёәжҸҗзәҜдёӢеҲ—зү©иҙЁ(жӢ¬еҸ·еҶ…зҡ„зү©иҙЁдёәжқӮиҙЁ)пјҢжүҖйҖүз”Ёзҡ„йҷӨжқӮиҜ•еүӮе’ҢеҲҶзҰ»ж–№жі•дёҚжӯЈзЎ®зҡ„жҳҜ(В В )
A. AВ В В В В В В В В В В В В В В В В В B. BВ В В В В В В В В В В В В В В В В В C. CВ В В В В В В В В В В В В В В В В В D. D
|
|||||||||||||||||||||
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢиЈ…зҪ®иғҪиҫҫеҲ°е…¶е®һйӘҢзӣ®зҡ„зҡ„жҳҜ(В В ) A. B. C. D.
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
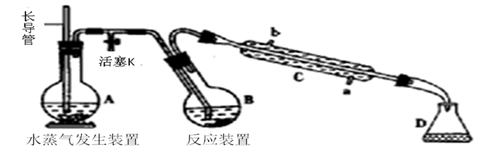
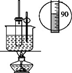
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В ) A. иҝҮж°§еҢ–铬(CrO5)зҡ„з»“жһ„дёәпјҡ B. 第дёүе‘ЁжңҹйғЁеҲҶе…ғзҙ з”өзҰ»иғҪеҰӮеӣҫжүҖзӨә,е…¶дёӯaгҖҒbгҖҒcеҲҶеҲ«д»ЈиЎЁзҡ„еҗ«д№үжҳҜI2гҖҒI3гҖҒI1
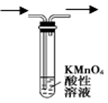
C. еҸҜд»Ҙз”ЁеҰӮеӣҫе®һйӘҢиЈ…зҪ®еӣҫйҷӨеҺ»з”Ізғ·дёӯж··жңүзҡ„д№ҷзғҜ D. 银й•ңеҸҚеә”еҗҺиҜ•з®ЎеЈҒдёҠзҡ„银й•ңе’Ңй»Ҹйҷ„еңЁиҜ•з®ЎеЈҒдёҠзҡ„жІ№и„ӮеҸҜеҲҶеҲ«з”ЁзЁҖж°Ёж°ҙгҖҒзғӯзўұж¶Іжҙ—ж¶Ө
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
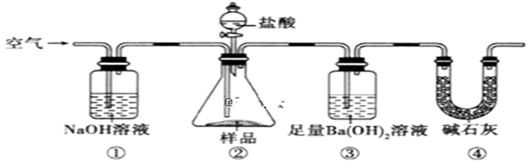
е®һйӘҢе®ӨжҢүеҰӮдёӢиЈ…зҪ®жөӢе®ҡзәҜзўұ(еҗ«е°‘йҮҸNaCl)зҡ„зәҜеәҰгҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ(В В )
A. ж»ҙе…Ҙзӣҗй…ёеүҚпјҢеә”е°ҶиЈ…зҪ®дёӯеҗ«жңүCO2зҡ„з©әж°”жҺ’е°Ҫ B. иЈ…зҪ®в‘ гҖҒв‘Јзҡ„дҪңз”ЁжҳҜйҳІжӯўз©әж°”дёӯзҡ„CO2иҝӣе…ҘиЈ…зҪ®в‘ў C. еҝ…йЎ»еңЁиЈ…зҪ®в‘ЎгҖҒв‘ўй—ҙж·»еҠ зӣӣжңүйҘұе’ҢNaHCO3жә¶ж¶Ізҡ„жҙ—气瓶 D. еҸҚеә”з»“жқҹж—¶пјҢеә”еҶҚйҖҡе…Ҙз©әж°”е°ҶиЈ…зҪ®в‘ЎдёӯCO2иҪ¬з§»еҲ°иЈ…зҪ®в‘ўдёӯ
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
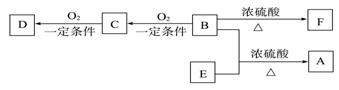
жңүжңәзү©Xзҡ„и’ёж°”зӣёеҜ№ж°ўж°”зҡ„еҜҶеәҰдёә51пјҢXдёӯж°§е…ғзҙ зҡ„иҙЁйҮҸеҲҶж•°дёә31.5%пјҢеҲҷиғҪдёҺNaOHжә¶ж¶ІеҸ‘з”ҹеҸҚеә”зҡ„Xзҡ„еҗҢеҲҶејӮжһ„дҪ“жңү(дёҚиҖғиҷ‘з«ӢдҪ“ејӮжһ„)(гҖҖгҖҖВ В ) A. 15з§ҚВ В В В В В В В В В В В В В В B. 14з§ҚВ В В В В В В В В В В В В В В C. 13з§ҚВ В В В В В В В В В В В В В В D. 12з§Қ
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүжңәзү©A(C6H12O2)е…·жңүжһңйҰҷе‘іпјҢеҸҜз”ЁдҪңйЈҹе“ҒеҠ йҰҷеүӮпјҢиҝҳеҸҜз”ЁдҪңеӨ©з„¶е’ҢеҗҲжҲҗж ‘и„Ӯзҡ„жә¶еүӮгҖӮ
е·ІзҹҘпјҡв‘ DгҖҒEе…·жңүзӣёеҗҢе®ҳиғҪеӣўпјҢEзҡ„зӣёеҜ№еҲҶеӯҗиҙЁйҮҸжҜ”DеӨ§пјӣ в‘Ў EеҲҶеӯҗеҗ«жңүж”Ҝй“ҫпјӣ в‘ў FжҳҜеҸҜд»ҘдҪҝжәҙ (1) Bзҡ„еҢ–еӯҰеҗҚз§°дёә____________пјӣDзҡ„з»“жһ„з®ҖејҸ_____________гҖӮ (2) CгҖҒFеҲҶеӯҗдёӯжүҖеҗ«зҡ„е®ҳиғҪеӣўзҡ„еҗҚз§°еҲҶеҲ«жҳҜ___________гҖҒ______________гҖӮ (3) еҶҷеҮәжңүжңәзү©Bз”ҹжҲҗCзҡ„еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸпјҡ___________________пјӣеҸҚеә”зұ»еһӢжҳҜ________гҖӮ (4) еҶҷеҮәжңүжңәзү©BдёҺEеҸҚеә”з”ҹжҲҗAзҡ„еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸпјҡ_______________________пјӣеҸҚеә”зұ»еһӢжҳҜ________гҖӮ (5) Eзҡ„еҗҢеҲҶејӮжһ„дҪ“дёӯиғҪеҗҢж—¶ж»Ўи¶ідёӢеҲ—жқЎд»¶зҡ„е…ұжңү________з§Қ(дёҚеҗ«з«ӢдҪ“ејӮжһ„) пјҢ并еҶҷеҮәд»»ж„ҸдёҖз§Қз¬ҰеҗҲжқЎд»¶зҡ„еҗҢеҲҶејӮжһ„дҪ“з»“жһ„з®ҖејҸ__________________гҖӮ в‘ иғҪдёҺNaеҸҚеә”пјӣВ В В в‘ЎиғҪеҸ‘з”ҹ银й•ңеҸҚеә”гҖӮ
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
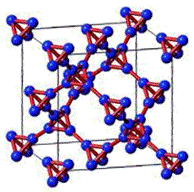
第еӣӣе‘Ёжңҹзҡ„еӨҡж•°е…ғзҙ еҸҠе…¶еҢ–еҗҲзү©еңЁеҢ–е·ҘгҖҒеҢ»иҚҜгҖҒжқҗж–ҷзӯүйўҶеҹҹжңүзқҖе№ҝжіӣзҡ„еә”з”ЁгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1) еҹәжҖҒTiеҺҹеӯҗдёӯпјҢжңҖй«ҳиғҪеұӮз”өеӯҗзҡ„з”өеӯҗдә‘иҪ®е»“еҪўзҠ¶дёә___пјҢдёҺTiеҗҢе‘Ёжңҹзҡ„жүҖжңүиҝҮжёЎе…ғзҙ зҡ„еҹәжҖҒеҺҹеӯҗдёӯпјҢеҶҷеҮәд»»ж„ҸдёҖз§ҚжңҖеӨ–еұӮз”өеӯҗж•°дёҺй’ӣдёҚеҗҢзҡ„е…ғзҙ еӨ–еӣҙз”өеӯҗжҺ’еёғејҸ_____гҖӮВ (2) зҗҘзҸҖй…ёдәҡй“ҒзүҮжҳҜз”ЁдәҺзјәй“ҒжҖ§иҙ«иЎҖзҡ„йў„йҳІе’ҢжІ»з–—зҡ„еёёи§ҒиҚҜзү©пјҢдёҙеәҠе»әи®®жңҚз”Ёз»ҙз”ҹзҙ CдҝғиҝӣвҖңдәҡй“ҒвҖқзҡ„еҗёж”¶пјҢйҒҝе…Қз”ҹжҲҗFe3+пјҢд»Һз»“жһ„и§’еәҰжқҘзңӢпјҢFe2+жҳ“иў«ж°§еҢ–жҲҗFe3+зҡ„еҺҹеӣ жҳҜ_________________гҖӮ (3) SCNвҖ” еҸҜз”ЁдәҺFe3+зҡ„жЈҖйӘҢпјҢеҶҷеҮәдёҺSCNвҖ” дә’дёәзӯүз”өеӯҗдҪ“зҡ„дёҖз§Қеҫ®зІ’пјҡ_____гҖӮВ (4) жҲҗиҜӯвҖңдҝЎеҸЈйӣҢй»„вҖқдёӯзҡ„йӣҢй»„еҲҶеӯҗејҸдёәAs2S3пјҢеҲҶеӯҗз»“жһ„еҰӮеӣҫпјҢAsеҺҹеӯҗзҡ„жқӮеҢ–ж–№ејҸдёә______пјҢйӣҢй»„е’ҢSnCl2еңЁзӣҗй…ёдёӯеҸҚеә”иҪ¬еҢ–дёәйӣ„й»„(As4S4)е’ҢSnCl4并ж”ҫеҮәH2Sж°”дҪ“пјҢеҶҷеҮәиҜҘеҸҚеә”ж–№зЁӢејҸпјҡ__________________гҖӮSnCl4еҲҶеӯҗзҡ„з«ӢдҪ“жһ„еһӢдёә_______гҖӮ
(5)йҮ‘зәўзҹі(TiO2)жҳҜеҗ«й’ӣзҡ„дё»иҰҒзҹҝзү©д№ӢдёҖпјҢе…·жңүе…ёеһӢзҡ„еӣӣж–№жҷ¶зі»з»“жһ„пјҢе…¶жҷ¶иғһз»“жһ„(жҷ¶иғһдёӯзӣёеҗҢдҪҚзҪ®зҡ„еҺҹеӯҗзӣёеҗҢ)еҰӮеӣҫжүҖзӨә(жіЁж„ҸпјҡDдёҚеңЁдҪ“еҝғ)пјҡ
в‘ 4дёӘеҫ®зІ’AгҖҒBгҖҒCгҖҒDдёӯпјҢеұһдәҺж°§еҺҹеӯҗзҡ„жҳҜ________________гҖӮ в‘ЎиӢҘAгҖҒBгҖҒCеҺҹеӯҗзҡ„еқҗж ҮеҲҶеҲ«дёәA(0пјҢ0пјҢ0)гҖҒB(0.69aпјҢ0.69aпјҢc)гҖҒC(aпјҢaпјҢc)пјҢеҲҷDеҺҹеӯҗзҡ„еқҗж ҮдёәD(0.19aпјҢ____пјҢ ____)пјӣиӢҘжҷ¶иғһеә•йқўиҫ№й•ҝдёәxпјҢеҲҷй’ӣж°§й”®зҡ„й”®й•ҝd=_______(з”Ёд»Јж•°ејҸиЎЁзӨә)гҖӮ
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
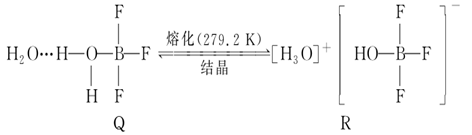
зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ еҸҠе…¶еҢ–еҗҲзү©еңЁз”ҹдә§з”ҹжҙ»дёӯиҮіе…ійҮҚиҰҒгҖӮ (1)BF3дёҺдёҖе®ҡйҮҸж°ҙеҪўжҲҗ(H2O)2В·BF3жҷ¶дҪ“QпјҢQеңЁдёҖе®ҡжқЎд»¶дёӢеҸҜиҪ¬еҢ–дёәRпјҡ
жҷ¶дҪ“Qдёӯеҗ«жңүзҡ„еҢ–еӯҰй”®еҢ…жӢ¬____________________гҖӮ (2) NF3дёҺNH3зҡ„з©әй—ҙжһ„еһӢзӣёеҗҢпјҢдҪҶNF3дёҚжҳ“дёҺCu2пјӢзӯүеҪўжҲҗй…ҚдҪҚй”®пјҢе…¶еҺҹеӣ жҳҜ___________гҖӮ (3)PCl5жҳҜдёҖз§ҚзҷҪиүІжҷ¶дҪ“пјҢеңЁжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯеҠ зғӯеҸҜеңЁ148 в„ғж¶ІеҢ–пјҢеҪўжҲҗдёҖз§ҚиғҪеҜјз”өзҡ„зҶ”дҪ“пјҢжөӢеҫ—е…¶дёӯеҗ«жңүйҳҙйҳізҰ»еӯҗеҗ„дёҖз§ҚпјҢз»“жһ„жҳҜжӯЈеӣӣйқўдҪ“еһӢзҰ»еӯҗе’ҢжӯЈе…«йқўдҪ“еһӢзҰ»еӯҗпјӣжӯЈе…«йқўдҪ“еһӢзҰ»еӯҗзҡ„еҢ–еӯҰејҸдёә_________________________пјӣжӯЈеӣӣйқўдҪ“еһӢзҰ»еӯҗдёӯй”®и§’еӨ§дәҺPCl3зҡ„й”®и§’еҺҹеӣ дёә______________________________________________________гҖӮ (4)ж°ҜеҢ–й’ зҡ„жҷ¶иғһз»“жһ„еҰӮеӣҫжүҖзӨәпјҢеӣҫжҳҜж°ҜеҢ–й’ зҡ„жҷ¶иғһжҲӘйқўеӣҫ(еӣҫдёӯзҗғеӨ§е°Ҹд»ЈиЎЁеҚҠеҫ„еӨ§е°Ҹ)гҖӮе·ІзҹҘNAд»ЈиЎЁйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢж°ҜеҢ–й’ жҷ¶дҪ“зҡ„еҜҶеәҰдёәd gВ·cm-3гҖӮеҲҷNa+еҚҠеҫ„дёә____________pm(еҸӘйңҖеҲ—еҮәи®Ўз®—ејҸ)гҖӮ
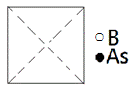
(5)з ·еҢ–зЎјдёәз«Ӣж–№жҷ¶зі»жҷ¶дҪ“пјҢиҜҘжҷ¶иғһдёӯеҺҹеӯҗзҡ„еҲҶж•°еқҗж Үдёә: B: (0пјҢ0пјҢ0)пјӣ ( Asпјҡ( в‘ иҜ·еңЁеӣҫдёӯз”»еҮәз ·еҢ–зЎјжҷ¶иғһзҡ„дҝҜи§Ҷеӣҫ______гҖӮ
в‘Ўз ·еҺҹеӯҗзҙ§йӮ»зҡ„зЎјеҺҹеӯҗжңү________дёӘпјҢдёҺжҜҸдёӘзЎјеҺҹеӯҗзҙ§йӮ»зҡ„зЎјеҺҹеӯҗжңү______дёӘгҖӮ
|
|
| 26. | иҜҰз»ҶдҝЎжҒҜ |
|
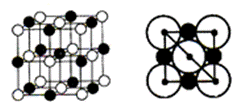
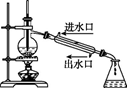
дёәжөӢе®ҡжҹҗж ·е“Ғдёӯж°ҹе…ғзҙ зҡ„иҙЁйҮҸеҲҶж•°иҝӣиЎҢеҰӮдёӢе®һйӘҢпјҢеҲ©з”Ёй«ҳж°Ҝй…ё(й«ҳжІёзӮ№й…ё)е°Ҷж ·е“Ғдёӯзҡ„ж°ҹе…ғзҙ иҪ¬еҢ–дёәж°ҹеҢ–ж°ў(ж°ўж°ҹй…ёдёәдҪҺжІёзӮ№й…ёпјҢеҗ«йҮҸдҪҺпјҢдёҚиҖғиҷ‘еҜ№зҺ»з’ғд»ӘеҷЁзҡ„и…җиҡҖ)пјҢз”Ёж°ҙи’ёж°”и’ёеҮәпјҢеҶҚйҖҡиҝҮж»ҙе®ҡжөӢйҮҸгҖӮе®һйӘҢиЈ…зҪ®еҰӮдёӢеӣҫжүҖзӨәпјҢеҠ зғӯиЈ…зҪ®зңҒз•ҘгҖӮ
(1) д»ӘеҷЁCеҗҚз§°жҳҜ___________пјҢй•ҝеҜјз®ЎдҪңз”ЁжҳҜ_____________________________гҖӮ (2)е®һйӘҢж—¶пјҢйҰ–е…Ҳжү“ејҖжҙ»еЎһKпјҢеҫ…ж°ҙжІёи…ҫж—¶пјҢе…ій—ӯжҙ»еЎһKпјҢејҖе§Ӣи’ёйҰҸгҖӮиӢҘи’ёйҰҸж—¶еӣ еҸҚеә”иЈ…зҪ®еұҖйғЁе өеЎһйҖ жҲҗй•ҝеҜјз®Ўж°ҙдҪҚжҖҘеү§дёҠеҚҮпјҢеә”з«ӢеҚі______________________гҖӮ (3)иҝһжҺҘж°ҙи’ёж°”еҸ‘з”ҹиЈ…зҪ®е’ҢеҸҚеә”иЈ…зҪ®д№Ӣй—ҙзҡ„зҺ»з’ғз®ЎеёёиЈ№д»ҘзҹіжЈүз»іпјҢе…¶дҪңз”ЁжҳҜ________гҖӮ (4)BдёӯеҠ е…ҘдёҖе®ҡдҪ“з§Ҝй«ҳж°Ҝй…ёе’Ң1.00g ж°ҹеҢ–зЁҖеңҹзҹҝж ·пјҢDдёӯзӣӣжңүж»ҙеҠ й…ҡй…һзҡ„NaOHжә¶ж¶ІгҖӮеҠ зғӯAгҖҒBпјҢдҪҝAдёӯдә§з”ҹзҡ„ж°ҙи’ёж°”иҝӣе…ҘBгҖӮ в‘ дёӢеҲ—зү©иҙЁдёҚеҸҜд»Јжӣҝй«ҳж°Ҝй…ёзҡ„жҳҜ___________(еЎ«ж ҮеҸ·) a. зЎ«й…ё В В В b.зЎқй…ёВ В c.зЈ·й…ёВ В В d.д№ҷй…ёВ В e.зӣҗй…ё в‘ЎDдёӯдё»иҰҒеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә_________________________________гҖӮ (5)еҗ‘йҰҸеҮәж¶ІдёӯеҠ е…Ҙ25.00mL0.1000molВ·LпјҚ1La(NO3)3жә¶ж¶ІпјҢеҫ—еҲ°LaF3жІүж·Җ(La3+дёҚеҸ‘з”ҹе…¶д»–еҸҚеә”)пјҢеҶҚз”Ё0.1000 molВ· LпјҚ1EDTAж ҮеҮҶжә¶ж¶Іж»ҙе®ҡеү©дҪҷLa3+(La3+дёҺEDTAжҢү1пё°1еҸ‘з”ҹз»ңеҗҲеҸҚеә”)пјҢж¶ҲиҖ—EDTAж ҮеҮҶжә¶ж¶Іе№іеқҮ19.80mLпјҢеҲҷж°ҹеҢ–зЁҖеңҹж ·е“Ғдёӯж°ҹзҡ„иҙЁйҮҸеҲҶж•°дёә______(зҷҫеҲҶж•°дҝқз•ҷе°Ҹж•°зӮ№еҗҺдёӨдҪҚ)гҖӮ
|
|
- 2019-2020е№ҙй«ҳдёҖдёҠеҶҢ第дәҢеӯҰж®өиҖғиҜ•еҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲз”ҳиӮғзңҒеӨ©ж°ҙеёӮ第дёҖдёӯеӯҰпјү
- жЎӮжһ—еёӮй«ҳдёүеҢ–еӯҰжңҲиҖғжөӢйӘҢпјҲ2019е№ҙдёҠеҶҢпјүе…Қиҙ№жЈҖжөӢиҜ•еҚ·
- й«ҳдёүеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·жЁЎжӢҹиҖғиҜ•з»ғд№
- йҮҚеәҶеёӮ第八дёӯеӯҰ2020еұҠй«ҳдёүдёҠеҶҢжңҹжң«иҖғиҜ•зҗҶ科综еҗҲеҢ–еӯҰйўҳе…Қиҙ№еңЁзәҝжЈҖжөӢ
- еҶ…и’ҷеҸӨ2019е№ҙй«ҳдёҖдёӢеҚҠе№ҙеҢ–еӯҰжңҲиҖғжөӢйӘҢиҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- ж–°з–ҶжІҷйӣ…еҺҝ第дәҢдёӯеӯҰ2018е№ҙй«ҳдёҖеҢ–еӯҰеүҚеҚҠжңҹжңҹдёӯиҖғиҜ•е®Ңж•ҙиҜ•еҚ·
- еӣӣе·қзңҒд»ҒеҜҝ第дәҢдёӯеӯҰ2021еұҠй«ҳдёү9жңҲжңҲиҖғзҗҶз»јеҢ–еӯҰдё“йўҳи®ӯз»ғ
- й«ҳдәҢдёҠжңҹе…ҘеӯҰиҖғиҜ•еҢ–еӯҰеңЁзәҝиҖғиҜ•йўҳе…Қиҙ№з»ғд№ пјҲ2019-2020е№ҙж№–еҚ—еёҲиҢғеӨ§еӯҰйҷ„еұһдёӯеӯҰпјү
 )дёӯжңҖеӨҡжңү6дёӘеҺҹеӯҗеңЁеҗҢдёҖзӣҙзәҝдёҠ
)дёӯжңҖеӨҡжңү6дёӘеҺҹеӯҗеңЁеҗҢдёҖзӣҙзәҝдёҠ
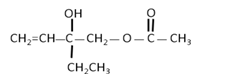

 еҲ¶еҸ–е°‘йҮҸH2
еҲ¶еҸ–е°‘йҮҸH2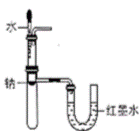 йӘҢиҜҒNaе’Ңж°ҙеҸҚеә”ж”ҫзғӯ
йӘҢиҜҒNaе’Ңж°ҙеҸҚеә”ж”ҫзғӯ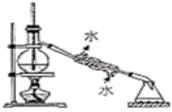 еҲҶзҰ»Na2CO3жә¶ж¶Іе’ҢCH3COOCH2CH3зҡ„ж··еҗҲзү©
еҲҶзҰ»Na2CO3жә¶ж¶Іе’ҢCH3COOCH2CH3зҡ„ж··еҗҲзү© и’ёе№ІNH4ClйҘұе’Ңжә¶ж¶ІеҲ¶еӨҮNH4Clжҷ¶дҪ“
и’ёе№ІNH4ClйҘұе’Ңжә¶ж¶ІеҲ¶еӨҮNH4Clжҷ¶дҪ“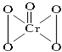 пјҢеҸҜжҺЁзҹҘCrO5дёӯж°§е…ғзҙ зҡ„еҢ–еҗҲд»·е…ЁйғЁжҳҜ-1д»·
пјҢеҸҜжҺЁзҹҘCrO5дёӯж°§е…ғзҙ зҡ„еҢ–еҗҲд»·е…ЁйғЁжҳҜ-1д»·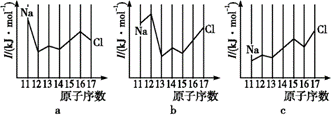
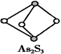 В
В