2016河南高三下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
已知K2O、K2O2、KO2的名称依次是氧化钾、过氧化钾、超氧化钾。那么BaO2的名称是( ) A、氧化钡 B、过氧化钡 C、超氧化钡 D、无法确定
|
|
| 2. | 详细信息 |
|
下列有关氧化还原反应的叙述正确的是( ) A.金属单质在反应中只作还原剂 B.非金属单质在反应中只作氧化剂 C.金属失电子越多,其还原性越强有力 D.Cu2+比Fe2+氧化性强,Fe比Cu还原性强
|
|
| 3. | 详细信息 |
|
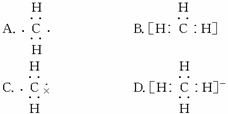
下列表示甲基的电子式中,正确的是( )
|
|
| 4. | 详细信息 |
|
下列各物质中,互为同系物的是( ) ACH3-CH2-CH2-CH3与 C.乙醇和甘油 D.CH3CH2Cl 和CH2ClCH2CH2Cl
|
|
| 5. | 详细信息 |
|
下面是有关厨房中的常见操作或常见现象,其中不属于氧化还原反应的是 A.烧菜用过的铁锅,经放置常出现红棕色斑迹 B.用气灶燃烧沼气(主要成分为甲烷)为炒菜提供热量 C.牛奶久置变质腐败 D.氧化铜固体加入稀盐酸中,完全溶解
|
|
| 6. | 详细信息 |
|
下列说法正确的是( ) A.物质的摩尔质量等于其相对分子(原子)质量 B.摩尔是一个基本的物理量 C.阿佛加德罗常数就是1mol粒子数的集体,0.012kg 12C中约含有6.02×1023个12C D.1mol任何物质都含有6.02×1023个原子
|
|
| 7. | 详细信息 |
|
在某恒容密闭容器中进行如下可逆反应:2M(g)+N(g)
|
|
| 8. | 详细信息 |
|
构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( ) A.E(5s)>E(4f)>E(4s)>E(3d) B.E(3d)>E(4s)>E(3p)>E(3s) C.E(4s)<E(3s)<E(2s)<E(1s) D.E(5s)>E(4s)>E(4f)>E(3d)
|
|
| 9. | 详细信息 |
|
NA表示阿伏加德罗常数。下列说法正确的是 A.7.8 g Na2O2中含有的阴离子数目为0.2 NA B.1mol苯乙烯中含有的碳碳双键数为4NA C.1molNaCl晶体中含有NA个Na+ D.28g乙烯分子中含有极性共价键的数目为6NA
|
|
| 10. | 详细信息 |
|
下列各组离子在常温下一定能大量共存的是 A.pH=0的无色溶液中:Cl-、Na+、SO42-、Fe2+ B.在c(H+)/c(OH-)=1012的溶液中:NH4+、NO3-、K+、Cl- C.加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl- D.含有大量Fe3+的溶液中:Al3+、SCN-、Br-、Na+
|
|
| 11. | 详细信息 |
|
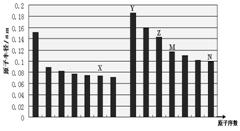
下图是部分短周期主族元素原子半径与原子序数的关系图,下列说法正确的是
A.最高价含氧酸的酸性:M>N B.离子半径:X<Y C.X和Y形成的化合物中一定含有含离子键 D.化合物MX2能与碱反应,不能与任何酸反应
|
|
| 12. | 详细信息 |
|
在1L1mol/L的氨水中 A.含有1molNH3 B.含NH3和NH4+之和为1mol C.含NH3·H2O1mol D.含NH3、NH4+、NH3·H2O共1mol
|
|
| 13. | 详细信息 |
|
用普通圆底烧瓶将某卤化钠和浓硫酸加热至500℃制备纯净HX气体,则该卤化钠是 A.NaF B.NaCl C.NaBr D.NaI
|
|
| 14. | 详细信息 |
|
镁电池毒性低、污染小,电压高而平稳,它逐渐成为人们研制绿色电池的关注焦点。其中一种镁电池的反应原理为: A.放电时,正极反应式:Mo3S4+2xe- =Mo3S42x- B.放电时,Mo3S4发生氧化反应 C.充电时,Mg2+向阴极迁移 D.充电时,阴极反应式:xMg2++2xe-=xMg
|
|
| 15. | 详细信息 | |||||||||||||||||
|
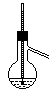
A~D是中学化学实验中使用温度计的装置示意图,其中所做实验与装置不相符的是:
|
||||||||||||||||||
| 16. | 详细信息 |
|
设NA为阿伏加德罗常数,下列说法中正确的是 A.1mol Na2SO4溶于水中,所得溶液中Na+个数为NA B.H2、O2、N2、CO2组成的混合气体1 mol在标准状况下的体积约为22.4 L C.1L 0.3mol·L-1Na2SO4溶液中,含有Na+和SO42- 总数为0.6NA D.NA个氢气分子(H2)的质量为1g
|
|
| 17. | 详细信息 |
|
钡盐行业生产中排出大量的钡泥[主要含有
(1)酸溶后溶液中 (2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸, 原因是 、 。 (3)该厂结合本厂实际,选用的X为 (填化学式);中和Ⅰ使溶液中 (填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)。 (4)上述流程中洗涤的目的是 。
|
|
| 18. | 详细信息 |
|
有X、Y、Z三种元素,已知: ①X、Y、Z的单质在常温下均为气体; ②X单质在Z单质中燃烧,生成XZ,火焰为苍白色; ③每2mol X2分子可与1mol Y2分子化合生成2mol X2Y分子,X2Y在常温下为液体; ④Z单质溶于X2Y中,所得溶液具有漂白作用; ⑤细铁丝能在Z2中剧烈燃烧,且产生棕色的烟. (1)推断X、Y、Z三种元素的名称:X ,Y ,Z .化合物的化学式为:XZ ,X2Y . (2)上述过程中涉及的化学反应方程式: ; ; . (3)配平下列化学方程式 KMnO4+ HCl(浓)→ MnCl2+ Cl2↑+ KCl+ H2O (4)指出下列氧化还原反应电子转移的方向和数目 6NO+4NH3═5N2+6H2O MnO2+4HCl(浓)
|
|
| 19. | 详细信息 |
|
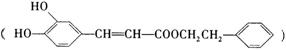
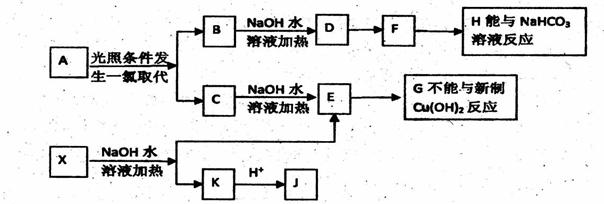
咖啡酸苯乙酯 下转化:
请填写下列空白。 (1)D分子中的官能团是________。 (2)高分子M的结构简式是______________。 (3)写出A→B反应的化学方程式:___________________。 (4)B→C发生的反应类型有______________。 (5)A的同分异构体很多种,其中,同时符合下列条件的同分异构体有____种。 ①苯环上只有两个取代基; ②能发生银镜反应; ③能与碳酸氢钠溶液反应; ④能与氯化铁溶液发生显色反应。 (6)以下对A具有的性质描述正确的是( ) a.1molA可消耗2molNaOH b.一定条件下1molA最多能与1mol氢气加成 c.能发生银镜反应 d.能发生取代反应
|
|
| 20. | 详细信息 |
|
芳香烃A,分子式为C3H10;某烃类衍生物X.分子式为C15H14O3,能使FeC13溶液显紫色:J分子在核磁共振氢谱中有4个特征吸收峰。在一定条件下有如下的转化关系:
(1)A的结构简式为____,X的结构简式为 。 (2)J中所含的含氧官能团的名称为___ _。 (3)E相H反应的化学方程式是____ 。 (4)向银氨溶液中滴人F发生反应的化学方程式为___ _。 (5)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机能I.以I为单体合成的高分子化合物的结构简式是 。 (6)已知J有多种同分异构体,试写出符合下列条件的J的同分异构体的结构简式 。①与FeCl3溶液作用显紫色;②可以发生银镜反应;③苯环上只有2种不同化学环境的氢原子。
|
|
| 21. | 详细信息 | ||||||||
|
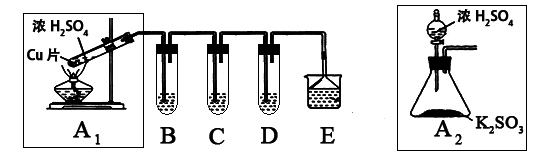
SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:
⑴ B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为______________,C中反应的离子方程式为:____________________________________________。 ⑵ 为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:_____________________________(任写一点即可)。 ⑶ E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
|
|||||||||
| 22. | 详细信息 |
|
某学生利用下图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。按照实验步骤依次回答下列问题:
(1)导线中电子流向为____________(用a、b表示)。 (2)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________ (用“NA”表示); (3)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。 A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动 B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动 C.盐桥中的K+、Cl-都向左侧烧杯移动 D.盐桥中的K+、Cl-几乎都不移动 (4)若将反应2Fe3++Cu===Cu2++2Fe2+设计成原电池,写出电极反应式。 正极反应______________; (5)下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式。 ①电池总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag:__________。 ②2C2H2+5O2 ③6H2O+6CO2
|
|
| 23. | 详细信息 |
|
X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质。Z是地壳中含量最高的金属元素;而地壳中含量最高的非金属元素与X同主族、与Y同周期。 (1)实验室用H2XO4制取XO2气体的化学反应方程式为 。(请用具体元素符号表示化学式,下同) (2)t℃时,0.1 mol·L-1的NaHXO3溶液pH=6,该溶液中各离子浓度由大到小顺序排列为 。 (3)请写出Z的氧化物与烧碱溶液反应的离子方程式 。 (4)一定条件下,YO与YO2存在下列反应:YO(g)+ YO2(g) (5)工业上用氧化YH3法制取YO,该反应的热化学方程式为: 4YH3(g)+5O2(g)=4YO(g)+6H2O(g) △H=-905.8 kJ·mol-1; 已知Y2(g)+O2(g)=2YO(g) △H=+180 kJ·mol-1,则YH3与氧气反应产生两种无污染物质的热化学式为 。 (6)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
①导线中电子移动方向为________。(用A、D表示) ②生成目标产物的电极反应式为__________________。 ③该储氢装置的电流效率η=____________________。 (η=
|
|
| 24. | 详细信息 |
|
有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题: (1)2.3 g A中所含氢原子、碳原子的物质的量各是多少?(4分) (2)通过计算确定该有机物的分子式。(4分)
|
|