2018届高三第一次质量检测化学考卷带参考答案和解析(湖南省郴州市)
| 1. | 详细信息 |
|
化学与生产生活联系紧密,下列有关说法正确的是 A. 只用淀粉溶液即可检验食盐是否为加碘盐 B. 氢氟酸刻蚀水晶饰品体现其酸性 C. 水垢中的CaSO4,可先转化为CaCO3,再用酸除去 D. 煤经过气化和液化等物理变化可转为清洁能源 |
|
| 2. | 详细信息 |
|
下列与化学有关的文献,理解错误的是 A. 《咏石灰》(明?于谦)中“…烈火焚烧若等闲…要留清白在人间”其中“清白”是指氢氧化钙 B. 《咏煤炭》(明?于谦)中“凿开混沌得乌金…不辞辛苦出山林”其中“乌金”的主要成分是煤炭 C. 《天工开物》中记载:“以消石、硫磺为主。草木灰为辅。…魂散惊而魄齑粉”文中提到的是火药 D. 《天工开物》中有如下描述:“世间丝、麻、裘、褐皆具素质…”文中的“裘”主要成分是蛋白质 |
|
| 3. | 详细信息 |
|
1mol化学式为C4H8O3的物质分别与足量的NaHCO3且和Na反应产生气体的物质的量相等,满足条件的同分异构体数目为(不考虑空间异构) A. 4种 B. 5种 C. 6种 D. 7种 |
|
| 4. | 详细信息 |
|
设NA表示阿伏加德罗常数的值,下列说法正确的是 A. 80℃时,1L pH=l的硫酸溶液中,含有的OH-数目为10-13NA B. 向含有FeI2的溶液中通人适量氯气,当有1molFe2+被氧化时,该反应转移电子数目为3NA C. l00g质量分数为46%的乙醇水溶液中氧原子数为4NA D. 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子 |
|
| 5. | 详细信息 |
|
下列解释实验过程或事实的反应方程式不正确的是 A. 熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH B. 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+ H2O2+2H+= I2+O2↑+2H2O C. 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+ 4H2O(g) D. “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+ Cl-+ 2H+= Cl2↑+H2O |
|
| 6. | 详细信息 |
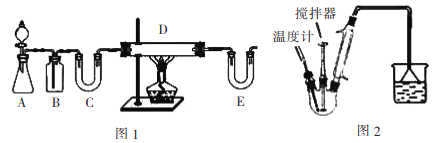
某同学查阅教材得知,普通锌锰电池筒内无机物质主要成分为MnO2、NH4Cl、ZnCl2等物质。他在探究废干电池内的黑色固体回收利用时,进行如图所示实验:下列有关实验的叙述中,不正确的是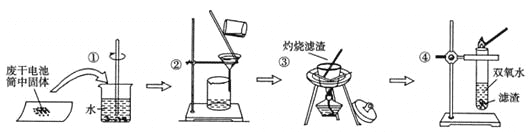 A. 操作①中玻璃棒的作用是加快固体溶解速度 B. 操作②的操作名称是过滤 C. 操作③中盛放药品的仪器是坩埚 D. 操作④的目的是除去滤渣中杂质 |
|
| 7. | 详细信息 |
已知a、b、c、d四种短周期主族元素,在周期表中相对位置如下图所示,下列说法正确的是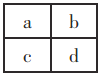 A. a、c两元素的最高正价一定相等 B. d的原子序数不可能是b的原子序数的3倍 C. c的最高价氧化物对应的水化物可溶于d的最高价氧化物对应的水化物 D. 若c元素最高价氧化物对应的水化物是强酸,则d元素的单质具有强氧化性 |
|
| 8. | 详细信息 |
|
常温下,下列各组离子在指定溶液中一定能大量共存的是 A. 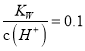 的溶液中:Na+、K+、SiO32?、SO32- 的溶液中:Na+、K+、SiO32?、SO32-B. pH=1的溶液中:K+、Al3+、SO42-、F? C. 与镁反应生成氢气的溶液中:Na+、Ba2+、NO3-、Cl- D. 0.1mol/L的NaHCO3溶液中:NH4+、Mg2+、Br-、AlO2- |
|
| 9. | 详细信息 |
乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是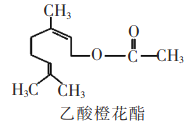 ①1mol该有机物可消耗3mol H2; ②不能发生银镜反应; ③分子式为C12H20O2;? ④它的同分异构体中可能有酚类;? ⑤1 mol该有机物水解时只能消耗1mol NaOH A. ②③④ B. ①④⑤ C. ①②③ D. ②③⑤ |
|
| 10. | 详细信息 |
|
优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2-乙烯吡啶(简写P2VP)和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为2Li+P2VP?nI2= P2VP?(n-1)I2+2LiI,则下列说法正确的是 A. 正极的反应为P2VP?nI2+2e-= P2VP?(n-1)I2+2I- B. 电池工作时,碘离子移向P2VP极 C. 聚2-乙烯吡啶的复合物与有机物性质相似,因此聚2-乙烯吡啶的复合物不会导电 D. 该电池所产生的电压低,使用寿命比较短 |
|
| 11. | 详细信息 | ||||||||||||||||||||
由下列实验操作和现象得出的结论正确的是
|
|||||||||||||||||||||
| 12. | 详细信息 |
一定条件下,CO2(g)+3H2(g)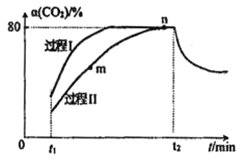 A. m点:v(正)>v(逆) B. 活化能:过程Ⅱ>过程I C. n点时该反应的平衡常数K=50 D. 过程I,t2时刻改变的反应条件可能是升高温度 |
|
| 13. | 详细信息 |
|
某溶液中含有的离子可能是K+、Ba2+、A13+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种, 现进行如下实验: ①取少量溶液加氢氧化钠溶液过程中无沉淀生成 ②另取少量原溶液,逐滴加入5 mL0.2 mol?L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失。 ③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.435 g。 下列说法中正确的是( ) A. 该溶液中一定不含Ba2+ 、Mg2+、A13+、SiO32-、Cl- B. 该溶液中一定含有K+、AlO2-、CO32-、Cl- C. 该溶液是否有K+ 需做焰色反应(透过蓝色钴玻璃片) D. 可能含有Cl- |
|
| 14. | 详细信息 |
甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去)。下列说法错误的是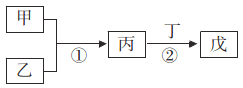 A. 若戊为一种强碱且焰色反应为黄色,则反应①②可能都属于氧化还原反应 B. 常温下,若丙为无色气体,戊为红棕色气体,则甲、乙可能是铜和稀硝酸 C. 若甲为硫磺燃烧产物,丁为水,则戊不可用于干燥甲 D. 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色 |
|
| 15. | 详细信息 |
|
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为pg .cm-3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的有 ① A. ②③ B. ②④ C. ③④ D. ①③ |
|
| 16. | 详细信息 |
|
某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与l00mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成硫单质2.4g、FeCl20.425mol和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是 A. l00mL的盐酸中HC1物质的量浓度为7.5mol/L B. 生成的H2S气体在标准状况下的体积为2.24L C. 该磁黄铁矿中FexS的x=0.85 D. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3:1 |
|
| 17. | 详细信息 | ||||||||||||||||||||
FeCl2是一种常用的还原剂。有关数据如下:
|
|||||||||||||||||||||
| 18. | 详细信息 |
|
(14分)某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2。 (1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式: MnO2 + FeS + H2SO4 (2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按以下的工业流程进行操作处理得溶液(IV),电解溶液(IV)即得MnO2和Zn。 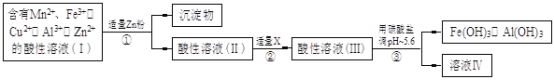 a.操作①中加Zn粉后发生反应的离子方程式为 。 b.操作②中加入适量X的作用是什么 ;X的首选物的化学式是 。 c.操作③中所加碳酸盐的化学式是 。 (3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如下的有关流程图 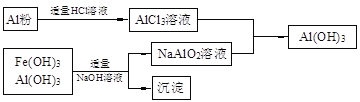 a.AlCl3溶液和NaAlO2溶液反应生成AI(OH)3的离子方程式为 ,若总共得到n molAl(OH)3,则消耗的NaOH和HCl的理论量(mol)分别为 、 。 b.若使用下列流程回收处理,请比较两个流程消耗酸碱的用量? 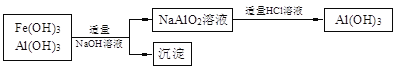 |
|
| 19. | 详细信息 |
CO2是燃烧和代谢的最终产物,也是造成温室效应的废气,但CO2作为一种资源,开发和利用的前景十分诱人。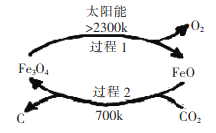 I、利用太阳能,以CO2为原料制取炭黑的流程如上图所示。过程2的化学方程式为:__________。 II、近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应制取甲醇。其工艺流程如图所示: 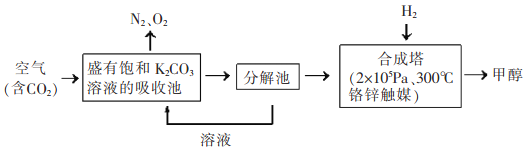 (1)①由吸收池导入分解池中的主要物质的化学式是____________。 ②上述流程中____________(填化学式)可循环使用,该流程体现了“绿色化学”理念。 (2)不同温度下,在1L恒容密闭容器中充入2mol CO2和5 mol H2,相同时间内测得CO2的转化率随温度变化如下图所示: 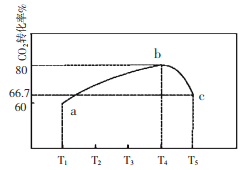 ①合成塔中发生的化学反应方程式为____________。 ②T1时a点v(正)____________v(逆)(填“>”,“<”,“=”) ③计算温度为T4时b的平衡常数为____________。 (3)为检验吸收池中饱和K2CO3溶液是否充足,量取l00mL吸收液用0.10 mol./L盐酸滴定,生成的V(CO2)(标准状况下)随V(盐酸)变化关系如图所示: 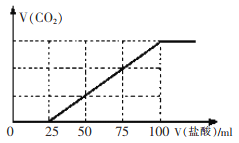 则该l00mL吸收液还可吸收标准状况下_______mLCO2. III、以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将CO2转化为低碳烯烃,工作原理如右图所示。  (1)H+的移动方向是_______________(填从左至右或从右至左); (2)产生乙烯的电极反应式为_______________。 |
|
| 20. | 详细信息 |
对乙酰氨基苯酚(F)是最常用的非甾体消炎解热镇痛药,用于治疗感冒发烧、关节痛、神经痛、偏头痛等,它可用最简单的烯烃A等合成: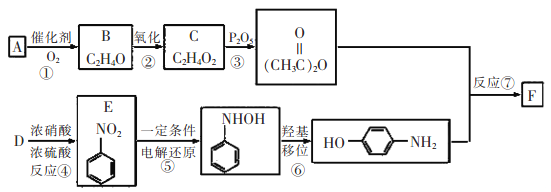 已知: 请回答下列问题: (1)E的名称为__________,C中含有的官能团是__________。 (2)B的结构简式是__________,反应③的反应类型是__________。 (3)F与足量NaOH溶液反应的化学方程式为__________。 (4)F的同分异构体有很多,其中一类同时满足下列条件的同分异构体共有_______种。 ①苯环上有三个侧链;②与FeCl3溶液发生显色反应;③能发生银镜反应且醛基直接连在苯环上。 (5)参照F的合成路线,设计一条以溴苯为起始原料制备 |
|