2018黑龙江高一上学期人教版高中化学期末考试
| 1. | 详细信息 |
|
化学在生产和生活中有重要的应用,下列说法正确的是( ) A.苏打在生活中可用做发酵粉 B.磁性氧化铁可用于制备颜料和油漆 C.石灰石既是制玻璃的原料又是制水泥的原料 D.二氧化硅可用于制作硅芯片和光电池 |
|
| 2. | 详细信息 |
|
下列试剂储存说法不正确的是( ) A.金属钠存放在盛有煤油的试剂瓶中 B.漂白粉置于冷暗处密封保存 C.存放液溴的试剂瓶中应加水封 D.烧碱盛放在玻璃瓶塞的磨口玻璃瓶中 |
|
| 3. | 详细信息 |
|
下列叙述不正确的是( ) A.丁达尔效应可以区别溶液和胶体 B.合金与各组分金属相比一般具有更大的硬度 C.向醋酸溶液中加入Na2CO3固体,溶液的导电性明显增强 D.配制一定物质的量浓度溶液,定容时仰视容量瓶刻度线,使所得溶液浓度偏大 |
|
| 4. | 详细信息 |
|
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( ) A.常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5 NA B.标准状况下,7.1 g氯气与足量氢氧化钠稀溶液反应转移的电子数为0.1NA C.1 mol Fe(OH)3胶体中含有的胶粒数目为NA D.2 L 0.5 mol·L−1硫酸钾溶液中阴离子所带电荷数为NA |
|
| 5. | 详细信息 |
|
在加入铝粉能放出氢气的溶液中,下列各组离子可能大量共存的是( ) A. Na+、K+、AlO C. Mg2+、Fe3+、I-、SO
|
|
| 6. | 详细信息 | |||||||||||||||
|
完成下列实验所选择的装置或仪器正确的是( )
|
||||||||||||||||
| 7. | 详细信息 |
|
下列离子方程式与所述事实相符且正确的是( ) A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO B.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O C.水玻璃中通入少量的二氧化碳:Na2SiO3+CO2+H2O=2Na++CO32-+H2SiO3↓ D.氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
|
| 8. | 详细信息 |
|
下列关于氯及其化合物说法正确的是( ) A.氯气溶于水的离子方程式:Cl2+H2O===2H++Cl-+ClO- B.洁厕灵不能与“84”消毒液混用,原因是两种溶液混合产生的HClO易分解 C.漂白粉在空气中久置变质是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 D.氯气可以使湿润的有色布条褪色,实际起漂白作用的物质是次氯酸,而不是氯气 |
|
| 9. | 详细信息 |
|
一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1 mol N2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )
A.右边与左边分子数之比为4∶1 B.右侧CO的质量为5.6 g C.右侧气体密度是相同条件下氢气密度的14倍 D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入0.2 mol CO |
|
| 10. | 详细信息 |
|
赤铜矿的主要成分是氧化亚铜(Cu2O),辉铜矿的主要成分是硫化亚铜(Cu2S),将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O===6Cu+SO2↑,下列对于该反应的说法正确的是( ) A.该反应中的氧化剂只有Cu2O B. Cu2S在反应中既是氧化剂又是还原剂 C.Cu既是氧化产物又是还原产物 D. 氧化产物与还原产物的物质的量之比为6:1 |
|
| 11. | 详细信息 | |||||||||||||||
|
下列实验操作不能达到实验目的的是( )
|
||||||||||||||||
| 12. | 详细信息 | |||||||||||||||||||||||||||
|
下列各组物质之间不能通过一步就能实现如图所示转化的是( )
|
||||||||||||||||||||||||||||
| 13. | 详细信息 |
|
已知含有硝酸铜、硝酸锌、硝酸铁、硝酸银各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后,铁溶解,溶液中不存在Fe3+,同时析出0.1mol银。下列结论正确的是( ) A. 氧化性:Ag+ >Cu2+>Fe3+> Zn2+ B. 溶液中Cu2+与Fe2+物质的量比为2:1 C. 0.1mol Fe可还原0.2mol阳离子 D. 加入0.1molFe时发生了反应Fe+Cu2+=Fe2++Cu |
|
| 14. | 详细信息 |
|
向NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
A.在0~a范围内,只发生中和反应 B.ab斜段发生反应的离子方程式为CO C.a=0.3 D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
|
|
| 15. | 详细信息 |
|
有一混合物的水溶液可能含有以下离子中的若干种:Na+、NH4+、Cl﹣、Ba2+、HCO3﹣、SO42﹣,现取两份100mL的该溶液进行如下实验: (1)第一份加足量NaOH溶液,加热,收集到标准状况下的气体448mL; (2)第二份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g. 根据上述实验,下列推测正确的是( ) A. Ba2+一定存在 B.100mL该溶液中含0.01mol HCO3﹣ C.Na+不一定存在 D.Cl﹣不确定,可向原溶液中加入AgNO3溶液进行检验 |
|
| 16. | 详细信息 |
|
有以下物质①Na2SO4溶液 ②熔融的CaCl2 ③CuSO4·5H2O固体 ④KOH固体 ⑤石墨 ⑥蔗糖。 有关它们的说法正确的是( ) A. 不能导电的有③④⑥ B. 属于电解质有①②③④ C. 属于非电解质的有①⑤⑥ D. 属于混合物的有①②③⑥ |
|
| 17. | 详细信息 |
|
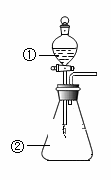
下列说法正确的是( ) A. 节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现 B. 将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是a%和b%的两种溶液,则a和b的关系是a=b C. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,说明金属铝的熔点较低 D. 用如图装置进行实验,将装置①中的AlCl3溶液滴入装置②浓氢氧化钠溶液,溶液中可观察到有大量白色沉淀产生 |
|
| 18. | 详细信息 |
|
铁、铜混合粉末18.0g加入到100mL 5.0mol•L﹣1 FeCl3溶液中,充分反应后,剩余固体质量为2.8g 。下列说法正确的是( ) A.剩余固体是铁、铜混合物 B.原固体混合物中铜的质量是9.6g C.反应后溶液中n(Fe3+)=0.10mol D.反应后溶液中n(Fe2+)+n(Cu2+)=0.75mol |
|
| 19. | 详细信息 |
|
A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化如图所示(某些反应条件和部分反应产物已略去)。
(1)写出下列物质的化学式:D X 。 (2)在反应①~⑦中,不属于氧化还原反应的是 (填编号)。 (3)反应⑥的离子方程式为: 。 (4)反应⑦的化学方程式为 ;该反应中每消耗0.3mol的A,可转移电子 mol。 (5)除去D溶液中混有的少量G的方法是: 。 (6)检验G溶液中阳离子的方法是: 。 |
|
| 20. | 详细信息 |
|
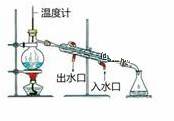
(1)在标准状况下,4.48LCH4和CO2的混合气体质量为6.0g,则该混合气体的平均摩尔质量为____,其中CH4和CO2的物质的量之比为____。 (2)将17.1gBa(OH)2溶解在水中,配成100mL溶液,配好后从中取出10mL溶液,加水稀释至100mL,则稀释后所得溶液中OH-的物质的量浓度是__________mol/L。 (3)在标准状况下,VL某气体(摩尔质量为Mg/mol)溶解在1L水(水的密度近似为1g/cm3)中,假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的物质的量浓度c=______mol/L(用以上字母表示,且必须化简)。 (4)实验室用MnO2与浓盐酸制取Cl2,发生反应的化学方程式:______________________。 ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应: NaClO2+HCl→ClO2↑+NaCl+H2O。写出配平的化学方程式________________________。生成0.2molClO2转移的电子数目为________ 。 (5)取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为_______________________。如果向FeBr2 溶液中通入等物质的量的Cl2,该反应的离子方程式为___________________________。 |
|
| 21. | 详细信息 |
|
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入2.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
(1)A点沉淀物的化学式为_______________________。B点纵坐标为_______________________。 (2)A点至B点改为通入二氧化碳气体,至少须标准状况下二氧化碳_______________________mL。 此时发生反应的离子方程式为 。 (3)B点含溶质的物质的量是___________________________mol。C点(此时沉淀恰好完全溶解)HCl溶液的体积为___________________________mL。 |
|
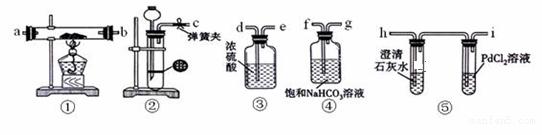
| 22. | 详细信息 |
|
某同学为了探究钠与CO2的反应,利用如图装置进行实验。(已知PdCl2能被CO还原为黑色的Pd)
(1)装置②中用稀盐酸与CaCO3反应制备CO2,在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是 。 A. H2SO4溶液 B. CCl4 C. 苯 D. 稀硝酸 (2)将图中各装置按顺序连接(填装置接口字母):c接 , 接 , 接 , 接 。 (3)装置④的作用是 。 (4)检查完装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到 时再点燃酒精灯。 (5)若反应过程中CO2足量,钠与CO2充分反应后,生成的固体物质可能有多种情况,该同学提出以下猜想: ①生成的固体物质为Na2CO3 ②生成的固体物质为Na2CO3和C的混合物 ③生成的固体物质为Na2CO3和Na2O的混合物 假设反应过程中有下列两种情况: I. 观察到装置⑤PdCl2溶液中有黑色沉淀,若装置①中固体成分只有一种,且向固体中加入稀盐酸可产生能使澄清石灰水变浑浊的气体,写出该情况下钠与CO2反应的化学方程式 。 II. 装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入足量的稀盐酸中产生224ml(标准状况)CO2气体,溶液中残留固体的质量为 。 (6)设计实验方案证明装置①中加入的金属钠部分被氧化(已知:金属钠部分被氧化为Na2O) 。 |
|