2019福建高一上学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
下列说法正确的是( ) A.用食盐水易清洗热水瓶中的水垢 B.利用丁达尔现象区别溶液和胶体 C.生铁炼钢的过程并没有发生化学变化 D.漂白粉在空气中容易变质的原因是 Ca(ClO)2 见光分解
|
|
| 2. | 详细信息 |
|
下列说法错误的是( ) A.化学是近代人类新发现的一门科学 B.假说是研究物质性质的基本方法之一 C.在研究氯气的性质时,发现有刺激性气味,该过程使用了观察法 D.化学家可以操纵分子和原子,制造出自然界中不存在的物质
|
|
| 3. | 详细信息 |
|
下列说法正确的是( ) A.将钠放入水中,钠将沉入水底 B.金属钠着火时,可以用泡沫灭火器或用干燥的沙土灭火 C.将一小块钠放入 CuSO4 溶液中发生反应:2Na+CuSO4 = Na2SO4+Cu D.钠块放置于空气中,表面变暗;加热时,钠燃烧,发出黄色火焰
|
|
| 4. | 详细信息 |
|
NA 代表阿伏加德罗常数的值。下列说法正确的是( ) A.配制 1L 0.1mol/L 的 CuSO4 溶液需称取 1.6g CuSO4 固体 B.常温常压下,1mol O3 气体体积约为 22.4L C.浓度为 1mol·L−1 的盐酸所含氯化氢分子的数目为 NA D.5.6 g Fe 与足量 Cl2 反应,转移的电子数为 0.3NA
|
|
| 5. | 详细信息 | |||
|
对下列现象或事实的解释不正确的是( | ) | |||
| 现象或事实 | 解释 | |||
| A | CO2 气体缓缓通入包裹有 Na2O2 粉末 | Na2O2 与 CO2 反应放出热量 | ||
| 的棉花,棉花很快燃烧起来 | ||||
| B | 将 Na2O2、Na2O 分别溶于水,再往 | Na2O2、Na2O 都是碱性氧化物 | ||
| 其中滴入酚酞,最终溶液均变红色 | ||||
| C | Na 投入水中会熔成光亮的小球 | Na 与水反应放热且钠的熔点低 | ||
| D | 工业上常用钠冶炼金属钛: | Na 具有强还原性 | ||
| 4Na+TiCl4 | Ti+4NaCl | |||
| 6. | 详细信息 | |
|
7.关于氯气的性质下列说法不正确的是( | ) | |
| 7. | 详细信息 |
|
新制氯水中含有次氯酸具有杀菌作用,常用于自来水的消毒。下列有关说法正确的是( ) A.次氯酸中氯元素呈 -1 价 B.次氯酸既不是电解质,也不是非电解质 C.新制氯水长期放置后仍可用于自来水的消毒 D.往氯水中加入 AgNO3 溶液产生白色沉淀,说明氯水中有 Cl-存在
|
|
| 8. | 详细信息 | ||||
|
下列在无色溶液中能大量共存的离子组是( )
|
|||||
| 9. | 详细信息 | |
|
下列电离方程式书写正确的是( | ) | |
| A.NaHCO3Na+ + HCO3- | B.CaCO3 = Ca2+ + CO32- | |
| C.Cu(NO3)2 = Cu2+ + (NO3-)2 | D.HClO = H+ + ClO- | |
| 10. | 详细信息 | |
|
关于分散系的描述错误的是( | ) | |
| 11. | 详细信息 |
|
化学概念相互间存在如下 3 种关系,下列说法不正确的是 ( )
包含关系 并列关系 交叉关系 A.电解质与酸、碱、盐属于包含关系 B.化合物与氧化物属于包含关系 C.碱性氧化物与酸性氧化物属于并列关系 D.复分解反应与氧化还原反应属于交叉关系
|
|
| 12. | 详细信息 |
|
现有物质:①铁片、②NaCl、③氨水、④硫酸钡、⑤酒精、⑥盐酸、 ⑦稀 H2SO4、⑧KOH、 ⑨蔗糖、⑩H2S;下列全部属于电解质的一组是( ) A.⑥⑧⑩ B.②④⑩ C.④⑦⑧ D.②③⑥
|
|
| 13. | 详细信息 |
|
下列离子方程式正确的是( ) A.氯化亚铁溶液中通入氯气:Fe2+ + Cl2 = Fe3+ + 2Cl- B.碳酸钙溶液与盐酸溶液反应:CO32-+2H+ = CO2↑+H2O C.氢氧化钡溶液与硫酸溶液反应:Ba2+ + SO42- = BaSO4↓ D.铜片插入硝酸银溶液中:Cu + 2Ag+ = Cu2+ + 2Ag
|
|
| 14. | 详细信息 |
|
工业上常用氨气来检测输送氯气的管道是否发生漏气,其原理为 3Cl2 + 8NH3 = 6NH4Cl + N2,下列关于该反应的说法正确的是( ) A.Cl2 发生氧化反应 B.氯气为氧化剂,氮气为还原产物 C.未被氧化的 NH3 与被氧化的 NH3 物质的量之比为 3:1 D.氯气的氧化性比氮气的氧化性弱
|
|
| 15. | 详细信息 |
|
已知常温下,在溶液中可发生以下两个反应:①Cl2 + 2Br- = Br2 + 2Cl-;②Br2 + 2Fe2+ = 2Fe3+ + 2Br-。现将标准状况下 1.12L 的氯气通入 1L 0.05mol/L 的 FeBr2 溶液中,由此判断下列说法正确的是( ) A.氧化性强弱:Cl2 > Fe3+ > Br2 B.还原性强弱:Br- >Fe2+ >Cl- C.反应后溶液中 c(Fe3+):c(Br- ) =1:1 D.反应后溶液中 c(Fe2+):c(Cl- ) =1:2
|
|
| 16. | 详细信息 |
|
下列叙述正确的是( ) A.物质的摩尔质量等于其相对分子(原子)质量 B.摩尔是七个基本物理量之一 C.非标准状况下,1 mol 气体体积也可能为 22.4 L D.1mol 任何物质中都含有阿伏加德罗常数个原子
|
|
| 17. | 详细信息 |
|
一种生活中常用的纯碱溶液浓度为 0.5 mol/L,某同学欲用纯碱粉末配制该溶液 480 mL 备用。请回答下列相关问题: (1)除烧杯、玻璃棒外,一定还需要用到的玻璃仪器有(2)计算:需要称取纯碱固体的质量为__________ g (3)配制时,正确的操作顺序是(每个序号只用一次)
A.用少量水洗涤烧杯 2 次~3 次,洗涤液均注入容量瓶,振荡 B.在盛有纯碱固体的烧杯中加入适量水溶解 C.将恢复到室温的溶液沿玻璃棒注入容量瓶中 D.将容量瓶塞紧,上下颠倒摇匀 E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相平 F.继续往容量瓶内小心加水,直到液面接近刻度 1 cm~2 cm 处 (4)下列会导致所配溶液实际浓度偏高的是
a.在 C 步骤中未恢复到室温即注入容量瓶 b.在 D 步骤完成后发现液面低于刻度线 c.在 E 步骤中俯视凹液面 (5)若欲用上述溶液另外配制 100 mL 0.2 mol/L 的纯碱溶液,则需取用上述溶 液的体积为 mL
|
|
| 18. | 详细信息 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
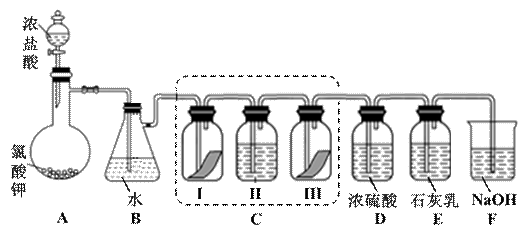
某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。 已知:①A 中反应为 KClO3+6HCl(浓) = KCl+3Cl2↑+3H2O;②石灰乳的主要成分为 Ca(OH)2,其他杂质不参与反应。
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中 I、II、III 处依次放入的物质正确的是_________(填编号)。
(3)待 E 中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主 要成份为 、 (填化学式)。
(4)F 装置的作用是(用离子方程式表示)
(5)为测定(3)中所得漂白粉的有效成份含量。称取 a g 漂白粉样品溶解, 往所得溶液中通入 CO2 至不再产生沉淀为止,该过程的化学方程式为
。若反应生成沉淀的物质的量为 b mol,则该
漂白粉中有效成份的质量分数为 (用含 a、b 的式子表示)。
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 19. | 详细信息 |
|
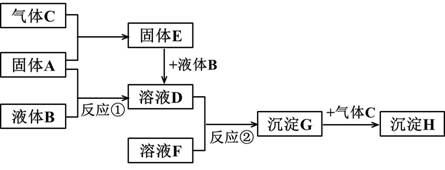
下图转化关系中的物质均为常见物质或它们的溶液,其中 A、C 为 单质,B 为氧化物且常温下为无色液体,E 为淡黄色固体,H 为红褐色沉淀。(反 应条件和部分产物已省略)
根据上述转化关系,回答问题: (1)写出下列物质的化学式:A_________ G _________ (2)反应①的化学方程式为:______________________________________。 反应②的离子方程式为:______________________________________。 (3)沉淀 G 转化为沉淀 H 的现象: ,
化学方程式为
(4)写出物质 E 的一种用途________________________________。 (5)一定条件下,将一定量的 A 与足量的 C 充分反应,最终得到 39.0g 固体 E, 则反应中转移的电子数为_______________。
|
|
| 20. | 详细信息 |
|
从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。 (1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是_____。 A.Fe B.FeO C.Fe3O4 D.Fe2O3 (2)在现代半导体工业生产中,常利用 FeCl3 腐蚀铜的原理制作印刷线路板,写出该原理的化学方程式
(3)实验室在配制 FeSO4 溶液时为了防止 FeSO4 溶液变质,经常向其中加入铁 粉,其原因是(用离子方程式表示) 。
(4)现有配制所得的 100mL 6mol/L FeSO4 溶液,往其中滴入一定量的稀硝酸,请回答下列问题: ①配平该反应的离子方程式: □Fe2++□NO3-+□H+ = □Fe3++□NO↑+□H2O ②要检验该反应后的溶液中是否还含有 Fe2+,可选用的试剂为
A. 酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2 ③写出上述②的具体实验方案(含操作、现象、结论):____________________ 。
④经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体 积为(标准状况下) L。
|
|