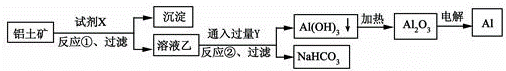2018йҷ•иҘҝй«ҳдёҖдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰдёҺз”ҹдә§е’Ңз”ҹжҙ»еҜҶеҲҮзӣёе…ігҖӮдёӢеҲ—иҝҮзЁӢдёӯжІЎжңүеҸ‘з”ҹеҢ–еӯҰеҸҳеҢ–зҡ„жҳҜпјҲВ В В В пјү A.й“ҒиҪЁзҡ„й”ҲиҡҖВ В В В В В В В В В В В В B.жһӘж”Ҝдҝқеӯҳж—¶ж¶ӮеұӮй»„жІ№йҳІй”ҲиҡҖ C.й“ҒзІүгҖҒз”ҹзҹізҒ°з”ЁдәҺиўӢиЈ…йЈҹе“Ғзҡ„йҳІи…җеҸҠйҳІжҪ® D.ж¶ҲйҳІе‘ҳжҲҙзқҖйҳІжҜ’йқўе…·пјҲеҶ…иЈ…Na2O2пјүж•‘зҒ«
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺNa2CO3гҖҒNaHCO3иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲгҖҖВ гҖҖпјү A.еҸ—зғӯж—¶Na2CO3иҫғNaHCO3жӣҙдёҚзЁіе®ҡпјҢжӣҙжҳ“еҲҶи§Јдә§з”ҹCO2 B.зӯүиҙЁйҮҸзҡ„Na2CO3гҖҒNaHCO3дёҺи¶ійҮҸзӣҗй…ёеҸҚеә”пјҢеүҚиҖ…дә§з”ҹзҡ„CO2жӣҙеӨҡ C.еёёжё©дёӢзӣёеҗҢзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„Na2CO3гҖҒNaHCO3жә¶ж¶ІпјҢеүҚиҖ…зўұжҖ§жӣҙејә D.еҗ‘Na2CO3гҖҒNaHCO3жә¶ж¶ІдёӯеҲҶеҲ«ж»ҙеҠ жҫ„жё…зҹізҒ°ж°ҙпјҢеүҚиҖ…дә§з”ҹзҷҪиүІжІүж·ҖпјҢеҗҺиҖ…ж— жІүж·Җ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
иҰҒйӘҢиҜҒMgгҖҒFeгҖҒCuдёүз§ҚйҮ‘еұһзҡ„жҙ»еҠЁжҖ§йЎәеәҸпјҢеҸҜйҖүз”ЁдёӢеҲ—е“Әз»„зү©иҙЁиҝӣиЎҢе®һйӘҢпјҲгҖҖВ гҖҖпјү A. FeгҖҒCuSO4жә¶ж¶ІгҖҒMgCl2жә¶ж¶ІВ В В В B.FeгҖҒCuгҖҒMgCl2жә¶ж¶І C.MgгҖҒCuOгҖҒFeSO4жә¶ж¶ІВ В В В В В В В В В В В В В D.CuгҖҒFeCl2жә¶ж¶ІгҖҒMgCl2 жә¶ж¶І
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
жҳ“жӢүзҪҗзҡ„дё»иҰҒжҲҗеҲҶдёәй“қеҗҲйҮ‘пјҢе…¶дёӯд»Ҙй“қй“ҒеҗҲйҮ‘е’Ңй“қй•ҒеҗҲйҮ‘жңҖдёәеёёи§ҒпјҺзҺ°еҸ–еҮ е°Ҹеқ—жҳ“жӢүзҪҗзўҺзүҮиҝӣиЎҢдёӢеҲ—е®һйӘҢпјҢе…¶дёӯе®һйӘҢж–№жЎҲдёҺзҺ°иұЎгҖҒз»“и®әжӯЈзЎ®зҡ„жҳҜпјҲгҖҖВ гҖҖпјү
|
||||||||||||||||
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁNAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү A.5.6 gй“ҒдёҺи¶ійҮҸзӣҗй…ёеҸҚеә”иҪ¬з§»зҡ„з”өеӯҗж•°дёә0.3NA B.еёёжё©дёӢпјҢ2.7gй“қдёҺи¶ійҮҸзҡ„зӣҗй…ёеҸҚеә”пјҢеӨұеҺ»зҡ„з”өеӯҗж•°дёә0.3NA C.ж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4 Lж°Ұж°”дёҺ22.4 Lж°ҹж°”жүҖеҗ«еҺҹеӯҗж•°еқҮдёә2NA D.18gNH4пјӢжүҖеҗ«з”өеӯҗж•°дёә11NA
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
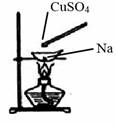
жҹҗеӯҰд№ иө„ж–ҷдёҠжңүиҝҷж ·дёҖдёӘе®һйӘҢпјҡеңЁи’ёеҸ‘зҡҝдёӯж”ҫй»„иұҶзІ’еӨ§е°Ҹзҡ„дёҖеқ—йҮ‘еұһй’ пјҢеҠ зғӯиҮізҶ”еҢ–ж—¶пјҢз”ЁзҺ»з’ғжЈ’иҳёеҸ–е°‘йҮҸж— ж°ҙCuSO4зІүжң«дёҺзҶ”еҢ–зҡ„й’ жҺҘи§ҰпјҢзһ¬й—ҙдә§з”ҹиҖҖзңјзҡ„зҒ«иҠұпјҢеҗҢж—¶жңүзәўиүІзү©иҙЁз”ҹжҲҗпјҺжҚ®жӯӨеҲӨж–ӯдёӢеҲ—иҜҙжі•дёӯдёҚжӯЈзЎ®зҡ„жҳҜпјҲгҖҖВ гҖҖпјү A.дёҠиҝ°еҸҚеә”жҳҜзҪ®жҚўеҸҚеә” B.дёҠиҝ°еҸҚеә”жҳҜж”ҫзғӯеҸҚеә” C.еҠ зғӯдё”ж— ж°ҙжқЎд»¶дёӢпјҢNaеҸҜд»ҘдёҺCuSO4еҸҚеә”并з”ҹжҲҗCu D.дёҠиҝ°е®һйӘҢиҜҒжҳҺCuSO4е…·жңүиҝҳеҺҹжҖ§
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷе°‘йҮҸйҮ‘еұһй’ ж”ҫе…ҘдёӢеҲ—зӣӣжңүи¶ійҮҸжә¶ж¶Ізҡ„е°Ҹзғ§жқҜдёӯпјҲеҝҪз•Ҙжё©еәҰзҡ„еҸҳеҢ–пјүпјҢж—ўжңүж°”дҪ“з”ҹжҲҗпјҢеҸҲжңүзҷҪиүІжІүж·Җдә§з”ҹзҡ„жҳҜпјҲгҖҖВ гҖҖпјү в‘ MgSO4жә¶ж¶ІВ В В В В В В В в‘ЎйҘұе’ҢNaClжә¶ж¶ІВ В В В в‘ўNa2SO4жә¶ж¶І в‘ЈCaпјҲHCO3пјү2жә¶ж¶ІВ В в‘ӨAl2пјҲSO4пјү3жә¶ж¶ІВ В В в‘ҘCuSO4жә¶ж¶ІпјҺ A.в‘ в‘Ўв‘Јв‘ӨВ В В В B.в‘ўв‘Јв‘Өв‘ҘВ В В C.в‘ в‘Ўв‘ўв‘ЈВ В В В В В В D.в‘Ўв‘Јв‘Өв‘Ҙ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘еҗ«жңүMn2+зҡ„й…ёжҖ§жә¶ж¶Ідёӯж»ҙеҠ иҝҮдәҢзЎ«й…ёй’ҫпјҲK2S2O8пјүжә¶ж¶ІпјҢеҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҲжңӘй…Қе№іпјҢдёҚиҖғиҷ‘ж»ҙеҠ еҗҺжә¶ж¶ІдҪ“з§ҜеҸҳеҢ–пјү:Mn2++S2O82п№Ј+H2OвҶ’MnO4п№Ј+SO42п№Ј+H+пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ пјҲВ В В В пјү A.еҸҚеә”еҗҺжә¶ж¶Ізҡ„й…ёжҖ§еҮҸејұ B.жңү1molиҝҳеҺҹеүӮеҸӮеҠ еҸҚеә”ж—¶пјҢиҪ¬з§»5molз”өеӯҗ C.иҜҘеҸҚеә”дёӯиө·ж°§еҢ–дҪңз”Ёзҡ„жҳҜMn2+ D.з”ЁиҝҮдәҢзЎ«й…ёй’ҫпјҲK2S2O8пјүжә¶ж¶ІжЈҖйӘҢMn2+еӯҳеңЁзҡ„е®һйӘҢзҺ°иұЎжҳҜжә¶ж¶Ізҙ«зәўиүІж¶ҲеӨұ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗйҮ‘еұһ еҠ зғӯ3.40gиҜҘзЎқй…ёзӣҗпјҢе®Ңе…ЁеҲҶи§Јз”ҹжҲҗNO2е’ҢO2е…ұ672mLпјҲж ҮеҮҶзҠ¶еҶөпјүпјҢеҲҷMзҡ„зӣёеҜ№еҺҹеӯҗ иҙЁйҮҸдёәпјҲВ В В В В пјү A. 23В В В В В В В В B. 40В В В В В В В В C. 108В В В В В В В D. 201
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||
|
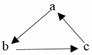
NaгҖҒAlгҖҒFeгҖҒCuжҳҜдёӯеӯҰеҢ–еӯҰдёӯйҮҚиҰҒзҡ„йҮ‘еұһе…ғзҙ гҖӮе®ғ们зҡ„еҚ•иҙЁеҸҠе…¶еҢ–еҗҲзү©д№Ӣй—ҙжңүеҫҲеӨҡиҪ¬еҢ–е…ігҖӮдёӢиЎЁжүҖеҲ—зү©иҙЁдёҚиғҪжҢүеҰӮеӣҫпјҲвҖңвҶ’вҖқиЎЁзӨәдёҖжӯҘе®ҢжҲҗпјүе…ізі»зӣёдә’иҪ¬еҢ–зҡ„жҳҜпјҲВ В В пјү
|
||||||||||||||||||||||
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©дёӢпјҢдёӢеҲ—еҗ„з»„зҰ»еӯҗеңЁжҢҮе®ҡжә¶ж¶ІдёӯиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ(гҖҖВ гҖҖ) A.й…ёжҖ§жә¶ж¶ІдёӯпјҡClпјҚгҖҒMg2пјӢгҖҒFe3пјӢгҖҒSCNпјҚ B.1.0 molВ·LпјҚ1зҡ„NaNO3жә¶ж¶ІдёӯпјҡFe2+гҖҒK+гҖҒH+гҖҒSO42п№Ј C.еңЁејәзўұжҖ§зҺҜеўғдёӯпјҡAlO D.0.1 molВ·LпјҚ1жҳҺзҹҫжә¶ж¶ІдёӯпјҡNH
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖе®ҡйҮҸзҡ„Na2O2дёҺCO2еҸҚеә”еҗҺзҡ„еӣәдҪ“зү©иҙЁдёә41.8 gпјҢжҒ°еҘҪдёҺ1 L 1 molВ·LпјҚ1зҡ„зЁҖзӣҗй…ёе®Ңе…ЁеҸҚеә”гҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖ гҖҖ) A.41.8 gеӣәдҪ“зүӘиҙЁдёәNa2CO3 B.41.8 gеӣәдҪ“зү©иҙЁдёә0.1 mol Na2CO3е’Ң0.4 mol Na2O2зҡ„ж··еҗҲзү© C.41.8 gеӣәдҪ“зү©иҙЁдёә31.2 g NaHCO3е’Ң10.6 g Na2CO3зҡ„ж··еҗҲзү© D.дёҖе®ҡйҮҸзҡ„Na2O2дёә78 g
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
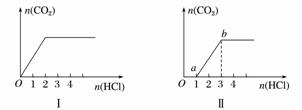
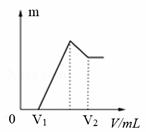
еҗ‘еӣӣеҸӘзӣӣжңүдёҖе®ҡйҮҸNaOHжә¶ж¶Ізҡ„зғ§жқҜдёӯйҖҡе…ҘдёҚеҗҢйҮҸзҡ„CO2ж°”дҪ“пјҢеҶҚеңЁжүҖеҫ—жә¶ж¶ІдёӯйҖҗж»ҙеҠ е…ҘзЁҖзӣҗй…ёиҮіиҝҮйҮҸпјҢ并е°Ҷжә¶ж¶ІеҠ зғӯпјҢдә§з”ҹзҡ„CO2ж°”дҪ“дёҺHClзү©иҙЁзҡ„йҮҸзҡ„е…ізі»еҰӮеӣҫ(еҝҪз•ҘCO2зҡ„жә¶и§Је’ҢHClзҡ„жҢҘеҸ‘):
еҲҷдёӢеҲ—еҲҶжһҗйғҪжӯЈзЎ®зҡ„з»„еҗҲжҳҜ(гҖҖВ гҖҖ) в‘ в… еӣҫеҜ№еә”жә¶ж¶Ідёӯзҡ„жә¶иҙЁдёәNaHCO3 в‘Ўв…ЎеӣҫеҜ№еә”жә¶ж¶Ідёӯзҡ„жә¶иҙЁдёәNa2CO3е’ҢNaHCO3пјҢдё”дәҢиҖ…зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә1вҲ¶1 в‘ўв…ўеӣҫеҜ№еә”жә¶ж¶Ідёӯзҡ„жә¶иҙЁдёәNaOHе’ҢNa2CO3пјҢдё”дәҢиҖ…зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә1вҲ¶1 в‘Јв…ЈеӣҫеҜ№еә”жә¶ж¶Ідёӯзҡ„жә¶иҙЁдёәNa2CO3 A.в‘ в‘ЎВ В В В В В В B.в‘ в‘ўВ В В В В В В C.в‘Ўв‘ЈВ В В В В В D.в‘Ўв‘ўгҖҖ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
.еҗ‘Fe2O3е’Ңй“ҒзІүз»„жҲҗзҡ„ж··еҗҲзү©дёӯпјҢеҠ е…ҘйҖӮйҮҸзҡ„зЁҖH2SO4пјҢеҗ„зү©иҙЁжҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҢжөӢеҫ—жә¶ж¶ІдёӯдёҚеҗ«Fe3+пјҢдё”Fe2+дёҺH2зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә4пјҡ1пјҢйӮЈд№ҲеңЁеҸҚеә”дёӯпјҢFe2O3гҖҒFeгҖҒH2SO4зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёәпјҲгҖҖВ гҖҖпјү A.1пјҡ1пјҡ1В В В В B.1пјҡ2пјҡ4В В В В В В В В В C.1пјҡ2пјҡ3В В В В В В В D.2пјҡ3пјҡ5
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ҘдёҡдёҠз”Ёй“қеңҹзҹҝпјҲдё»иҰҒжҲҗеҲҶдёәAl2O3пјҢеҗ«Fe2O3жқӮиҙЁпјүдёәеҺҹж–ҷеҶ¶зӮјй“қзҡ„е·ҘиүәжөҒзЁӢеҰӮдёӢпјҢдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲгҖҖВ гҖҖпјү
A.иҜ•еүӮXж°ўж°§еҢ–й’ жә¶ж¶І B.еҸҚеә”в‘ гҖҒиҝҮж»ӨеҗҺжүҖеҫ—жІүж·ҖдёәзәўиӨҗиүІFe2O3 C.еӣҫдёӯжүҖзӨәиҪ¬еҢ–еҸҚеә”йғҪдёҚжҳҜж°§еҢ–иҝҳеҺҹеҸҚеә” D.еҸҚеә”в‘Ўзҡ„еҢ–еӯҰж–№зЁӢејҸдёә2NaAlO2+CO2+3H2O=2AlпјҲOHпјү3вҶ“+Na2CO3
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗеӣәдҪ“ж··еҗҲзү©дёӯеҸҜиғҪеҗ«жңүпјҡK+гҖҒNa+гҖҒClЛүгҖҒCO32п№ЈгҖҒSO42п№ЈзӯүзҰ»еӯҗпјҢе°ҶиҜҘеӣәдҪ“жә¶и§ЈжүҖеҫ—еҲ°зҡ„жә¶ж¶ІиҝӣиЎҢеҰӮдёӢе®һйӘҢпјҡдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В гҖҖпјү
A.иҜҘж··еҗҲзү©дёҖе®ҡжҳҜK2CO3е’ҢNaCl B.иҜҘж··еҗҲзү©еҸҜиғҪжҳҜNa2CO3е’ҢKCl C.иҜҘж··еҗҲзү©еҸҜиғҪжҳҜNa2SO4е’ҢNa2CO3 D.иҜҘж··еҗҲзү©дёҖе®ҡжҳҜNa2CO3е’ҢNaCl
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү A.4mol/Lзҡ„NaAlO2жә¶ж¶Іе’Ң7mol/Lзҡ„HClзӯүдҪ“з§Ҝдә’зӣёеқҮеҢҖж··еҗҲ 4AlO2пјҚ+7H++H2Oпјқ3Al(OH)3вҶ“+Al3+ B.зЎ«й…ёж°ўй’ жә¶ж¶ІдёҺж°ўж°§еҢ–й’Ўжә¶ж¶Іж··еҗҲжҳҫдёӯжҖ§пјҡH++SO42пјҚ+Ba2++OHпјҚпјқBaSO4вҶ“+H2O C.зЁҖзЎқй…ёдёӯеҠ е…ҘиҝҮйҮҸзҡ„й“ҒзІүпјҡFeпјӢ4HпјӢпјӢNO3пјҚпјқFe3пјӢпјӢNOвҶ‘пјӢ2H2O D.еҗ‘AlCl3жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙпјҡAl3+ + 4 NH3В·H2OпјқAlO2пјҚ+4NH4++2H2O
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
4.48LCO2йҖҡиҝҮдёҖе®ҡйҮҸзҡ„еӣәдҪ“иҝҮж°§еҢ–й’ еҗҺ收йӣҶеҲ°3. 36Lж°”дҪ“пјҲеқҮжҳҜеңЁж ҮеҮҶзҠ¶еҶөдёӢпјүпјҢеҲҷиҝҷ3.36Lж°”дҪ“зҡ„иҙЁйҮҸжҳҜпјҲВ В В В пјү A.3.8gВ В В В B.5.6gВ В В В C.4.8gВ В В В D.6.0g
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
. Feе’ҢFe2O3ж··еҗҲзү©е…ұ27.2gпјҢеҠ е…Ҙ200mLзЁҖH2SO4пјҢ收йӣҶеҲ°ж ҮеҮҶзҠ¶еҶөдёӢ2.24LH2пјҢ жүҖеҫ—жә¶ж¶Ідёӯж»ҙеҠ KSCNжә¶ж¶ІпјҢдёҚеҸҳиүІгҖӮдёәдёӯе’ҢиҝҮйҮҸзҡ„H2SO4пјҢ并дҪҝжә¶ж¶Ідёӯзҡ„йҮ‘еұһйҳізҰ»еӯҗе…ЁйғЁиҪ¬еҢ–дёәжІүж·ҖпјҢе…ұж¶ҲиҖ—дәҶ4 mol/L зҡ„NaOHжә¶ж¶І300 mLпјҢеҲҷиҜҘH2SO4зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёәпјҲВ В В В пјү A.0.5mol/LВ В В B.2mol/LВ В В C.2.25mol/LВ В D.3mol/L
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷ15.6 g Na2O2е’Ң5.4 g AlеҗҢж—¶ж”ҫе…ҘдёҖе®ҡйҮҸзҡ„ж°ҙдёӯпјҢе……еҲҶеҸҚеә”еҗҺеҫ—еҲ°200 mLжә¶ж¶ІпјҢеҶҚеҗ‘иҜҘжә¶ж¶Ідёӯзј“ж…ўйҖҡе…Ҙж ҮеҮҶзҠ¶еҶөдёӢзҡ„HClж°”дҪ“6.72 LпјҢиӢҘеҸҚеә”иҝҮзЁӢдёӯжә¶ж¶Ізҡ„дҪ“з§ҜдҝқжҢҒдёҚеҸҳпјҢеҲҷдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В В В пјү A.жңҖз»Ҳеҫ—еҲ°7.8gжІүж·Җ B.жңҖз»Ҳеҫ—еҲ°зҡ„жә¶ж¶Ідёӯпјҡc(NaAlO2)пјҡc(NaCl) =2пјҡ3В C.ж ҮеҮҶзҠ¶еҶөдёӢпјҢеҸҚеә”иҝҮзЁӢдёӯе…ұз”ҹжҲҗ8.96 Lж°”дҪ“ D.жңҖз»Ҳеҫ—еҲ°зҡ„жә¶ж¶Ідёӯпјҡc(Na+)=2.0 molВ·L-1
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҲ1пјүеңЁж ҮеҮҶзҠ¶еҶөдёӢпјҢCOе’ҢCO2ж··еҗҲж°”дҪ“зҡ„иҙЁйҮҸдёә3.2gпјҢдҪ“з§Ҝдёә2.24LпјҢеҲҷе…¶дёӯCOдёҺCO2зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёәВ В В В В В пјҢиӢҘйҳҝдјҸеҠ еҫ·зҪ—еёёж•°дёәNAпјҢеҲҷжүҖеҗ«OеҺҹеӯҗзҡ„ж•°зӣ®дёәВ В В В В гҖӮ пјҲ2пјүеңЁВ В В В В В В mL 0.2 mol/L NaOHжә¶ж¶Ідёӯеҗ«1 gжә¶иҙЁпјӣй…ҚеҲ¶480 mL 0.2 mol/L CuSO4жә¶ж¶ІпјҢйңҖиҰҒз§°йҮҸCuSO4В·5H2O В В В В В В В В В gгҖӮ пјҲ3пјүеңЁе®һйӘҢе®Өе°Ҷ16.8gеӣәдҪ“NaHCO3еҠ зғӯдёҖж®өж—¶й—ҙеҗҺпјҢжөӢеҫ—еү©дҪҷеӣәдҪ“зҡ„иҙЁйҮҸеҸҳдёә13.7gгҖӮеҲҷжңү______g NaHCO3еҸ‘з”ҹдәҶеҲҶи§ЈеҸҚеә”гҖӮиӢҘ继з»ӯеҜ№еү©дҪҷеӣәдҪ“еҠ зғӯпјҢиҮідёҚеҶҚдә§з”ҹж°”дҪ“еҗҺпјҢе°ҶеҶ·еҚҙеҗҺзҡ„еӣәдҪ“жә¶и§ЈдәҺж°ҙпјҢй…ҚжҲҗ1000mLзҡ„жә¶ж¶ІгҖӮеҲҷиҜҘжә¶ж¶Іжә¶иҙЁзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰжҳҜ____________гҖӮ
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗеҗҢеӯҰж¬ІжҺўз©¶Na2O2дёҺж°ҙзҡ„еҸҚеә”пјҢеҸҜдҫӣдҪҝз”Ёзҡ„иҜ•еүӮжңүпјҡNa2O2гҖҒи’ёйҰҸж°ҙгҖҒKMnO4й…ёжҖ§жә¶ж¶ІгҖҒMnO2гҖӮиҜҘеҗҢеӯҰеҸ–дёҖе®ҡйҮҸNa2O2ж ·е“ҒдёҺиҝҮйҮҸж°ҙеҸҚеә”пјҢеҫ…е®Ңе…ЁеҸҚеә”еҗҺпјҢеҫ—еҲ°жә¶ж¶ІXе’ҢдёҖе®ҡйҮҸO2 гҖӮ пјҲ1пјүNa2O2дёҺж°ҙеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ иӢҘйҳҝдјҸеҠ еҫ·зҪ—еёёж•°дёәNAпјҢзҗҶи®әдёҠжҜҸж¶ҲиҖ—7.8g Na2O2иҪ¬з§»зҡ„з”өеӯҗж•°дёә В В В В В В В В пјҢз”ҹжҲҗзҡ„ж°§ж°”еңЁж ҮеҶөдёӢзҡ„дҪ“з§ҜжҳҜ В В В В В В В В В гҖӮВ пјҲ2пјүиҜҘеҗҢеӯҰжҺЁжөӢеҸҚеә”дёӯеҸҜиғҪз”ҹжҲҗдәҶH2O2пјҢ并иҝӣиЎҢе®һйӘҢжҺўз©¶гҖӮиҜ•и®ҫи®Ўе®һйӘҢеё®еҠ©иҜҘеҗҢеӯҰиҜҒжҳҺжә¶ж¶ІXдёӯеҗ«иҝҮж°§еҢ–ж°ў В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ3пјүйҖҡиҝҮдёҠиҝ°е®һйӘҢиҜҒжҳҺжә¶ж¶ІдёӯзЎ®е®һеӯҳеңЁH2O2 пјҢеҸ–е°‘йҮҸXдәҺиҜ•з®ЎдёӯпјҢж»ҙеҠ FeCl2жә¶ж¶ІпјҢз«ӢеҚіз”ҹжҲҗзәўиӨҗиүІжІүж·ҖпјҢеҶҷеҮәеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮпјҲ4пјүиҜҘеҗҢеӯҰеҸ‘зҺ°жә¶ж¶ІXиҝҳеҸҜдҪҝй…ёжҖ§KMnO4жә¶ж¶ІиӨӘиүІпјҢеҗҢж—¶ж”ҫеҮәж°§ж°”пјҢеҶҷеҮәиҜҘиҝҮзЁӢзҡ„зҰ»еӯҗж–№зЁӢејҸ______________________________________________________гҖӮ
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷ0.1molзҡ„й•ҒгҖҒй“қж··еҗҲзү©жә¶дәҺ100mLгҖҒ2molвҖўLп№Ј1зҡ„H2SO4жә¶ж¶ІдёӯпјҢ然еҗҺеҶҚж»ҙеҠ 1molвҖўLп№Ј1зҡ„NaOHжә¶ж¶ІгҖӮиҜ·еӣһзӯ”пјҡ
пјҲ2пјүиӢҘеңЁж»ҙеҠ NaOHжә¶ж¶ІиҝҮзЁӢдёӯпјҢж¬ІдҪҝMg2+гҖҒAl3+еҲҡеҘҪжІүж·Җе®Ңе…ЁпјҢеҲҷж»ҙе…ҘNaOHжә¶ж¶Ізҡ„дҪ“з§ҜVпјҲNaOHпјү=________mLгҖӮ пјҲ3пјүиӢҘж··еҗҲзү©д»Қдёә0.1molпјҢе…¶дёӯMgзІүзҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°дёәaпјҢз”Ё100mLгҖҒ2molвҖўLп№Ј1зҡ„H2SO4жә¶и§ЈжӯӨж··еҗҲзү©еҗҺпјҢеҶҚеҠ е…Ҙ450mLгҖҒ1molвҖўLп№Ј1зҡ„NaOHжә¶ж¶ІпјҢжүҖеҫ—жІүж·Җдёӯж— Al(OH)3пјҢж»Ўи¶іжӯӨжқЎд»¶зҡ„aзҡ„еҸ–еҖјиҢғеӣҙжҳҜ________гҖӮ
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
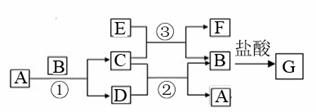
дёӢеӣҫдёӯжүҖж¶үеҸҠзҡ„AгҖҒBгҖҒCгҖҒDгҖҒEгҖҒFе’ҢGзӯүйғҪжҳҜдёӯеӯҰеҢ–еӯҰж•ҷжқҗдёӯеёёи§Ғзү©иҙЁгҖӮе…¶дёӯпјҢBгҖҒEдёәйҮ‘еұһеҚ•иҙЁпјҢDдёәж°”дҪ“гҖӮеҸҚеә”в‘ в‘ЎжҳҜзҪ®жҚўеҸҚеә”пјҢеҸҚеә”в‘ в‘Ўв‘ўеқҮеңЁй«ҳжё©дёӢиҝӣиЎҢгҖӮAдёәеёёжё©дёӢжңҖеёёи§Ғзҡ„ж¶ІдҪ“пјҢCжңүзЈҒжҖ§пјҢEгҖҒFж—ўиғҪжә¶дәҺNaOHеҸҲиғҪжә¶дәҺHClгҖӮ
пјҲ1пјүCзҡ„дҝ—еҗҚВ В В В В В В В В В В В пјҢEдёҺи¶ійҮҸзӣҗй…ёеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸВ В В В В В В В В В В В В В В В пјӣ пјҲ2пјүеҸҚеә”в‘ўеҢ–еӯҰж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В пјӣEеҠ е…ҘNaOHжә¶ж¶ІдёӯеҸҚеә”зҡ„зҰ»еӯҗеҸҚеә”ж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В пјӣ пјҲ3пјүжЈҖйӘҢGжә¶ж¶ІдёӯйҮ‘еұһйҳізҰ»еӯҗзҡ„ж–№жі•____________________________________________пјӣ пјҲ4пјүFдёҺж°ўж°§еҢ–й’ еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
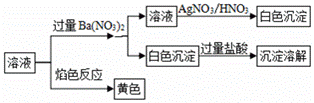
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүдә”з§ҚеҸҜжә¶жҖ§зү©иҙЁAгҖҒBгҖҒCгҖҒDгҖҒEпјҢе®ғ们жүҖеҗ«зҡ„йҳҙгҖҒйҳізҰ»еӯҗдә’дёҚзӣёеҗҢпјҢеҲҶеҲ«еҗ«жңүдә”з§ҚйҳізҰ»еӯҗK+гҖҒFe3+гҖҒCu2+гҖҒBa2+гҖҒAl3+е’Ңдә”з§ҚйҳҙзҰ»еӯҗClп№ЈгҖҒOHп№ЈгҖҒNO3п№ЈгҖҒCO32п№ЈгҖҒXдёӯзҡ„дёҖз§ҚгҖӮ пјҲ1пјүжҹҗеҗҢеӯҰйҖҡиҝҮжҜ”иҫғеҲҶжһҗпјҢи®Өдёәж— йңҖжЈҖйӘҢе°ұеҸҜеҲӨж–ӯе…¶дёӯеҝ…жңүзҡ„дёӨз§Қзү©иҙЁжҳҜ________е’Ң ________гҖӮ пјҲ2пјүзү©иҙЁCдёӯеҗ«жңүзҰ»еӯҗXгҖӮдёәдәҶзЎ®е®ҡXпјҢзҺ°е°ҶпјҲ1пјүдёӯзҡ„дёӨз§Қзү©иҙЁи®°дёәAе’ҢBпјҢеҪ“CдёҺAзҡ„жә¶ж¶Іж··еҗҲж—¶пјҢдә§з”ҹи“қиүІжІүж·ҖпјҢеҗ‘иҜҘжІүж·Җдёӯж»ҙе…ҘзЁҖHNO3пјҢжІүж·ҖйғЁеҲҶжә¶и§ЈпјҢеү©дҪҷзҷҪиүІеӣәдҪ“пјҢеҲҷXдёә________пјҲеЎ«еәҸеҸ·пјүгҖӮ A.Brп№ЈВ В В В В В B.SO42п№ЈВ В В В C.CH3COOп№ЈВ В В В В В В В D.HCO3п№Ј пјҲ3пјүе°Ҷ19.2gCuжҠ•е…ҘиЈ…жңүи¶ійҮҸDжә¶ж¶Ізҡ„иҜ•з®ЎдёӯпјҢCuдёҚжә¶и§ЈпјҢеҶҚж»ҙеҠ зЁҖH2SO4пјҢCuйҖҗжёҗжә¶и§ЈпјҢз®ЎеҸЈйҷ„иҝ‘жңүзәўжЈ•иүІж°”дҪ“еҮәзҺ°пјҢеҶҷеҮәCuжә¶и§Јзҡ„зҰ»еӯҗж–№зЁӢејҸ________________________гҖӮ иӢҘиҰҒе°ҶCuе®Ңе…Ёжә¶и§ЈпјҢиҮіе°‘еҠ е…ҘH2SO4зҡ„зү©иҙЁзҡ„йҮҸжҳҜ________гҖӮ пјҲ4пјүEжә¶ж¶ІиғҪдҪҝKI-ж·ҖзІүиҜ•зәёеҸҳи“қпјҢиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә________________________гҖӮ
|
|
| 26. | иҜҰз»ҶдҝЎжҒҜ |
|
з»ҝзҹҫжҳҜеҗ«жңүдёҖе®ҡйҮҸз»“жҷ¶ж°ҙзҡ„зЎ«й…ёдәҡй“ҒпјҢеңЁе·ҘеҶңдёҡз”ҹдә§дёӯе…·жңүйҮҚиҰҒзҡ„з”ЁйҖ”гҖӮжҹҗеҢ–еӯҰе…ҙи¶Је°Ҹз»„еҜ№з»ҝзҹҫзҡ„дёҖдәӣжҖ§иҙЁиҝӣиЎҢжҺўз©¶гҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүеңЁиҜ•з®ЎдёӯеҠ е…Ҙе°‘йҮҸз»ҝзҹҫж ·е“ҒпјҢеҠ ж°ҙжә¶и§ЈпјҢж»ҙеҠ KSCNжә¶ж¶ІпјҢжә¶ж¶ІйўңиүІж— жҳҺжҳҫеҸҳеҢ–гҖӮеҶҚеҗ‘иҜ•з®ЎдёӯйҖҡе…Ҙз©әж°”пјҢжә¶ж¶ІйҖҗжёҗеҸҳзәўгҖӮеҶҷеҮәиҜҘиҝҮзЁӢзҡ„жүҖжңүзҰ»еӯҗеҸҚеә”ж–№зЁӢејҸпјҡ _____________________________________________________________________гҖӮ пјҲ2пјүдёәжөӢе®ҡз»ҝзҹҫдёӯз»“жҷ¶ж°ҙеҗ«йҮҸпјҢе°ҶзҹіиӢұзҺ»з’ғз®ЎпјҲеёҰдёӨз«ҜејҖе…іK1е’ҢK2пјүпјҲи®ҫдёәиЈ…зҪ®Aпјүз§°йҮҚпјҢи®°дёәm1 gгҖӮе°Ҷж ·е“ҒиЈ…е…ҘзҹіиӢұзҺ»з’ғз®ЎдёӯпјҢеҶҚж¬Ўе°ҶиЈ…зҪ®Aз§°йҮҚпјҢи®°дёә m2 gгҖӮжҢүдёӢеӣҫиҝһжҺҘеҘҪиЈ…зҪ®иҝӣиЎҢе®һйӘҢгҖӮ
в‘ д»ӘеҷЁBзҡ„еҗҚз§°жҳҜ______________гҖӮ в‘Ўе°ҶдёӢеҲ—е®һйӘҢж“ҚдҪңжӯҘйӘӨжӯЈзЎ®жҺ’еәҸ______________пјҲеЎ«ж ҮеҸ·пјүпјӣйҮҚеӨҚдёҠиҝ°ж“ҚдҪңжӯҘйӘӨпјҢзӣҙиҮіAжҒ’йҮҚпјҢи®°дёәm3 gгҖӮ a.зӮ№зҮғй…’зІҫзҒҜпјҢеҠ зғӯ b.зҶ„зҒӯй…’зІҫзҒҜ c.е…ій—ӯK1е’ҢK2 d.жү“ејҖK1е’ҢK2пјҢзј“зј“йҖҡе…ҘN2 e.з§°йҮҸAВ В В В f.еҶ·еҚҙиҮіе®Өжё© в‘ўж №жҚ®е®һйӘҢи®°еҪ•пјҢи®Ўз®—з»ҝзҹҫеҢ–еӯҰејҸдёӯз»“жҷ¶ж°ҙж•°зӣ®x=_______________гҖӮпјҲеҲ—ејҸиЎЁзӨәпјүпјҺиӢҘе®һйӘҢж—¶жҢүaгҖҒdж¬ЎеәҸж“ҚдҪңпјҢеҲҷдҪҝx__________пјҲеЎ«вҖңеҒҸеӨ§вҖқвҖңеҒҸе°ҸвҖқжҲ–вҖңж— еҪұе“ҚвҖқпјүгҖӮ пјҲ3пјүжөӢе®ҡзЎ«й…ёдәҡй“Ғзҡ„еҲҶи§Јдә§зү©еҸ‘зҺ°пјҡдёҖз§Қдә§зү©дёәзәўжЈ•иүІеӣәдҪ“пјҢеҸҰеӨ–дёӨз§Қдә§зү©дёәж°”дҪ“пјҢеҸҚеә”дә§зү©дёӯж°§еҢ–дә§зү©дёҺиҝҳеҺҹдә§зү©зҡ„зү©иҙЁзҡ„йҮҸзӣёзӯүпјҢеҶҷеҮәиҜҘиҝҮзЁӢзҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ______________ ___________________________________________гҖӮ
|
|
- еҶ…и’ҷеҸӨ2018е№ҙй«ҳдәҢеҢ–еӯҰдёҠеҚҠжңҹжңҹдёӯиҖғиҜ•еёҰеҸӮиҖғзӯ”жЎҲдёҺи§Јжһҗ
- 2018-2019е№ҙй«ҳдәҢдёҠеҶҢжңҹжң«иҖғиҜ•еҢ–еӯҰйўҳејҖеҚ·жңүзӣҠпјҲзҰҸе»әзңҒжіүе·һеёӮжіүжёҜеҢә第дёҖдёӯеӯҰпјү
- йҹ¶е…іеёӮеҗҢжӯҘз»ғд№
- жӣІйқ–еёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•жЁЎжӢҹиҖғиҜ•и®ӯз»ғ
- жұҹиӢҸиӢҸе·һеёӮ2021еұҠй«ҳдёүдёӢжңҹжңҹеҲқеӯҰдёҡиҙЁйҮҸйҳіе…үжҢҮж Үи°ғз ”еҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·
- иҙөе·һзңҒ2020е№ҙжҷ®йҖҡй«ҳзӯүеӯҰж ЎжӢӣз”ҹйҖӮеә”жҖ§жөӢиҜ•зҗҶз»јеҢ–еӯҰ
- жІіеҢ—зңҒиЎЎж°ҙеёӮ第еҚҒеӣӣдёӯеӯҰ2020-2021е№ҙй«ҳдәҢдёҠеӯҰжңҹдёүи°ғиҖғиҜ•еҢ–еӯҰж— зәёиҜ•еҚ·е®Ңж•ҙзүҲ
- й«ҳдәҢдёӢеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰйўҳеҗҢжӯҘи®ӯз»ғе…Қиҙ№иҜ•еҚ·пјҲ2019-2020е№ҙжөҷжұҹзңҒиҜёжҡЁдёӯеӯҰпјү