2019иҘҝи—Ҹй«ҳдәҢдёҠеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҸҚеә”2A(g)пјӢB(g) A.дҪҺжё©гҖҒдҪҺеҺӢВ В В В В B.дҪҺжё©гҖҒй«ҳеҺӢВ В В В C.й«ҳжё©гҖҒй«ҳеҺӢВ В В В В D.й«ҳжё©гҖҒдҪҺеҺӢ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—иҝҮзЁӢжҲ–зҺ°иұЎдёҺзӣҗзұ»ж°ҙи§Јж— е…ізҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲВ В В пјү AпјҺзәҜзўұжә¶ж¶ІеҺ»жІ№жұЎВ В В В В В В В В В В В В В В В В В В В В В В В В BпјҺй“ҒеңЁжҪ®ж№ҝзҡ„зҺҜеўғдёӢз”ҹй”Ҳ CпјҺеҠ зғӯж°ҜеҢ–й“Ғжә¶ж¶ІйўңиүІеҸҳж·ұВ В В В В В В В В В В В В В В В В DпјҺжө“зЎ«еҢ–й’ жә¶ж¶ІжңүиҮӯе‘і
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
0.1mol/L HFжә¶ж¶Ізҡ„pH=2пјҢеҲҷиҜҘжә¶ж¶Ідёӯжңүе…іжө“еәҰе…ізі»ејҸдёҚжӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В пјҲВ В В пјү A.c(H+)пјһc(F-) В В B.c(HF) пјһc(H+)В В В В В В В В C.c(OH-)пјһc(HF)В В В В В В В D.c(HF)пјһc(F-)
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
зү©иҙЁзҡ„йҮҸжө“еәҰзӣёеҗҢзҡ„дёүз§Қй…ёHXгҖҒHYгҖҒHZзҡ„жә¶ж¶ІпјҢе…¶pHдҫқж¬Ўдёә4гҖҒ5гҖҒ6пјҢеҲҷKXгҖҒKYгҖҒKZзҡ„зўұжҖ§з”ұејәеҲ°ејұзҡ„йЎәеәҸжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲВ В В пјү В A. KZгҖҒKY гҖҒKXВ В В В В В В B.KXгҖҒ KYгҖҒKZВ В В В В В В В В C. KXгҖҒKZгҖҒKYВ В В В В В В D.KYгҖҒKZгҖҒKX
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
25в„ғж—¶пјҢеңЁеҗ«жңүеӨ§йҮҸзҡ„PbI2йҘұе’Ңжә¶ж¶ІдёӯеӯҳеңЁе№іиЎЎпјҡPbI2(s) AпјҺжә¶ж¶ІдёӯPb2+е’ҢIпјҚжө“еәҰйғҪеўһеӨ§В В В В В В В В В В В В В В В В BпјҺжә¶еәҰз§Ҝеёёж•°KspеўһеӨ§ CпјҺжІүж·Җжә¶и§Је№іиЎЎеҗ‘йҖҶеҗ‘移еҠЁВ В В В В В В В В В В В В В В В В В DпјҺPbI2зҡ„жә¶и§ЈеәҰдёҚеҸҳ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘ450в„ғж—¶пјҢеҸҚеә”H2(g)пјӢI2(g)В =В 2HI(g)зҡ„Kпјқ50пјҢз”ұжӯӨжҺЁжөӢеңЁ450в„ғж—¶пјҢеҸҚеә” 2HI(g)В В =В В H2(g)пјӢI2(g)зҡ„еҢ–еӯҰе№іиЎЎеёёж•°дёәВ В В В В В В В В В В В В В В В В В В В В В В В В В пјҲВ В В пјү AпјҺ50В В В В В В В В В BпјҺ0.02В В В В В В В В В CпјҺ100В В В В В В В DпјҺж— жі•зЎ®е®ҡВ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
pH=aжҹҗз”өи§ЈиҙЁжә¶ж¶ІдёӯпјҢжҸ’е…ҘдёӨж”Ҝжғ°жҖ§з”өжһҒйҖҡзӣҙжөҒз”өдёҖж®өж—¶й—ҙеҗҺпјҢжә¶ж¶Ізҡ„pHпјңaпјҢеҲҷиҜҘз”өи§ЈиҙЁеҸҜиғҪжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲВ В В пјү В A.Ba(OH)2В В В В В В В В В В В B.HВӯClВ В В В В В В В В В В В В В В В В C.Na2SO4В В В В В В В В В В В В В D.AgNO3
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
В 25oCж—¶иӢҘдҪ“з§ҜдёәVaпјҢpH=aзҡ„жҹҗдёҖе…ғејәй…ёдёҺдҪ“з§ҜдёәVb, pH=bзҡ„жҹҗдёҖе…ғејәзўұж··еҗҲпјҢжҒ°еҘҪдёӯе’ҢпјҢдё”е·ІзҹҘVaпјңVbе’Ңa=0.5bпјҢеҲҷдёӢеҲ—з¬ҰеҗҲaеҖјзҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲВ В В пјү A.3В В В В В В В В В В В В В В В В В В B.4В В В В В В В В В В В В В В В В В C.5В В В В В В В В В В В В В В В В В D.6
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—еҗ„зҰ»еӯҗж–№зЁӢејҸдёӯпјҢдёҚеұһдәҺж°ҙи§ЈеҸҚеә”зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲВ В В пјү В AпјҺHCO3п№Ј+H2OвҮҢH3O++CO32п№ЈВ В В В В В В В В В В В В В В В В В В BпјҺNH4++H2OвҮҢNH3вҖўH2O+H+ В CпјҺPO43п№Ј+H2Oв•җHPO42п№Ј+OHп№ЈВ В В В В В В В В В В В В В В В В В D.NH3+H2OвҮҢNH4++OHп№Ј
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
жҠҠеҲҶеҲ«зӣӣжңүзҶ”иһҚзҡ„ж°ҜеҢ–й’ гҖҒж°ҜеҢ–й•ҒгҖҒж°§еҢ–й“қзҡ„дёүдёӘз”өи§Јж§ҪдёІиҒ”пјҢеңЁдёҖе®ҡжқЎд»¶дёӢйҖҡз”өдёҖж®өж—¶й—ҙеҗҺпјҢжһҗеҮәй’ гҖҒй•ҒгҖҒй“қзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲВ В В пјү A.1пё°2пё°3В В В В В В В В B.3пё°2пё°1В В В В В В В В C.6пё°3пё°1В В В В В В В В В D.6пё°3пё°2
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
жҠҠ0.2mol/L NH4Clжә¶ж¶ІдёҺ0.1mol/L NaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲеҗҺжә¶ж¶ІдёӯдёӢеҲ—еҫ®зІ’зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰзҡ„е…ізі»жӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (В В В В ) AпјҺcпјҲNH4+пјүпјһcпјҲNa+пјүпјһcпјҲNH3вҖўH2OпјүпјһcпјҲOHп№ЈпјүВ В BпјҺcпјҲNH4+пјүпјү=cпјҲNa+пјүпјһcпјҲNH3вҖўH2OпјүпјһcпјҲOHп№Јпјү CпјҺcпјҲNH4+пјүпјүпјһcпјҲNa+пјүпјһcпјҲOHп№ЈпјүпјһcпјҲNH3вҖўH2Oпјү D. cпјҲNH4+пјү=cпјҲNa+пјү=cпјҲOHп№ЈпјүпјһcпјҲNH3вҖўH2Oпјү
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||
|
жҹҗж··еҗҲжә¶ж¶ІдёӯжүҖеҗ«зҰ»еӯҗзҡ„жө“еәҰеҰӮдёӢиЎЁпјҢеҲҷMзҰ»еҸҜиғҪдёәВ В В В В В В В В В В В В В В В В В В В пјҲВ В В пјү
В AпјҺClпјҚВ В В В В В В В В В В BпјҺBa2+В В В В В В В В В В В CпјҺFпјҚВ В В В В В В В В В В В В В DпјҺMg2+
|
|||||||||||
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
250oCпјҢ101Kpaж—¶пјҢ2N2O5(g)= 4NO2(g)+ O2(g)В в–іH=+56.76kJ/molпјҢиҜҘеҸҚеә”иғҪиҮӘеҸ‘иҝӣиЎҢпјҢе…¶иҮӘеҸ‘иҝӣиЎҢзҡ„дё»иҰҒеҺҹеӣ жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲВ В В пјү AпјҺжҳҜеҗёзғӯеҸҚеә”В В В В BпјҺжҳҜж”ҫзғӯеҸҚеә”В В В В CпјҺжҳҜзҶөеҮҸеҸҚеә”В В В В В В DпјҺзҶөеўһж•Ҳеә”еӨ§дәҺиғҪйҮҸж•Ҳеә”
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
еҸҚеә”2XпјҲgпјү+YпјҲgпјү AпјҺT1<T2пјҢP1<P2В В В В В В В В В В В В В В BпјҺT1<T2пјҢP1>P2В В В В CпјҺT1>T2пјҢP1>P2В В В В В В В В В В В В В В DпјҺT1>T2пјҢP1<P2
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёүдёӘзғ§жқҜдёӯеҲҶеҲ«зӣӣжңүжө·ж°ҙпјҢдҫқж¬ЎжҸ’е…ҘпјҲ1пјүй“ҒзүҮпјӣпјҲ2пјүеҜјзәҝзӣёиҝһзҡ„й“ңгҖҒй“ҒзүҮпјӣ(3)еҜјзәҝзӣёиҝһзҡ„й”ҢгҖҒй“ҒзүҮгҖҒй“ҒеңЁе…¶дёӯиў«и…җиҡҖж—¶з”ұеҝ«еҲ°ж…ўзҡ„йЎәеәҸжҳҜВ В В В В В В В В В В В В В В В В В В пјҲВ В В пјү В A. (2)(1)(3) В В В В В В В В B.(2)(3)(1)В В В В C. (1)(2)(3)В В В В В В В В D.(3) (2)(1)
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
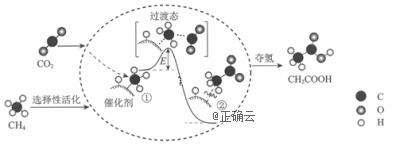
жҲ‘еӣҪз§‘з ”дәәе‘ҳжҸҗеҮәдәҶз”ұCO2е’ҢCH4иҪ¬еҢ–дёәй«ҳйҷ„еҠ еҖјдә§е“ҒCH3COOHзҡ„еӮ¬еҢ–еҸҚеә”еҺҶзЁӢгҖӮиҜҘеҺҶзЁӢзӨәж„ҸеӣҫеҰӮеҸігҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜВ пјҲВ В В пјү A. в‘ вҶ’в‘Ўж”ҫеҮәиғҪйҮҸ并еҪўжҲҗдәҶCвҖ”Cй”® B. иҜҘеӮ¬еҢ–еүӮеҸҜжңүж•ҲжҸҗй«ҳеҸҚеә”зү©зҡ„е№іиЎЎиҪ¬еҢ–зҺҮ C. з”ҹжҲҗCH3COOHжҖ»еҸҚеә”зҡ„еҺҹеӯҗеҲ©з”ЁзҺҮдёә100% D. CH4вҶ’CH3COOHиҝҮзЁӢдёӯпјҢжңүCвҖ”Hй”®еҸ‘з”ҹж–ӯиЈӮ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
еңЁдҪ“з§Ҝдёә2 Lзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢе……е…Ҙ2mol CO2 е’Ң2mol H2пјҢиҝӣиЎҢеҰӮдёӢеҢ–еӯҰеҸҚеә”пјҡ CO2пјҲgпјүпјӢH2пјҲgпјү е…¶еҢ–еӯҰе№іиЎЎеёёж•°Kе’Ңжё©еәҰtзҡ„е…ізі»еҰӮдёӢиЎЁпјҡ
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүиҜҘеҸҚеә”зҡ„еҢ–еӯҰе№іиЎЎеёёж•°иЎЁиҫҫејҸдёәKпјқВ В В В В В В В В В В В пјӣ пјҲ2пјүиҜҘеҸҚеә”дёәВ В В В В В В В В В В еҸҚеә”пјҲйҖүеЎ«еҗёзғӯгҖҒж”ҫзғӯпјүпјӣ пјҲ3пјүиғҪеҲӨж–ӯиҜҘеҸҚеә”жҳҜеҗҰиҫҫеҲ°еҢ–еӯҰе№іиЎЎзҠ¶жҖҒзҡ„дҫқжҚ®жҳҜ______________пјӣ aпјҺе®№еҷЁдёӯеҺӢејәдёҚеҸҳВ В В В В В В В В В В В В В В В bпјҺж··еҗҲж°”дҪ“дёӯ cпјҲCOпјүдёҚеҸҳ cпјҺП…жӯЈпјҲH2пјүпјқП…жӯЈпјҲH2OпјүВ В В В В В В В В В dпјҺcпјҲCO2пјүпјқcпјҲCOпјү пјҲ4пјүжҹҗжё©еәҰдёӢпјҢе№іиЎЎжө“еәҰз¬ҰеҗҲдёӢејҸпјҡcпјҲCO2пјүВ·cпјҲH2пјүпјқcпјҲCOпјүВ·cпјҲH2OпјүпјҢиҜ•еҲӨж–ӯжӯӨж—¶зҡ„жё©еәҰдёә________в„ғгҖӮ
|
|||||||||||||
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
зЎ«й…ёжҳҜејәй…ёпјҢдёӯеӯҰйҳ¶ж®өе°ҶзЎ«й…ёеңЁж°ҙжә¶ж¶ІдёӯзңӢдҪңе®Ңе…Ёз”өзҰ»гҖӮдҪҶдәӢе®һжҳҜпјҢзЎ«й…ёеңЁж°ҙдёӯзҡ„第дёҖжӯҘз”өзҰ»жҳҜе®Ңе…Ёзҡ„пјҢ第дәҢжӯҘз”өзҰ»е№¶дёҚе®Ңе…ЁпјҢе…¶з”өзҰ»жғ…еҶөдёәпјҡH2SO4пјқH++HSO4-пјҢHSO4- пјҲ1пјүNa2SO4жә¶ж¶Іе‘ҲВ В В В В В В В пјҲеЎ«вҖңејұй…ёжҖ§вҖқгҖҒвҖңдёӯжҖ§вҖқжҲ–вҖңејұзўұжҖ§вҖқпјүпјӣ пјҲ2пјүеңЁ0.1 molВ·L-1зҡ„Na2SO4жә¶ж¶ІдёӯпјҢдёӢеҲ—зІ’еӯҗжө“еәҰе…ізі»ејҸжӯЈзЎ®зҡ„жҳҜВ В В В В В В пјӣпјҲеЎ«зј–еҸ·пјүВ В В В В В В В В В В aпјҺc(SO42пјҚ)пјқ0.1 molВ·L-1В В В В В В В В В В В В В В В В bпјҺc(SO42пјҚ)пјӢc(HSO4пјҚ)пјқ2 c(NaпјӢ) cпјҺc(OHпјҚ)пјқc(HпјӢ)пјӢc(HSO4пјҚ)В В В В В В В В В В В В В В В В dпјҺc(NaпјӢ)пјӢc(HпјӢ)пјқc(OHпјҚ)пјӢc(HSO4пјҚ) пјҲ3пјүе·ІзҹҘ0.1 molВ·L-1зҡ„NaHSO4жә¶ж¶Ізҡ„pH=2пјҢеҲҷ0.1 molВ·L-1зҡ„H2SO4жә¶ж¶ІдёӯSO42-зҡ„жө“еәҰ В В В В В 0.01molВ·L-1пјҲеЎ«вҖңпјһвҖқ вҖң=вҖқ жҲ–вҖңпјңвҖқпјүгҖӮ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
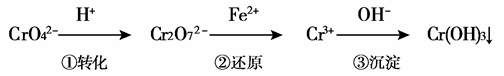
еӣһзӯ”дёӢеҲ—й—®йўҳгҖӮ пјҲдёҖпјү пјҲ1пјүеёёжё©ж—¶пјҢFeCl3 жә¶ж¶Ізҡ„pHВ В В В В 7пјҲеЎ«вҖңпјһвҖқгҖҒвҖңпјңвҖқжҲ–вҖңпјқвҖқпјүпјҢеҺҹеӣ жҳҜпјҲз”Ёж–№зЁӢејҸиЎЁиЎЁзӨәпјүВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ пјҲ2пјү25в„ғж—¶пјҢеҗ‘0.1 molВ·LпјҚ1ж°Ёж°ҙдёӯеҠ е…Ҙе°‘йҮҸNH4ClеӣәдҪ“пјҢеҪ“еӣәдҪ“жә¶и§ЈеҗҺпјҢжөӢеҫ—жә¶ж¶ІpHеҮҸе°ҸпјҢдё»иҰҒеҺҹеӣ жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ пјҲ3пјүжҹҗжә¶ж¶ІдёӯеҸӘеӯҳеңЁOHпјҚгҖҒH+гҖҒNa+гҖҒCH3COOпјҚеӣӣз§ҚзҰ»еӯҗгҖӮ в‘ иӢҘжә¶ж¶ІдёӯеҸӘжә¶и§ЈдәҶдёҖз§Қжә¶иҙЁпјҢиҝҷеӣӣз§ҚзҰ»еӯҗзҡ„жө“еәҰеӨ§е°Ҹе…ізі»дёәпјҡВ В В В В В В В В В В В В В В В В В В В В В В пјӣ в‘ЎиӢҘжә¶ж¶Ідёӯеӣӣз§ҚзҰ»еӯҗзҡ„еӨ§е°ҸйЎәеәҸдёәc(Na+)пјһc(OHпјҚ)пјһc(CH3COOпјҚ)пјһc(H+)пјҢеҲҷжә¶ж¶Ідёӯжә¶иҙЁзҡ„еҢ–еӯҰејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В пјӣ в‘ўиӢҘжә¶ж¶Ідёӯc(Na+)пјқc(CH3COOпјҚ)пјҢиҜҘжә¶ж¶Із”ұдҪ“з§Ҝзӣёзӯүзҡ„зЁҖNaOHе’ҢCH3COOHжә¶ж¶Іж··еҗҲиҖҢжҲҗпјҢеҲҷж··еҗҲеүҚc(NaOH) В В В В В В В В В В В В В В В В В В c(CH3COOH)пјҲеЎ«вҖңпјһвҖқгҖҒвҖңпјңвҖқжҲ–вҖңпјқвҖқпјүгҖӮ В пјҲдәҢпјүе·Ҙдёҡеәҹж°ҙдёӯеёёеҗ«жңүдёҖе®ҡйҮҸзҡ„Cr2O72вҖ”е’ҢCrO42вҖ”пјҢе®ғ们дјҡеҜ№дәәзұ»еҸҠз”ҹжҖҒзі»з»ҹдә§з”ҹеҫҲеӨ§зҡ„еҚұе®іпјҢеҝ…йЎ»иҝӣиЎҢеӨ„зҗҶгҖӮеёёз”Ёзҡ„еӨ„зҗҶж–№жі•жңүиҝҳеҺҹжІүж·Җжі•пјҢиҜҘжі•зҡ„е·ҘиүәжөҒзЁӢдёәпјҡ
е…¶дёӯ第①жӯҘеӯҳеңЁе№іиЎЎпјҡ2CrO42вҖ”пјҲй»„иүІпјү+2H+ пјҲ1пјүиӢҘе№іиЎЎдҪ“зі»зҡ„pH=2пјҢеҲҷжә¶ж¶ІжҳҫВ В В В В В В В В В В иүІпјӣ пјҲ2пјүиғҪиҜҙжҳҺ第①жӯҘеҸҚеә”иҫҫе№іиЎЎзҠ¶жҖҒзҡ„жҳҜВ В В В В В В В В В В В пјӣ aпјҺжә¶ж¶Ізҡ„йўңиүІдёҚеҸҳВ В bпјҺ2v (CrO42вҖ”)= v (Cr2O72вҖ”)В В В В cпјҺCr2O72вҖ”е’ҢCrO42вҖ”зҡ„жө“еәҰзӣёеҗҢ пјҲ3пјү第②жӯҘдёӯпјҢиҝҳеҺҹ1mol Cr2O72вҖ”зҰ»еӯҗпјҢйңҖиҰҒ________molзҡ„FeSO4В·7H2OгҖӮ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
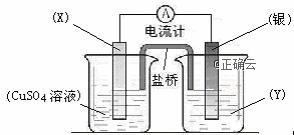
В дҫқжҚ®ж°§еҢ–иҝҳеҺҹеҸҚеә”пјҡ2Ag+пјҲaqпјү+CuпјҲsпјү
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүз”өжһҒXзҡ„жқҗж–ҷжҳҜВ В В В В В В В В В В В В В пјӣз”өи§ЈиҙЁжә¶ж¶ІYжҳҜВ В В В В В В В В В В В В В пјӣ пјҲ2пјү银з”өжһҒдёәз”өжұ зҡ„В В В В В В В В В В В В В В жһҒпјҢеҸ‘з”ҹзҡ„з”өжһҒеҸҚеә”дёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣXз”өжһҒдёҠеҸ‘з”ҹзҡ„з”өжһҒеҸҚеә”дёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ пјҲ3пјүеӨ–з”өи·Ҝдёӯзҡ„з”өеӯҗжҳҜд»ҺВ В В В В В В В В В В В В з”өжһҒжөҒеҗ‘В В В В В В В В В В В В В з”өжһҒпјӣ пјҲ4пјүеҰӮеӣҫжүҖзӨәпјҢaгҖҒbгҖҒcеқҮдёәзҹіеўЁз”өжһҒпјҢdдёәзўій’ўз”өжһҒпјҢйҖҡз”өиҝӣиЎҢз”өи§ЈгҖӮеҒҮи®ҫеңЁз”өи§ЈиҝҮзЁӢдёӯдә§з”ҹзҡ„ж°”дҪ“е…ЁйғЁйҖёеҮәпјҢеҲҷ в‘ aз”өжһҒеҸҚеә”ејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ в‘Ўд№ҷдёӯзҡ„жҖ»еҸҚеә”дёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ в‘ўиӢҘж•ҙдёӘз”өи·Ҝдёӯжңү2NA дёӘз”өеӯҗиҪ¬з§»пјҢеҲҷdз”өжһҒдә§з”ҹВ В В В В В В В В Lж°”дҪ“ пјҲж ҮеҮҶзҠ¶еҶөпјүгҖӮ
|
|
- 2018е№ҙиҮі2019е№ҙй«ҳдәҢеүҚеҚҠжңҹ第дәҢж¬ЎжңҲиҖғеҢ–еӯҰиҖғйўҳеҗҢжӯҘи®ӯз»ғпјҲжұҹиҘҝзңҒдёҠй«ҳдәҢдёӯпјү
- жҪҚеқҠеёӮ2020е№ҙй«ҳдёҖеҢ–еӯҰдёӢеӯҰжңҹжңҹдёӯиҖғиҜ•иҜ•еҚ·еёҰи§ЈжһҗеҸҠзӯ”жЎҲ
- йҮҚеәҶеёӮй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҲиҖғиҜ•еҚ·иҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- дәәж•ҷзүҲй«ҳдёҖеҝ…дҝ®з¬¬дёҖеҶҢ第дёүз« й“ҒйҮ‘еұһжқҗж–ҷ第дәҢиҠӮйҮ‘еұһжқҗж–ҷиҜҫж—¶2зү©иҙЁзҡ„йҮҸеңЁеҢ–еӯҰж–№зЁӢејҸи®Ўз®—дёӯзҡ„еә”з”Ё
- 2018е№ҙиҮі2019е№ҙй«ҳдәҢ3жңҲжңҲиҖғеҢ–еӯҰиҜ•еҚ·пјҲж–°з–Ҷд№ҢйІҒжңЁйҪҗеёӮ23дёӯеӯҰпјү
- 2019-2020е№ҙй«ҳдёҖдёӢеҶҢе…ҘеӯҰиҖғиҜ•еҢ–еӯҰиҜ•еҚ·пјҲжІіеҚ—зңҒжҙӣйҳіеёӮе®ңйҳідёҖй«ҳпјү
- еұұиҘҝй«ҳдёҖеҢ–еӯҰжңҲиҖғжөӢйӘҢпјҲ2018е№ҙдёӢеҚҠжңҹпјүеңЁзәҝеҒҡйўҳ
- жҲҗйғҪеёӮй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҲиҖғиҜ•еҚ·иҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ