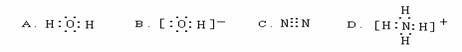2017й«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹдёӯиҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
19дё–зәӘдёӯеҸ¶пјҢй—ЁжҚ·еҲ—еӨ«зҡ„зӘҒеҮәиҙЎзҢ®жҳҜпјҲВ В пјү В A.жҸҗеҮәеҺҹеӯҗеӯҰиҜҙВ В В В В В В В В B.еҸ‘зҺ°е…ғзҙ е‘ЁжңҹеҫӢ В C.жҸҗеҮәеҲҶеӯҗеӯҰиҜҙВ В В В В В В В В В D.еҸ‘зҺ°ж°§ж°”
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҝҮзЁӢдёӯпјҢжҠҠеҢ–еӯҰиғҪиҪ¬еҢ–дёәзғӯиғҪзҡ„жҳҜпјҲВ В пјү AпјҺйЈҺеҠӣеҸ‘з”өВ В В В BпјҺе№Із”өжұ дә§з”ҹз”өжөҒВ В В В В CпјҺжңЁзӮӯзҮғзғ§В В В В В DпјҺз”Ёз”өеҸ–жҡ–еҷЁеҸ–жҡ–
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗйҷЁзҹідёӯеҗ«жңүеҚҠиЎ°жңҹжһҒзҹӯзҡ„й•Ғзҡ„дёҖз§Қж”ҫе°„жҖ§еҗҢдҪҚзҙ 2812Mg,иҜҘеҗҢдҪҚзҙ еҺҹеӯҗзҡ„ж ёеҶ…дёӯеӯҗж•°жҳҜпјҡпјҲВ В В В пјү AгҖҒ4В В В В В В В В BгҖҒ12В В В В В В CгҖҒ16В В В В В В DгҖҒ18
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—з”өеӯҗејҸд№ҰеҶҷй”ҷиҜҜзҡ„жҳҜ(В В В )
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еұһдәҺеҗҢдҪҚзҙ зҡ„дёҖз»„жҳҜ (В В В В ) AпјҺO2гҖҒO3 В В В В В BпјҺH2OгҖҒD2OВ В В В В CпјҺ21Hе’Ң31H В В В В В В DпјҺ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯдҪҚдәҺйҮ‘еұһе…ғзҙ е’ҢйқһйҮ‘еұһе…ғзҙ дәӨз•ҢеӨ„жңҖе®№жҳ“жүҫеҲ°зҡ„жқҗж–ҷжҳҜВ пјҲВ В пјүВ В В В В В В В В В AпјҺеҲ¶еӮ¬еҢ–еүӮзҡ„жқҗж–ҷВ В В В В В В В В В В В В BпјҺиҖҗй«ҳжё©гҖҒиҖҗи…җиҡҖзҡ„еҗҲйҮ‘жқҗж–ҷ CпјҺеҲ¶еҶңиҚҜзҡ„жқҗж–ҷВ В В В В В В В DпјҺеҚҠеҜјдҪ“жқҗж–ҷ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯпјҢдёҚеҗ«е…ұд»·й”®зҡ„жҳҜпјҲВ В В пјү пјЎпјҺNaClгҖҖВ В В В В В пјўпјҺCl2гҖҖВ В В пјЈпјҺHClгҖҖгҖҖВ В В В пјӨпјҺNaOH
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„йЎәеәҸзҡ„жҺ’еҲ—дёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү AпјҺйҮ‘еұһжҖ§пјҡNaпјңMgпјңAlВ В В В В В В В В В В В BпјҺзғӯзЁіе®ҡжҖ§пјҡHClпјһH2SпјһPH3 CпјҺй…ёжҖ§ејәејұпјҡH4SiO4пјңH3PO4пјңHClO4 В В В В В В В DпјҺеҺҹеӯҗеҚҠеҫ„еӨ§е°ҸпјҡNa>S>ClВ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
зҹӯе‘Ёжңҹе…ғзҙ XгҖҒYгҖҒZеңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®е…ізі»еҰӮеӣҫжүҖзӨәпјҢе·ІзҹҘXжңҖеӨ–еұӮз”өеӯҗж•°дёә2пјҢеҲҷдёӢеҲ—еҸҷиҝ°дёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјүВ В
BпјҺYзҡ„ж°ўеҢ–зү©еҫҲдёҚзЁіе®ҡ CпјҺXзҡ„еҚ•иҙЁжҖ§иҙЁеҫҲжҙ»жіј DпјҺYзҡ„ж°ўеҢ–зү©зЁіе®ҡжҖ§еӨ§дәҺZзҡ„ж°ўеҢ–зү©зЁіе®ҡжҖ§
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
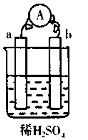
дёӢеҲ—еӣӣж”ҜиҜ•з®ЎдёӯпјҢеңЁдёҚеҗҢжқЎд»¶дёӢеҸҚеә”пјҡFe + 2HCl = FeCl2 + H2вҶ‘ еҲӨж–ӯдә§з”ҹH2зҡ„еҸҚеә”йҖҹзҺҮжңҖеҝ«зҡ„жҳҜпјҲВ В В В пјү
|
|||||||||||||||||||||
| 11. | иҜҰз»ҶдҝЎжҒҜ | |||
|
дёӢеҲ—еҗ„иЈ…зҪ®дёӯпјҢдёҚиғҪжһ„жҲҗеҺҹз”өжұ зҡ„жҳҜ(з”өи§ЈиҙЁйғҪдёәзЁҖзЎ«й…ё)В В В В В В В В В В В
AВ В В В В В В В В В В В В В В BВ В В В В В В В В В В В В В CВ В В В В В В В В В В В В В В В В В D
|
||||
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҺи®ҫ AпјҺv(йҖҶ)пјһv(жӯЈ)В В В В В В В В В В В В В В В В В BпјҺv(йҖҶ)пјңv(жӯЈ) CпјҺV(йҖҶпјқV(жӯЈ)пјҢжӯЈйҖҶеҸҚеә”еҒңжӯўВ В В DпјҺv(йҖҶ)пјқv(жӯЈ)пјҢжӯЈйҖҶеҸҚеә”д»ҚиҝӣиЎҢ
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺй“ңпјҚй”ҢпјҚзЁҖзЎ«й…ёжһ„жҲҗзҡ„еҺҹз”өжұ зҡ„жңүе…іеҸҷиҝ°пјҢй”ҷиҜҜзҡ„жҳҜ(В В ) A.й”ҢдёәиҙҹжһҒпјҢй”ҢеҸ‘з”ҹж°§еҢ–еҸҚеә”В В В В В В В В B.й“ңдёәжӯЈжһҒпјҢ В В В C.иҙҹжһҒеҸ‘з”ҹиҝҳеҺҹеҸҚеә”пјҢжӯЈжһҒеҸ‘з”ҹж°§еҢ–еҸҚеә” D.еӨ–з”өи·Ҝз”өеӯҗжөҒе…Ҙзҡ„дёҖжһҒдёәжӯЈжһҒпјҢз”өеӯҗжөҒеҮәзҡ„дёҖжһҒдёәиҙҹжһҒ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ідәҺжӯӨиЈ…зҪ®зҡ„еҗ„з§ҚеҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү AпјҺзўіжЈ’дёҠжңүж°”дҪ“ж”ҫеҮәпјҢжә¶ж¶Ій…ёжҖ§еҸҳејұВ В В В В В В В В В В В В В В В В В В В В BпјҺaжҳҜжӯЈжһҒпјҢbжҳҜиҙҹжһҒВ В В В В В В В В В В В В В В В CпјҺеҜјзәҝдёӯжңүз”өеӯҗжөҒеҠЁпјҢз”өжөҒд»ҺaжһҒеҲ°bжһҒ DпјҺaжһҒдёҠеҸ‘з”ҹдәҶиҝҳеҺҹеҸҚеә”
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
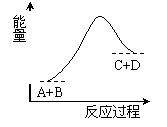
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В В ) AпјҺиҜҘеҸҚеә”дёәж”ҫзғӯеҸҚеә”В BпјҺиҜҘеҸҚеә”дёәеҗёзғӯеҸҚеә” CпјҺеҸҚеә”зү©зҡ„жҖ»иғҪйҮҸй«ҳдәҺз”ҹжҲҗзү©зҡ„жҖ»иғҪйҮҸ DпјҺиҜҘеҸҚеә”еҸӘжңүеңЁеҠ зғӯжқЎд»¶дёӢжүҚиғҪиҝӣиЎҢ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ | ||||||
|
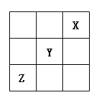
еҸіеӣҫжҳҜе‘ЁжңҹиЎЁдёӯзҹӯе‘Ёжңҹзҡ„дёҖйғЁеҲҶгҖӮиӢҘXеҺҹеӯҗжңҖеӨ–еұӮз”өеӯҗж•°жҜ”ж¬ЎеӨ–еұӮз”өеӯҗж•°е°‘3дёӘпјҢеҲҷдёӢеҲ—иҜҙжі•дёӯдёҚжӯЈзЎ®зҡ„жҳҜ(В В )
AпјҺеҺҹеӯҗеҚҠеҫ„зҡ„еӨ§е°ҸйЎәеәҸжҳҜZ>Y>X>W BпјҺZзҡ„ж°”жҖҒж°ўеҢ–зү©жҜ”Xзҡ„ж°”жҖҒж°ўеҢ–зү©зЁіе®ҡ CпјҺXгҖҒYгҖҒZеҗ„е…ғзҙ жңҖй«ҳд»·е’ҢжңҖдҪҺд»·зҡ„з»қеҜ№еҖјд№Ӣе’Ңдёә8 DпјҺXгҖҒYгҖҒZжңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©зҡ„й…ёжҖ§ејәејұе…ізі»Z>Y>X
|
|||||||
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺеҚӨзҙ еҸҠе…¶еҢ–еҗҲзү©зҡ„еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜ (В В )В В В В A. йқһйҮ‘еұһжҖ§пјҡFпјһClпјһBrпјһIВ В В В В В В В В В В В В В B. еҚ•иҙЁж°§еҢ–жҖ§пјҡF2пјһCl2пјһBr2пјһI2 C. ж°ўеҢ–зү©зЁіе®ҡжҖ§пјҡHFпјһHClпјһHBrпјһHIВ В В В В D. жІёзӮ№пјҡF2пјһCl2пјһBr2пјһI2
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ідәҺ第дёүе‘Ёжңҹе…ғзҙ жҖ§иҙЁзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү A.й•ҒеҚ•иҙЁиғҪе’ҢеҶ·ж°ҙеҸ‘з”ҹеү§зғҲзҡ„еҸҚеә”В В В B.зўұжҖ§MgпјҲOHпјү2<AlпјҲOHпјү3 C.зЁіе®ҡжҖ§SiH4пјңHClВ В В В В В В В В В В В В В D.йҮ‘еұһжҖ§NaпјңMg
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖе®ҡжқЎд»¶дёӢе°Ҷ0.1 mol N2е’Ң0.3 mol H2зҪ®дәҺеҜҶй—ӯе®№еҷЁдёӯеҸ‘з”ҹеҸҚеә”пјҡ N2пјӢ3H2 AпјҺжңҖз»ҲеҸҜз”ҹжҲҗ0.2 mol NH3В В В В В В В В В В В BпјҺеҺӢзј©дҪ“з§ҜпјҢеўһеӨ§еҺӢејәиғҪдҪҝеҸҚеә”йҖҹзҺҮеҮҸе°Ҹ CпјҺйҷҚдҪҺеҸҚеә”дҪ“зі»зҡ„жё©еәҰиғҪеҠ еҝ«еҸҚеә”йҖҹзҺҮВ DпјҺе®№еҷЁдҪ“з§ҜдёҚеҸҳпјҢеҗ‘е®№еҷЁдёӯеҶҚеҠ е…ҘN2пјҢиғҪеҠ еҝ«еҸҚеә”йҖҹзҺҮ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еӣӣдёӘж•°жҚ®жҳҜеңЁдёҚеҗҢжқЎд»¶дёӢжөӢеҮәзҡ„еҗҲжҲҗж°ЁеҸҚеә”N2пјӢ3H2 AпјҺV(H2)==0.1 molпјҸ(LВ·min) В В В В В В В BпјҺV(N2)==0.1molпјҸ(LВ·min) CпјҺV(NH3)==0.15molпјҸ(LВ·min) В В В В В DпјҺ V(N2)==0.002molпјҸ(LВ·min)
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ёз”өеӯҗејҸиЎЁзӨәдёӢеҲ—иҝҮзЁӢпјҡ в‘ В В В В KClзҡ„еҪўжҲҗиҝҮзЁӢ__________________________________________ в‘Ў H2Oзҡ„еҪўжҲҗиҝҮзЁӢ____________________________________________
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ҘдёҡеҗҲжҲҗж°ЁжҳҜеҲ©з”Ёж°®ж°”е’Ңж°ўж°”еңЁдёҖе®ҡжқЎд»¶дёӢеҸҚеә”з”ҹжҲҗзҡ„гҖӮж°ЁжҳҜйҮҚиҰҒзҡ„е·ҘдёҡеҺҹж–ҷгҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүж°®е…ғзҙ еңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®жҳҜ第      周жңҹ第      ж—Ҹпјӣж°®еҺҹеӯҗз»“жһ„зӨәж„Ҹеӣҫдёә________________пјӣ пјҲ2пјүеҶҷеҮәж°ЁеҲҶеӯҗзҡ„з”өеӯҗејҸ______пјӣжҢҮеҮәеҲҶеӯҗдёӯеҢ–еӯҰй”®жҳҜ_____(еЎ«вҖҳзҰ»еӯҗй”®вҖҷжҲ–вҖҳе…ұд»·й”®вҖҷ)гҖӮ пјҲ3пјүеҶҷжҲҗеҗҲжҲҗж°Ёзҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ________________________пјӣиҜҘеҸҚеә”жҳҜж”ҫзғӯеҸҚеә”пјҢеҲҷзӣёеҗҢжқЎд»¶дёӢвҖң1molN2е’Ң3molH2вҖқзҡ„иғҪйҮҸдёҺвҖң2molNH3вҖқзҡ„иғҪйҮҸиҫғй«ҳзҡ„жҳҜ________________пјӣ
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||||||||||||||||||
|
дёӢиЎЁжҳҜе…ғзҙ е‘ЁжңҹиЎЁзҡ„дёҖйғЁеҲҶпјҢиҜ·еӣһзӯ”жңүе…ій—®йўҳпјҡ
пјҲ1пјүиЎЁдёӯв‘ҘдёҺв‘ЁдёҺеҪўжҲҗзҡ„еҢ–еҗҲзү©дёә гҖҖгҖҖгҖҖгҖҖеҢ–еҗҲзү©гҖӮпјҲеЎ«вҖңзҰ»еӯҗвҖқжҲ–вҖңе…ұд»·вҖқпјүгҖҖ
|
||||||||||||||||||||||||||||||||||||||
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
д»»дҪ•дёҖдёӘиҮӘеҸ‘зҡ„ж°§еҢ–иҝҳеҺҹеҸҚеә”йғҪеҸҜд»Ҙи®ҫи®ЎжҲҗдёҖдёӘеҺҹз”өжұ гҖӮиҜ·ж №жҚ®: В Fe+CuSO4== Cu+FeSO4и®ҫи®ЎжҲҗдёҖдёӘеҺҹз”өжұ гҖӮ пјҲ1пјүиҜҘз”өжұ зҡ„иҙҹжһҒжқҗж–ҷдёә______пјҢпјҲ2еҲҶпјүе…¶з”өжһҒеҸҚеә”дёә__________пјӣпјҲ2еҲҶпјү пјҲ2пјүжӯЈжһҒжқҗж–ҷдёә_____пјҲ2еҲҶпјүпјҢз”өи§ЈиҙЁжә¶ж¶ІдёәВ В В В пјҲ2еҲҶпјүе…¶з”өжһҒеҸҚеә”дёә___________________________гҖӮпјҲ2еҲҶпјү пјҲ3пјүз”»еҮәиЈ…зҪ®зҡ„з®ҖеӣҫпјҢ并注жҳҺжӯЈиҙҹжһҒе’Ңз”өи§ЈиҙЁпјҲ3еҲҶпјү
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁеҜҶй—ӯе®№еҷЁдёӯйҖҡе…Ҙa mol H2е’Ңb molВ I2(g)пјҢеҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡH2пјҲgпјү+ I2(g)===2HIж”№еҸҳдёӢеҲ—жқЎд»¶пјҢеҸҚеә”йҖҹзҺҮе°ҶеҰӮдҪ•ж”№еҸҳпјҹ(еЎ«еўһеӨ§гҖҒеҮҸе°ҸгҖҒжҲ–дёҚеҸҳпјү пјҲ1пјүеҚҮй«ҳжё©еәҰ ______ пјӣпјҲ2пјүеҠ е…ҘжӯЈеӮ¬еҢ–еүӮ _______ пјӣ пјҲ3пјүдҪ“з§ҜдёҚеҸҳе……е…ҘжӣҙеӨҡзҡ„H2 ________пјӣ пјҲ4пјүжү©еӨ§е®№еҷЁзҡ„дҪ“з§Ҝ _______пјӣпјҲ5пјүе®№еҷЁдҪ“з§ҜдёҚеҸҳпјҢйҖҡе…Ҙж°–ж°” ________пјӣ гҖҖ |
|
| 26. | иҜҰз»ҶдҝЎжҒҜ | ||
|
Г—100%пјү Yзҡ„иө·е§ӢйҮҸВ В
|
|||
- жІіеҚ—зңҒе‘ЁеҸЈдёӯиӢұж–ҮеӯҰж Ў2020еұҠй«ҳдёүеүҚеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ
- ж№–еҢ—зңҒе®ңжҳҢеёӮи‘ӣжҙІеққдёӯеӯҰ2021еұҠй«ҳдёү9жңҲжңҲиҖғеҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·еңЁзәҝжЈҖжөӢ
- еҗүжһ—2019е№ҙй«ҳдёүеҢ–еӯҰеүҚеҚҠжңҹеңЁзәҝе…Қиҙ№иҖғиҜ•
- 2019еұҠй«ҳдёүдёҠеҶҢ12жңҲжңҲиҖғеҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·пјҲеұұдёңзңҒеҫ®еұұеҺҝдёҖдёӯпјү
- дҪӣеұұеёӮй«ҳдәҢеҢ–еӯҰ2019е№ҙдёҠеӯҰжңҹжңҲиҖғжөӢйӘҢе®Ңж•ҙиҜ•еҚ·
- еӨӘеҺҹеёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҲиҖғиҜ•еҚ·иҖғйўҳеҗҢжӯҘи®ӯз»ғ
- жІіжұ еёӮй«ҳдёүеҢ–еӯҰжңҲиҖғжөӢйӘҢпјҲ2018е№ҙдёҠеҚҠе№ҙпјүйҷ„зӯ”жЎҲдёҺи§Јжһҗ
- ж№–еҚ—зңҒйӮөйҳійӮөдёңеёӮ第дёҖдёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠеҚҠе№ҙ第дёүж¬ЎжңҲиҖғеҢ–еӯҰеңЁзәҝиҖғиҜ•йўҳе…Қиҙ№з»ғд№