河池市高三化学月考测验(2018年上半年)附答案与解析
| 1. 选择题 | 详细信息 |
|
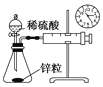
《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之.”文中涉及的操作方法是( ) A. 蒸馏 B. 干馏 C. 升华 D. 萃取 |
|
| 2. 选择题 | 详细信息 |
广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其他简单仪器组成各种功能的装置。下列各图中能用作防倒吸安全瓶的是( )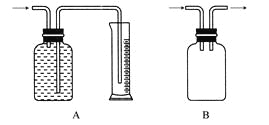 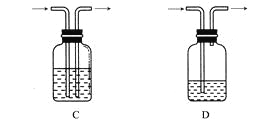 |
|
| 3. 选择题 | 详细信息 |
|
类推是中学化学中重要的思维方法。下列类推结论正确的是 A. 电解熔融NaCl制取Na,故电解熔融MgCl2也能制取Mg B. Fe与CuSO4溶液反应置换出Cu,故Na也能从CuSO4溶液中置换出Cu C. 铝和硫加热得到Al2S3,故铁和硫加热得到Fe2S3 D. 次氯酸钙溶液和CO2反应生成CaCO3和HClO,故次氯酸钙和SO2反应生CaSO3和HClO |
|
| 4. 选择题 | 详细信息 |
|
下列溶液中,溶质的物质的量浓度不是1 mol/L的是( ) A. 10 g NaOH固体溶解在水中配成250 mL溶液 B. 将80 g SO3溶于水并配成1 L的溶液 C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液 D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液 |
|
| 5. 选择题 | 详细信息 |
|
下列关于物质或离子检验的叙述正确的是 A. 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ B. 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 C. 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ D. 将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |
|
| 6. 选择题 | 详细信息 |
|
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其中c(H+)=0.1mol/L,c(Al3+)=0.4mol/L,c(SO42﹣)=0.8mol/L,则c(K+)为( ) A. 0.15 mol/L B. 0.2 mol/L C. 0.3 mol/L D. 0.4 mol/L |
|
| 7. 选择题 | 详细信息 |
如图所示1 g O2与1 g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是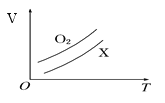 A. C2H4(气) B. CH4 C. CO2 D. NO |
|
| 8. 选择题 | 详细信息 | |||||||||||||||
下列实验设计能够达到实验目的的是
|
||||||||||||||||
| 9. 选择题 | 详细信息 |
|
下列物质不能通过化合反应生成的是 A. FeCl2 B. H2SiO3 C. CuCl2 D. Fe(OH)3 |
|
| 10. 选择题 | 详细信息 |
|
设NA代表阿伏加德罗常数的值,下列说法正确的是 A. 在标准状况下,22.4 L氨气分子所含原子总数为4NA B. 在标准状况下,11.2 L二氯甲烷含氯原子总数为2NA C. 32g氧气作氧化剂时转移电子数目一定为2NA D. 1 mol环己烷( |
|
| 11. 选择题 | 详细信息 |
|
“酸化”是实验中经常采用的方法,下列说法错误的是( ) A. 提高高锰酸钾的氧化能力——用浓盐酸酸化 B. 抑制Fe2(SO4)3的水解——用稀硫酸酸化 C. 确认溶液中含有Cl-时——先用硝酸酸化,再加Ag+检验 D. 确认溶液中含有SO |
|
| 12. 选择题 | 详细信息 |
制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是  A. ①② B. ② C. ②③ D. ②③④ |
|
| 13. 选择题 | 详细信息 |
|
下列反应的离子方程式书写正确的是 A. 将铜屑加入含Fe3+的溶液中:2Fe3++Cu=2Fe2++Cu2+ B. 将磁性氧化铁溶于盐酸中:Fe3O4+8H+=3Fe3++4H2O C. 向硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+=Fe3++4H2O D. 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
|
| 14. 选择题 | 详细信息 | ||||||||
下列图中所示的实验方法、装置或操作正确的是( )
|
|||||||||
| 15. 选择题 | 详细信息 |
|
短周期主族元素W、X、Y、Z、R 原子序数依次增大。由W、X、Y、R组成的一种化合物a在加热时完全分解为三种产物,其中一种产物b是能使品红溶液褪色的气体,另一种产物c是能使湿润的红色石蕊试纸变蓝的气体。金属单质Z在空气中燃烧生成的化合物可与水发生反应生成气体。下列说法正确的是 A. 简单离子的半径: X < Z < R B. X的简单氢化物比Y的稳定 C. a、b、c中均含有极性共价健,且 a属于电解质,b和c都属于非电解质 D. W、X、Y、R四种元素形成的化合物一定会促进水的电离 |
|
| 16. 实验题 | 详细信息 |
I. 以下是实验室常用的部分仪器,请回答下列问题: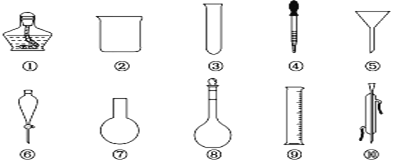 (1)序号为⑥和⑧的仪器的名称分别为__________________________。 (2)在分液操作中,必须用到上述仪器中的____________(填序号)。 (3)能作反应容器且可直接加热的仪器是上述中的____________(填名称)。 (4)配制一定物质的量浓度的溶液时要用到的仪器是________(填序号)。 (5)仪器上标有温度的有____________(填序号)。 II.(1)指出下列实验仪器和用品(已洗涤干净)使用时的第一步操作: ①淀粉碘化钾试纸检验Cl2的性质_____________________________; ②分液漏斗(分液)__________________________________________。 (2)下列有关实验的叙述中,合理的是________。 A.用碱式滴定管量取25.00 mL溴水 B.测定溶液的pH时用干燥、洁净的玻璃棒蘸取溶液,点在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较 C.圆底烧瓶、锥形瓶、烧杯加热时都应垫上石棉网 D.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高 E.滴定用的锥形瓶和滴定管都要用所盛溶液润洗 F.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸 G.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
|
| 17. 实验题 | 详细信息 |
|
I.某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10 mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案: 方案①:A中加入少量KMnO4溶液,溶液紫红色褪去, 方案②:B中加入KSCN溶液,溶液不变血红色,再加入新制的氯水,溶液变血红。 方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。 (1)上述实验方案中能证明该反应液有Fe2+生成的是_____________。 Ⅱ.氨气具有还原性,在加热时与氧化铜发生反应的化学方程式为:2NH3+3CuO 某化学实验小组拟用下列仪器(可重复使用)证明氨气具有还原性,并检验生成的水。现提供浓氨水、氧化铜,若需其他试剂可自选。(连接和固定仪器用的胶管、铁夹、铁架台等装置均略去),请回答下列问题: 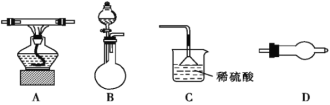 (2)上述仪器从左到右的连接顺序是__→D→__→D→__(填字母)。____________ (3)烧瓶中加入的固体试剂可以是___。 ①生石灰 ②五氧化二磷 ③硫酸铜 ④氢氧化钠 (4)装置C中倒扣漏斗的作用是__________________。 (5)需重复使用的仪器D中所选用的固体药品依次是_____。 (6)实验中证明有水生成的现象是_______________________________ |
|
| 18. 综合题 | 详细信息 |
某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)22SO4的工艺流程: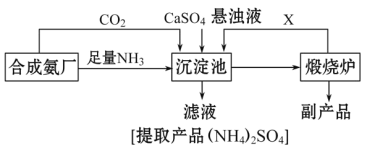 请回答以下问题: (1)工业合成氨反应的条件是_____________________。沉淀池中发生的主要反应方程式是________________________。该反应能够发生的原因是__________________________。 (2)提纯滤液以获得(NH4)2SO4晶体,必要的操作步骤是:__________(填序号)。 A.萃取 B.蒸发浓缩 C.冷却结晶 D.蒸馏 (3)上述生产流程中,有关NH3的作用及说明正确的是:__________(填序号)。 A.提供制备所需的氮元素 B.增大CO32-的浓度促进反应发生 C.作反应的催化剂 D.生产1 mol (NH4)2SO4,至少消耗2 mol NH3 (4)该生产过程中的副产品是_______________,从绿色化学和资源综合利用的角度说明上述流程的主要优点是______________.缺点是_____________。 |
|
| 19. 综合题 | 详细信息 |
|
前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子。回答下列问题: (1)元素电负性:D____E (填>、<或=); (2)B、C单质熔点B_____C(填>、<或=); (3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_____________; (4)氢化物的沸点:B比D高的原因______________; (5)F的核外电子排布式为____________________________;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出深蓝色晶体,该晶体的化学式为_______,其中关于该晶体下列说法中正确的是_____________________。 A.加入乙醇的目的是降低溶剂的极性,促使晶体析出 B.F与NH3之间的化学键为离子键 C.该配合物晶体中,N是配位原子,NH3为三角锥型 D.配离子内N原子排列成为平面正方形,则其中F离子是sp3杂化 E.向该晶体的水溶液中加入浓BaCl2溶液有白色沉淀生成 (6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元为立方体,结构如图所示。该晶体中每个Xn-被________个等距离的C+离子包围。已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,CnX的摩尔质量为M g/mol,C+和Xn-间的最短距离是_____________nm。(列出计算式即可) 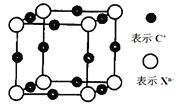 |
|
| 20. 综合题 | 详细信息 |
医用麻醉药苄佐卡因E和食品防腐剂J的合成路线如下: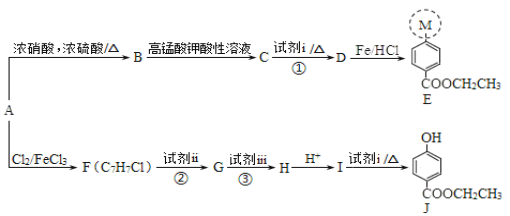 已知:I.M代表E分子结构中的一部分 II. 请回答下列问题: (1)A属于芳香烃,分子式为C7H8 ,其名称是_______,A到B的反应类型是______________________。 (2)E中所含含氧官能团的名称是_______,M的结构简式是__________。 (3)C能与NaHCO3溶液反应,则反应①的化学方程式是_____________。 (4)反应②、③中试剂ii和试剂iii依次是_______。(填序号) a.高锰酸钾酸性溶液、氢氧化钠溶液 b.氢氧化钠溶液、高锰酸钾酸性溶液 (5)H的结构简式是_______。 (6)J有多种同分异构体,其中符合下列条件的同分异构体有______ 种,写出其中任一种同分异构体的结构简式:____。 a.为苯的二元取代物 b.遇到FeCl3溶液显紫色,能发生水解反应且能发生银镜反应 (7)以A为起始原料,选用必要的无机试剂合成涂改液的主要成分亚甲基环己烷( |
|
高中化学 试卷推荐
- 高中化学人教版 必修2 第一章 物质结构 元素周期律 第一节 元素周期表 元素性质与原子结构
- 2017-2018年高二上期第二次联考化学在线测验(福建省永安一中、德化一中、漳平一中)
- 2016-2017年高二下册期中考试化学在线测验(福建省永春县第一中学)
- 2018届高三上期11月月考理综化学考题带答案和解析(广东省佛山一中)
- 2017-2018年高二上学期理综-化学期末考试题带答案和解析(广东省惠州市)
- 2016-2017年高二上册化学期中考试在线测验(广东省佛山一中)
- 2018届高三一模化学考卷带参考答案和解析(上海市青浦区)
- 2016-2017年高一上半年化学期中考试考题带答案和解析(浙江省绍兴一中)
最近更新