2019е®үеҫҪй«ҳдёҖдёҠеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
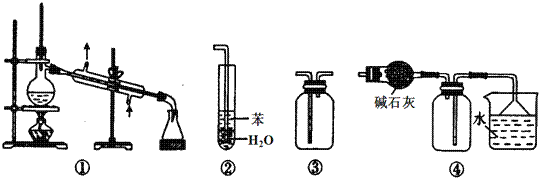
дёӢеҲ—жңүе…ід»ӘеҷЁдҪҝз”Ёж–№жі•жҲ–е®һйӘҢж“ҚдҪңжӯЈзЎ®зҡ„жҳҜпјҲ В В В В В пјү A. жҙ—еҮҖзҡ„й”ҘеҪўз“¶е’Ңе®№йҮҸ瓶еҸҜд»Ҙж”ҫиҝӣзғҳз®ұзғҳе№І B. й…ёејҸж»ҙе®ҡз®ЎиЈ…ж ҮеҮҶжә¶ж¶ІеүҚпјҢеҝ…йЎ»е…Ҳз”ЁиҜҘжә¶ж¶Іж¶Ұжҙ— C. й…ёзўұж»ҙе®ҡе®һйӘҢдёӯпјҢз”Ёеҫ…ж»ҙе®ҡжә¶ж¶Іж¶Ұжҙ—й”ҘеҪўз“¶д»ҘеҮҸе°Ҹе®һйӘҢиҜҜе·® D. з”Ёе®№йҮҸ瓶й…Қжә¶ж¶Іж—¶пјҢиӢҘеҠ ж°ҙи¶…иҝҮеҲ»еәҰзәҝпјҢз«ӢеҚіз”Ёж»ҙз®ЎеҗёеҮәеӨҡдҪҷж¶ІдҪ“ В |
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
е®һйӘҢжҳҜеҢ–еӯҰз ”з©¶зҡ„еҹәзЎҖгҖӮдёӢеҲ—е…ідәҺеҗ„е®һйӘҢиЈ…зҪ®зҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү
A. иЈ…зҪ®в‘ еёёз”ЁдәҺеҲҶзҰ»дә’дёҚзӣёжә¶зҡ„ж¶ІдҪ“ж··еҗҲзү© B. иЈ…зҪ®в‘ЎеҸҜз”ЁдәҺеҗёж”¶NH3жҲ–HClж°”дҪ“пјҢ并йҳІжӯўеҖ’еҗё C. иЈ…зҪ®в‘ЈеҸҜз”ЁдәҺе№ІзҮҘгҖҒ收йӣҶж°ҜеҢ–ж°ўпјҢ并еҗёж”¶еӨҡдҪҷзҡ„ж°ҜеҢ–ж°ў D. иЈ…зҪ®в‘ўеҸҜз”ЁдәҺ收йӣҶH2гҖҒCO2гҖҒCl2гҖҒNH3зӯүж°”дҪ“ В |
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
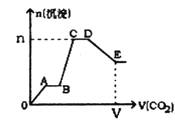
ж ҮеҶөдёӢе°ҶCO2ж°”дҪ“зј“зј“ең°йҖҡе…ҘеҲ°еҗ«2 mol KOHгҖҒ1 mol Ba(OH)2е’Ң2 mol KAlO2зҡ„ж··еҗҲжә¶ж¶ІдёӯзӣҙиҮіиҝҮйҮҸпјҢз”ҹжҲҗжІүж·Җзҡ„зү©иҙЁзҡ„йҮҸдёҺжүҖйҖҡCO2зҡ„дҪ“з§Ҝе…ізі»еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—е…ідәҺж•ҙдёӘеҸҚеә”иҝӣзЁӢдёӯзҡ„еҗ„з§ҚжҸҸиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү
AпјҺAпҪһBж®өе’ҢCпҪһDж®өеҸ‘з”ҹзҡ„еҸҚеә”зӣёеҗҢ BпјҺBпҪһCж®өеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜA1O2-+2H2O+CO2=Al(OH)3вҶ“+HCO3- CпјҺV=134.4 LпјҢn=3mol DпјҺDзӮ№жүҖеҫ—жә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰзҡ„е…ізі»дёәпјҡc(K+)пјһc(CO32-)пјһc(OHп№Ј)пјһc(HCO3-)пјһc(H+) В |
|
| 4. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||||||
|
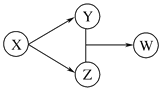
XгҖҒYгҖҒZгҖҒWеӣӣз§Қзү©иҙЁзҡ„иҪ¬еҢ–е…ізі»еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—з»„еҗҲдёӯдёҚз¬ҰеҗҲиҜҘе…ізі»зҡ„жҳҜ(гҖҖгҖҖ)
В |
||||||||||||||||||||||||||
| 5. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
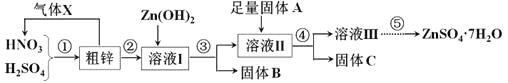
еҲ©з”Ёеҗ«й“ңгҖҒй“Ғзҡ„зІ—й”ҢеҲ¶еӨҮзЎ«й…ёй”ҢеҸҠзӣёе…ізү©иҙЁгҖӮе·ҘиүәжөҒзЁӢеӣҫеҸҠжңүе…іж•°жҚ®еҰӮдёӢпјҡ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүзІ—й”Ңдёӯзҡ„й“ңдёҺж··й…ёзҡ„зЁҖжә¶ж¶ІеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә_________________пјҢеӣҫдёӯеӨ„зҗҶж°”дҪ“XиҰҒиғҪеӨҹдҪ“зҺ°з»ҝиүІеҢ–еӯҰжҖқжғіпјҢиҝҳйңҖиЎҘе……ж°”дҪ“______пјҲеЎ«еҢ–еӯҰејҸпјүгҖӮ пјҲ2пјүиӢҘжә¶ж¶ІIдёӯc(Cu2пјӢ)дёә0.05molВ·LпјҚ1пјҢеҲҷжә¶ж¶ІIIдёӯc(Fe3пјӢ)пјһ____molВ·LпјҚ1гҖӮ пјҲ3пјүиӢҘеӣәдҪ“AжҳҜZnпјҢеҸ–9.61 gеӣәдҪ“Cжә¶и§ЈдәҺи¶ійҮҸзҡ„500mL 2 molВ·LпјҚ1зЁҖзЎқй…ёдёӯпјҢе…ұ收йӣҶеҲ°ж ҮеҮҶзҠ¶еҶөдёӢ2.24Lзҡ„ж°”дҪ“пјҢеҗ‘жүҖеҫ—жә¶ж¶ІдёӯеҠ е…Ҙ2 molВ·LпјҚ1В NaOHжә¶ж¶ІпјҢеҲҷеҪ“з”ҹжҲҗжІүж·ҖжңҖеӨҡж—¶пјҢжІүж·Җзҡ„иҙЁйҮҸдёә_____gпјӣиӢҘеӣәдҪ“AжҳҜеҸҰдёҖз§Қзү©иҙЁпјҢеҸ–йғЁеҲҶеӣәдҪ“CдәҺиҜ•з®ЎдёӯпјҢеҠ е…Ҙзӣҗй…ёдә§з”ҹжңүиҮӯйёЎиӣӢе‘іж°”дҪ“пјҢеҲҷиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә________________________гҖӮ пјҲ4пјүжә¶ж¶Ів…ўз»ҸиҝҮи’ёеҸ‘жө“зј©гҖҒ____________гҖҒиҝҮж»ӨгҖҒжҙ—ж¶ӨгҖҒе№ІзҮҘпјҢеҚіеҫ—еҲ°иҫғзәҜеҮҖзҡ„зЎ«й…ёй”Ңжҷ¶дҪ“пјӣжә¶ж¶ІиҝҳеҸҜд»ҘеҲ¶еӨҮZnSпјҢе®һйҷ…йҖүжӢ©зҡ„жҳҜпјҲNH4пјү2Sжә¶ж¶ІиҖҢдёҚжҳҜNa2Sжә¶ж¶ІдҪңдёәеҸҚеә”зү©пјҢзҗҶз”ұжҳҜеҗҺиҖ…еҲ¶еҫ—зҡ„ZnSеҗ«жңүиҫғеӨҡзҡ„жқӮиҙЁпјҢеҲҷиҜҘжқӮиҙЁжҳҜ____________пјҲеЎ«еҢ–еӯҰејҸпјүгҖӮ пјҲ5пјүйҮ‘еұһй”Ңеёёз”ЁдҪңй…ёжҖ§е№Із”өжұ зҡ„иҙҹжһҒпјҢе№Із”өжұ дёҚдҪҝз”Ёж—¶пјҢз”ұдәҺиҙҹжһҒдёҺз”өи§ЈиҙЁжә¶ж¶ІжҺҘи§ҰиҖҢеҸ‘з”ҹиҮӘж”ҫз”өеҸҚеә”пјҡ2NH4пјӢпјӢZnпјқ2NH3пјӢH2вҶ‘пјӢZn2пјӢпјҢйҖ жҲҗз”өйҮҸиҮӘеҠЁеҮҸе°‘гҖӮеҶҷеҮәй“…и“„з”өжұ дёҚдҪҝз”Ёж—¶пјҢе…¶жӯЈжһҒдёҠеҸ‘з”ҹиҮӘж”ҫз”өзҡ„еҢ–еӯҰж–№зЁӢејҸ__________________гҖӮ В |
|||||||||||||
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—ж“ҚдҪңй”ҷиҜҜзҡ„жҳҜпјҲ В В В В В пјү A. йҷӨеҺ»CO2дёӯе°‘йҮҸзҡ„SO2пјҡйҖҡиҝҮзӣӣжңүйҘұе’ҢNaHCO3жә¶ж¶Ізҡ„жҙ—气瓶 B. йҷӨеҺ»жәҙиӢҜдёӯзҡ„е°‘йҮҸжәҙпјҡеҠ е…ҘNaOHжә¶ж¶ІпјҢжҢҜиҚЎгҖҒйқҷзҪ®еҲҶеұӮеҗҺпјҢйҷӨеҺ»ж°ҙеұӮ C. жҸҗеҸ–зўҳж°ҙдёӯзҡ„зўҳпјҡз”Ёеӣӣж°ҜеҢ–зўіиҗғеҸ– D. йҷӨеҺ»д№ҷй…ёд№ҷй…Ҝдёӯзҡ„е°‘йҮҸд№ҷй…ёпјҡеҠ е…Ҙд№ҷйҶҮе’Ңжө“зЎ«й…ёпјҢдҪҝд№ҷй…ёе…ЁйғЁиҪ¬еҢ–дёәд№ҷй…ёд№ҷй…Ҝ В |
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү AпјҺж°ҙзҡ„ж‘©е°”иҙЁйҮҸжҳҜ18gВ В В В В В В В В BпјҺ1еҲҶеӯҗзЎ«й…ёзҡ„иҙЁйҮҸжҳҜ98g CпјҺ1molN2зҡ„иҙЁйҮҸжҳҜ28gВ В В В В В В В DпјҺж‘©е°”жҳҜдёғдёӘеҹәжң¬зү©зҗҶйҮҸд№ӢдёҖ В |
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
0.5L 1mol/L FeCl3жә¶ж¶ІдёҺ0.2L1mol/L KClжә¶ж¶Ідёӯзҡ„Cl-зҡ„ж•°зӣ®д№ӢжҜ”пјҲВ В В В пјү AпјҺ 5пјҡ2В В В В В В В BпјҺ 3пјҡ1В В В В В В В В CпјҺ15пјҡ2В В В В В В В В В DпјҺ 1пјҡ3 В |
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеӣҫжҳҜе®һйӘҢе®Өзҡ„зЎ«й…ёиҜ•еүӮж ҮзӯҫдёҠзҡ„йғЁеҲҶеҶ…е®№гҖӮжҚ®жӯӨпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ В В В В В В пјү
A. иҜҘзЎ«й…ёзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә9.2molВ·LпјҚ1 B. 1mol FeдёҺи¶ійҮҸзҡ„зЁҖзЎ«й…ёеҸҚеә”пјҢж ҮеҮҶзҠ¶еҶөдёӢдә§з”ҹ44.8Lж°”дҪ“ C. иӢҘе®һйӘҢе®ӨйңҖиҰҒ4.6В mol/Lзҡ„зЁҖзЎ«й…ё500mLпјҢй…ҚеҲ¶зЁҖзЎ«й…ёж—¶еҲҷеә”йҮҸеҸ–иҜҘзЎ«й…ё125.0mL D. иҜҘзЎ«й…ёдёҺзӯүдҪ“з§Ҝзҡ„ж°ҙж··еҗҲеҗҺпјҢжүҖеҫ—жә¶ж¶Ізҡ„иҙЁйҮҸеҲҶж•°зӯүдәҺ49% В |
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
NAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖј.дёӢеҲ—еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜпјҲВ В В В пјү A. 18gи‘Ўиҗ„зі–еҲҶеӯҗдёӯе®ҳиғҪеӣўж•°зӣ®дёә0.6NA B. еҗ«жңү0.1molВ NH4+зҡ„ж°Ёж°ҙдёӯпјҢеҗ«жңүOH-зҡ„ж•°ж—ҘеӨ§дәҺ0.1NA C. еёёжё©дёӢпјҢ5.6gFeдёҺеҗ«0.2molHNO3зҡ„жә¶ж¶Іе……еҲҶдҪңз”ЁпјҢжңҖе°‘дјҡеӨұеҺ»з”өеӯҗж•°дёә0.15NA D. еёёжё©дёӢпјҢ1LВ pH=9зҡ„CH3COONaе°Үж¶ІдёӯпјҢеҸ‘з”ҹз”өзҰ»зҡ„ж°ҙеҲҶеӯҗж•°дёә1Г—10-5NA В |
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
ж°ҙзғӯжі•еҲ¶еӨҮFe3O4зәізұійў—зІ’зҡ„еҸҚеә”дёә3Fe2+ + 2S2O32пјҚ+ O2 +xOHпјҚ=Fe3O4 + S4O62пјҚ + 2H2OпјҢ дёӢеҲ—иҜҙжі•дёӯдёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү A. жҜҸз”ҹжҲҗ1 mol Fe3O4пјҢеҸҚеә”иҪ¬з§»зҡ„з”өеӯҗжҖ»ж•°дёә4 mol B. Fe2+е’ҢS2O32пјҚйғҪжҳҜиҝҳеҺҹеүӮ C. 1 mol Fe2+иў«ж°§еҢ–ж—¶пјҢиў«Fe2+иҝҳеҺҹзҡ„O2зҡ„зү©иҙЁзҡ„йҮҸдёә1/3 mol D. xпјқ4 В |
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
24 mL 0.05 molВ·LпјҚ1зҡ„ Na2SO3жә¶ж¶ІжҒ°еҘҪдёҺ20 mL 0.02 molВ·LпјҚ1зҡ„K2R2O7зҡ„жә¶ж¶Іе®Ңе…ЁеҸҚеә”пјҢеҲҷRе…ғзҙ еңЁиҝҳеҺҹдә§зү©дёӯзҡ„еҢ–еҗҲд»·дёәпјҲВ В В В пјү A. 0В В В В В В В В В В В В B. +2В В В В В В В В В В В В C. +3В В В В В В В В В В В D. +6 В |
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺжә¶ж¶Ізҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү A. жүҖжңүжә¶ж¶ІйғҪжҳҜж— иүІзҡ„ B. з”ұеҲҶж•ЈиҙЁе’ҢеҲҶж•ЈеүӮз»„жҲҗзҡ„еҲҶж•Јзі»дёҖе®ҡжҳҜжә¶ж¶І C. еқҮдёҖзЁіе®ҡзҡ„ж¶ІдҪ“жҳҜжә¶ж¶І D. жә¶ж¶ІжҳҜз”ұжә¶иҙЁе’Ңжә¶еүӮз»„жҲҗзҡ„ В |
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁиҙЁйҮҸеҲҶж•°дёә98%зҡ„жө“зЎ«й…ё(ПҒпјқ1.84 gВ·cmпјҚ3)й…ҚеҲ¶240 mL 1.84 molВ·LпјҚ1зЁҖзЎ«й…ёпјҢдёӢеҲ—ж“ҚдҪңжӯЈзЎ®зҡ„жҳҜгҖҖВ В В В (гҖҖгҖҖ) A. е°Ҷи’ёйҰҸж°ҙзј“ж…ўжіЁе…ҘзӣӣжңүдёҖе®ҡйҮҸжө“зЎ«й…ёзҡ„зғ§жқҜдёӯпјҢ并дёҚж–ӯжҗ…жӢҢиҮіеҶ·еҚҙ B. еҝ…йңҖзҡ„е®ҡйҮҸд»ӘеҷЁжңү100 mLйҮҸзӯ’гҖҒ250 mLе®№йҮҸ瓶 C. йҮҸеҸ–жө“зЎ«й…ёзҡ„дҪ“з§Ҝдёә25.0 mL D. е…ҲеңЁе®№йҮҸ瓶дёӯеҠ е…ҘйҖӮйҮҸж°ҙпјҢе°ҶйҮҸеҘҪзҡ„жө“зЎ«й…ёжіЁе…Ҙе®№йҮҸ瓶пјҢеҠ ж°ҙе®ҡе®№ В |
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҜ№дёҖдәӣзү©иҙЁжҲ–еҢ–еӯҰеҸҚеә”зҡ„еҲҶзұ»д»ҘеҸҠдҫқжҚ®жӯЈзЎ®зҡ„жҳҜпјҲ В В В В В В пјү A. иұҶжөҶжҳҜиғ¶дҪ“пјҢеӣ дёәиұҶжөҶдёӯзҡ„еҲҶж•ЈиҙЁзІ’еӯҗзӣҙеҫ„еңЁ1nmпҪһ100nmд№Ӣй—ҙ B. NaClжә¶ж¶ІжҳҜз”өи§ЈиҙЁпјҢеӣ дёәNaClжә¶ж¶ІиғҪеҜјз”ө C. Naе’ҢH2Oзҡ„еҸҚеә”дёҚжҳҜзҰ»еӯҗеҸҚеә”пјҢеӣ дёәеҸҚеә”дёӯжІЎжңүзҰ»еӯҗеҸӮеҠ D. H2SO4жҳҜй…ёпјҢеӣ дёәH2SO4дёӯеҗ«жңүж°ўе…ғзҙ В |
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёӢиҝ°жқЎд»¶дёӢпјҢдёҖе®ҡиғҪеӨ§йҮҸе…ұеӯҳзҡ„зҰ»еӯҗз»„жҳҜпјҲВ В В пјү A. ж— иүІйҖҸжҳҺзҡ„ж°ҙжә¶ж¶ІдёӯпјҡK+гҖҒBa2+гҖҒI-гҖҒMnO4- B. иғҪдёҺAlеҸҚеә”дә§з”ҹH2зҡ„жә¶ж¶ІдёӯпјҡHCO3-гҖҒNa+гҖҒAl3+гҖҒBr- C. жҫ„жё…йҖҸжҳҺжә¶ж¶ІдёӯпјҡK+гҖҒFe3+гҖҒHCO3-гҖҒAlO2вҲ’ D. еёёжё©дёӢpH=1зҡ„жә¶ж¶ІдёӯпјҡMg2+гҖҒCl-гҖҒSO42-гҖҒFe3+ В |
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘеңЁзўұжҖ§жә¶ж¶ІдёӯеҸҜеҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡFeпјҲOHпјү3+ClOп№Ј+OHп№Јв•җFe4nп№Ј+Clп№Ј+H2OпјҲжңӘй…Қе№іпјүпјҺеҲҷдёӢеҲ—жңүе…іеҸҷиҝ°й”ҷиҜҜзҡ„жҳҜпјҲгҖҖгҖҖпјү В |
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
з§°еҸ–дёӨд»Ҫй“қзІүпјҢ第дёҖд»ҪеҠ и¶ійҮҸзҡ„NaOHжә¶ж¶ІпјҢ第дәҢд»ҪеҠ и¶ійҮҸзҡ„зӣҗй…ёпјҢиӢҘж”ҫеҮәзӯүйҮҸзҡ„ж°”дҪ“пјҢеҲҷдёӨд»Ҫй“қзІүзҡ„иҙЁйҮҸжҜ”пјҲВ В пјү В |
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁзӣёеҗҢжқЎд»¶дёӢпјҢ0.1molй•Ғе’Ң0.1molй“қеҲҶеҲ«е’Ңи¶ійҮҸзҡ„зЁҖзӣҗй…ёиө·еҸҚеә”еҗҺдә§з”ҹзҡ„ж°ўж°”пјҲВ В пјү В |
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
е°ҶдёҖеқ—й’ жҠ•е…ҘеҲ°зӣӣжңүз…ӨжІ№е’Ңж°ҙзҡ„зғ§жқҜдёӯпјҢи§ӮеҜҹеҲ°зҡ„зҺ°иұЎеҸҜиғҪжҳҜпјҲВ В В пјү AпјҺй’ еңЁж°ҙеұӮдёӯеҸҚеә”并еӣӣеӨ„жёёеҠЁ BпјҺй’ еҒңз•ҷеңЁз…ӨжІ№еұӮдёӯдёҚеҸ‘з”ҹеҸҚеә” CпјҺй’ еңЁз…ӨжІ№дёӯзҡ„ж¶ІйқўдёҠеҸҚеә”并еӣӣеӨ„жёёеҠЁ DпјҺй’ еңЁз…ӨжІ№дёҺж°ҙзҡ„з•ҢйқўеӨ„еҸҚеә”并еҸҜиғҪдёҠдёӢи·іеҠЁ В |
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
a mol Fe3O4дёҺb mol FeOжҠ•е…ҘV L c molВ·LпјҚ1зҡ„HNO3жә¶ж¶І(иҝҮйҮҸ)дёӯпјҢе……еҲҶеҸҚеә”пјҢдә§з”ҹж°”дҪ“дёәNOпјҢеҲҷеҸҚеә”еҗҺжә¶ж¶ІдёӯNO3пјҚзҡ„йҮҸдёә A. 62(aпјӢb) gВ В В B. 186(aпјӢb) g C. В |
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү A. ж°ҜеҢ–й“қжә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙпјҡAl3+ + 4NH3вҖўH2O B. жҫ„жё…зҹізҒ°ж°ҙдёҺе°‘йҮҸе°ҸиӢҸжү“жә¶ж¶Іж··еҗҲпјҡCa2+ + OH- + HCO3-В C. зўій…ёй’ҷжә¶дәҺйҶӢй…ёCaCO3 + 2H+ D. еҗ‘NaHSO4жә¶ж¶ІеҠ е…ҘBa(OH)2жә¶ж¶ІиҮідёӯжҖ§пјҡH++ SO42пјҚ+Ba2++OHпјҚ=BaSO4вҶ“+ H2O В |
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„йЎ№е®һйӘҢж“ҚдҪңдёӯжӯЈзЎ®зҡ„жҳҜ A. еҠ е…ҘйҖӮйҮҸзҡ„NaOHеҸҜйҷӨеҺ»NaHCO3жә¶ж¶Ідёӯж··жңүзҡ„е°‘йҮҸNa2CO3 B. еңЁи’ёйҰҸж—¶еә”е…Ҳжү“ејҖеҶ·еҮқж°ҙејҖе…іпјҢеҫ…ж°ҙе……ж»ЎеҗҺеҶҚзӮ№зҮғй…’зІҫзҒҜ C. еҲҶж¶Іж—¶пјҢеҲҶж¶ІжјҸж–—дёӯдёӢеұӮж¶ІдҪ“д»ҺдёӢеҸЈж”ҫеҮәпјҢ然еҗҺжҚўдёҖдёӘзғ§жқҜе°ҶдёҠеұӮж¶ІдҪ“ж”ҫеҮә D. еңЁеҒҡи’ёйҰҸе®һйӘҢж—¶еә”е°Ҷжё©еәҰи®Ўзҡ„ж°ҙ银зҗғжөёжІЎеңЁж¶ІдҪ“йҮҢ В |
|
| 24. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
е®һйӘҢе®Өеёёз”Ёзҡ„еҲҶзҰ»ж“ҚдҪңжңүпјҡв‘ иҗғеҸ–еҲҶж¶Іжі•в‘Ўз»“жҷ¶жі•в‘ўеҲҶж¶Іжі•в‘Ји’ёйҰҸжі•в‘ӨиҝҮж»Өжі•гҖӮйҖүжӢ©д»ҘдёҠж–№жі•еҲҶзҰ»ж··еҗҲзү©пјҢйҖүжӢ©жӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү
A.AВ В В В В В В В В В В В В В В В B.BВ В В В В В В В В В В В В В В В В В В В C.CВ В В В В В В В В В В В В В В В В В В В D.D В |
|||||||||||||
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ҘдёҡдёҠеҸҜ用硫酸银дёҺзЎ«й»„еҹ№зғ§еҲ¶еӨҮж°§еҢ–й“қпјҢеҶҚз”өи§Јж°§еҢ–й“қпјҢеҸ‘з”ҹеҸҚеә”еҰӮдёӢпјҡеҸҚеә”в… пјҡ2A12(SO4)3+3S еҸҚеә”в…Ўпјҡ2Al2O3 дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү A. еҸҚеә”в… дёӯS еҚ•иҙЁжҳҜж°§еҢ–еүӮ B. еҸҚеә”в…Ўдёӯй“қе…ғзҙ иў«ж°§еҢ– C. еҪ“з”ҹжҲҗ5.4gAlж—¶пјҢеҸҚеә”в… е’Ңв…Ўе…ұиҪ¬з§»1.2mole- D. еҸҚеә”в… дёӯж°§еҢ–дә§зү©дёҺиҝҳеҺҹдә§зү©зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә2пјҡ9 В |
|
| 26. | иҜҰз»ҶдҝЎжҒҜ |
|
иҝҮж°§д№ҷй…ё(CH3COOOH)жҳҜж— иүІйҖҸжҳҺж¶ІдҪ“пјҢжҳ“жә¶дәҺж°ҙгҖҒжҳ“жҢҘеҸ‘пјҢи§Ғе…үжҳ“еҲҶи§ЈпјҢе…·жңүејәж°§еҢ–жҖ§зҡ„й«ҳж•Ҳж¶ҲжҜ’еүӮпјҢдҪҝз”ЁиҝҮж°§д№ҷй…ёж¶ҲжҜ’еүӮж—¶йҖҡеёёе…Ҳз”Ёж°ҙзЁҖйҮҠе·Ҙдёҡе“ҒиҝҮж°§д№ҷй…ёпјҢ然еҗҺз”Ёе–·йӣҫжі•еҜ№з©әж°”дёҺең°йқўиҝӣиЎҢж¶ҲжҜ’гҖӮ пјҲ1пјүжҹҗеӯҰз”ҹеңЁе®һйӘҢе®Өз”ЁеҜҶеәҰдёә1.15g/mLпјҢиҙЁйҮҸеҲҶж•°дёә15%зҡ„е·Ҙдёҡе“ҒиҝҮж°§д№ҷй…ёй…ҚеҲ¶0.1mol/LиҝҮж°§д№ҷй…ёжә¶ж¶І250mLпјҢиҜҘз”ҹз”ЁйҮҸзӯ’йҮҸеҸ–е·Ҙдёҡе“ҒиҝҮж°§д№ҷй…ёдҪ“з§Ҝ___________________ mLпјҢйҷӨйҮҸзӯ’гҖҒзҺ»з’ғжЈ’гҖҒзғ§жқҜеӨ–иҝҳйңҖиҰҒзҡ„е…¶е®ғд»ӘеҷЁжҳҜ____________________________________гҖӮ пјҲ2пјүиҜҘеӯҰз”ҹй…ҚеҲ¶еүҚи®ҫи®ЎдәҶдёӢеҲ—ж“ҚдҪңпјҢе…¶еҗҲзҗҶзҡ„ж“ҚдҪңйЎәеәҸжҳҜ____________пјҲеӯ—жҜҚиЎЁзӨәпјҢжҜҸдёӘеӯ—жҜҚеҸӘиғҪз”ЁдёҖж¬ЎпјүгҖӮ AпјҺз”Ё30mLж°ҙжҙ—ж¶Өзғ§жқҜ2пҪһ3ж¬ЎпјҢжҙ—ж¶Өж¶ІеқҮжіЁе…Ҙе®№йҮҸ瓶пјҢжҢҜиҚЎ BпјҺз”ЁйҮҸзӯ’еҮҶзЎ®йҮҸеҸ–жүҖйңҖдҪ“з§Ҝзҡ„е·Ҙдёҡе“ҒиҝҮж°§д№ҷй…ёпјҢжІҝзҺ»з’ғжЈ’еҖ’е…Ҙзғ§жқҜдёӯпјҢеҶҚеҠ е…Ҙе°‘йҮҸж°ҙпјҲзәҰ30mLпјүпјҢз”ЁзҺ»з’ғжЈ’ж…ўж…ўжҗ…еҠЁпјҢдҪҝе…¶ж··еҗҲеқҮеҢҖ CпјҺе°Ҷе·ІеҶ·еҚҙзҡ„е·Ҙдёҡе“ҒиҝҮж°§д№ҷй…ёжІҝзҺ»з’ғжЈ’жіЁе…Ҙе®№йҮҸ瓶дёӯ DпјҺе°Ҷе®№йҮҸ瓶зӣ–зҙ§пјҢеҖ’зҪ®е№¶жҢҜиҚЎпјҢж‘ҮеҢҖ EпјҺж”№з”Ёиғ¶еӨҙж»ҙз®ЎеҠ ж°ҙпјҢдҪҝжә¶ж¶ІеҮ№йқўжҒ°еҘҪдёҺеҲ»еәҰзӣёеҲҮ FпјҺ继з»ӯеҫҖе®№йҮҸ瓶еҶ…е°ҸеҝғеҠ ж°ҙпјҢзӣҙеҲ°ж¶ІйқўжҺҘиҝ‘еҲ»еәҰ1вҖ”2cmеӨ„ пјҲ3пјүиӢҘеҮәзҺ°еҰӮдёӢжғ…еҶөпјҢеҜ№жүҖй…Қжә¶ж¶Іжө“еәҰе°ҶжңүдҪ•еҪұе“ҚпјҲйҖүеЎ«вҖңеҒҸй«ҳвҖқ гҖҒвҖң еҒҸдҪҺвҖқжҲ–вҖңж— еҪұе“ҚвҖқпјү? a. е®№йҮҸ瓶用蒸йҰҸж°ҙжҙ—ж¶ӨеҗҺжңӘе№ІзҮҘпјҢеҗ«жңүе°‘йҮҸи’ёйҰҸж°ҙ_____________________пјӣ b. иҪ¬з§»жә¶ж¶Іж—¶пјҢдёҚж…Һжңүе°‘йҮҸжә¶ж¶Іжҙ’еңЁе®№йҮҸ瓶еӨ–___________________________пјӣ cпјҺйҮҸеҸ–15%зҡ„е·Ҙдёҡе“ҒиҝҮж°§д№ҷй…ёж—¶пјҢд»°и§ҶйҮҸзӯ’_______________________пјӣ dпјҺе®ҡе®№еҗҺпјҢжҠҠе®№йҮҸ瓶еҖ’зҪ®ж‘ҮеҢҖеҗҺеҸ‘зҺ°ж¶ІйқўдҪҺдәҺеҲ»еәҰзәҝпјҢиЎҘе……еҮ ж»ҙж°ҙиҮіеҲ»еәҰзәҝ____________гҖӮ пјҲ4пјүдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ__________________(еЎ«еӯ—жҜҚ)гҖӮ A.еҸҜз”ЁиҝҮж»Өзҡ„ж–№жі•е°ҶиҝҮж°§д№ҷй…ёжә¶ж¶Ідёӯж··жңүзҡ„NaClйҷӨжҺү B.иҝҮж°§д№ҷй…ёеҢ…иЈ…дёҠеә”иҙҙзҡ„еҚұйҷ©иӯҰе‘Ҡж Үзӯҫеә”еҰӮеҸіеӣҫжүҖзӨә C.иҝҮж°§д№ҷй…ёеә”жіЁж„ҸеҜҶй—ӯгҖҒдҪҺжё©дҝқеӯҳдәҺжЈ•иүІз»ҶеҸЈз“¶дёӯ D.иҝҮж°§д№ҷй…ёжҳҜдёҖз§Қжңүжңәзү©пјҢе®ғеҸҜд»Ҙз”ЁдәҺиҗғеҸ–зўҳж°ҙдёӯзҡ„зўҳеҚ•иҙЁ пјҲ5пјүиҝҮж°§д№ҷй…ёеҚҠе°Ҹж—¶еҶ…дјҡе®Ңе…ЁеҲҶи§ЈжҲҗд№ҷй…ё(CH3COOH)е’ҢдёҖз§Қеёёи§Ғзҡ„ж°”дҪ“еҚ•иҙЁпјҢжЈҖйӘҢиҜҘж°”дҪ“еҚ•иҙЁзҡ„е®һйӘҢж–№жі•жҳҜ___________________________гҖӮ пјҲ6пјүеҰӮжһңз”ҹдә§иҝҮж°§д№ҷй…ёзҡ„еҺҹж–ҷCH3COONaдёӯж··жңүдәҶSO42пјҚ,иҰҒжғійҷӨжҺүSO42пјҚиҜ·йҖүжӢ©дёӢеҲ—иҜ•еүӮжҢүз…§еҠ е…Ҙе…ҲеҗҺйЎәеәҸеЎ«з©ә_________________________пјҲиҜ•еүӮдёҚеҝ…йҖүе®ҢпјҢеЎ«еәҸеҸ·пјүгҖӮ в‘ зӣҗй…ёв‘ЎйҶӢй…ёй’Ўжә¶ж¶Ів‘ўж°ҜеҢ–й’Ўжә¶ж¶Ів‘ЈйҶӢй…ёв‘Өзўій…ёй’ жә¶ж¶Ів‘Ҙзўій…ёж°ўй’ жә¶ж¶І В |
|
| 27. | иҜҰз»ҶдҝЎжҒҜ |
|
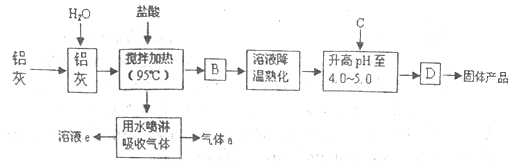
иҒҡеҗҲж°ҜеҢ–й“қжҷ¶дҪ“жҳҜд»ӢдәҺAlCl3е’ҢA1(OH)3д№Ӣй—ҙзҡ„дёҖз§Қж°ҙжә¶жҖ§ж— жңәй«ҳеҲҶеӯҗиҒҡеҗҲзү©пјҢе…¶еҲ¶еӨҮеҺҹж–ҷдё»иҰҒжҳҜй“қеҠ е·ҘиЎҢдёҡзҡ„еәҹжёЈвҖ”вҖ”й“қзҒ°пјҢе®ғдё»иҰҒеҗ«Al2O3гҖҒAlпјҢиҝҳжңүSiO2зӯүжқӮиҙЁгҖӮиҒҡеҗҲж°ҜеҢ–й“қз”ҹдә§е·ҘиүәжөҒзЁӢеҰӮдёӢпјҡ
пјҲ1пјүеҸҚеә”дёӯеүҜдә§е“ҒaжҳҜ______пјҲз”ЁеҢ–еӯҰејҸиЎЁзӨәпјүпјӣ пјҲ2пјүеҚҮй«ҳpHиҮі4.0пҪһ4.5зҡ„зӣ®зҡ„жҳҜ______пјӣ пјҲ3пјүз”ҹдә§иҝҮзЁӢдёӯеҸҜеҫӘзҺҜдҪҝз”Ёзҡ„зү©иҙЁжҳҜ______пјҲз”ЁеҢ–еӯҰејҸиЎЁзӨәпјүпјӣ пјҲ4пјүдёәдҪҝеҫ—еҲ°зҡ„жҷ¶дҪ“иҫғзәҜеҮҖпјҢз”ҹдә§иҝҮзЁӢдёӯдҪҝpHеҚҮй«ҳзҡ„Cзү©иҙЁеҸҜйҖүз”Ё______пјҲеЎ«зј–еҸ·пјүпјӣ aпјҺNaOHВ В В В bпјҺAlВ В В В cпјҺж°Ёж°ҙВ В dпјҺA12O3В В В В eпјҺNaAlO2 пјҲ5пјүиҒҡеҗҲж°ҜеҢ–й“қжҷ¶дҪ“зҡ„еҢ–еӯҰејҸеҸҜиЎЁзӨәдёә[A12пјҲOHпјүnCl6-nвҖўH2O]mпјҢе®һйӘҢе®ӨдёәжөӢе®ҡnзҡ„еҖјпјҢиҝӣиЎҢеҰӮдёӢж“ҚдҪңпјҡ в‘ з§°еҸ–agжҷ¶дҪ“пјҢеҲ¶жҲҗзІүжң«пјҢеҠ зғӯиҮіиҙЁйҮҸдёҚеҶҚеҸҳеҢ–ж—¶пјҢеҫ—еҲ°bgгҖӮжӯӨиҝҮзЁӢеҸҜиғҪз”ЁеҲ°зҡ„дёӢеҲ—д»ӘеҷЁжңү______пјӣ a.и’ёеҸ‘зҡҝВ В В В В В В В b.еқ©еҹҡВ В В В В В В В В В c.з ”й’өВ В В В В В В В В d.иҜ•з®Ў в‘ЎеҸҰеҸ–aВ gжҷ¶дҪ“пјҡз”ЁAиҜ•еүӮжә¶и§ЈвҶ’еҠ и¶ійҮҸAgNO3жә¶ж¶ІвҶ’иҝӣиЎҢCж“ҚдҪңвҶ’жҙ—ж¶ӨгҖҒзғҳе№ІвҶ’з§°йҮҸдёәcВ gгҖӮеҲҷиҜ•еүӮAдёә______пјҲеЎ«ж“ҚдҪңеҗҚз§°пјүпјҢCж“ҚдҪңдёә______пјҲеЎ«ж“ҚдҪңеҗҚз§°пјүгҖӮжңҖеҗҺз»јеҗҲжҺЁз®—еҮәnзҡ„еҖј_____ гҖӮ В |
|
| 28. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||
|
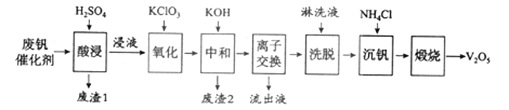
еӣһзӯ”дёӢеҲ—й—®йўҳ в… гҖҒе…ғзҙ 铬(Cr)еңЁжә¶ж¶Ідёӯдё»иҰҒд»ҘCr3+(и“қзҙ«иүІ)гҖҒCr(OH)4вҲ’(з»ҝиүІ)гҖҒCr2O72вҲ’(ж©ҷзәўиүІ)гҖҒCrO42вҲ’(й»„иүІ)зӯүеҪўејҸеӯҳеңЁпјҢCr(OH)3дёәйҡҫжә¶дәҺж°ҙзҡ„зҒ°и“қиүІеӣәдҪ“пјҢеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)Cr3+дёҺAl3+зҡ„еҢ–еӯҰжҖ§иҙЁзӣёдјјгҖӮеңЁCr2(SO4)3жә¶ж¶ІдёӯйҖҗж»ҙеҠ е…ҘNaOHжә¶ж¶ІзӣҙиҮіиҝҮйҮҸпјҢеҸҜи§ӮеҜҹеҲ°зҡ„зҺ°иұЎжҳҜ_________гҖӮ (2)+6价铬зҡ„еҢ–еҗҲзү©жҜ’жҖ§иҫғеӨ§пјҢеёёз”ЁNaHSO3е°Ҷй…ёжҖ§еәҹж¶Ідёӯзҡ„Cr2O72вҲ’иҝҳеҺҹжҲҗCr3+пјҢиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә______________гҖӮ в…ЎгҖҒд»ҘзЎ…и—»еңҹдёәиҪҪдҪ“зҡ„дә”ж°§еҢ–дәҢй’’пјҲV2O5пјүжҳҜжҺҘи§Ұжі•з”ҹжҲҗзЎ«й…ёзҡ„еӮ¬еҢ–еүӮгҖӮд»Һеәҹй’’еӮ¬еҢ–еүӮдёӯеӣһ收V2O5ж—ўйҒҝе…ҚжұЎжҹ“зҺҜеўғеҸҲжңүеҲ©дәҺиө„жәҗз»јеҗҲеҲ©з”ЁгҖӮеәҹй’’еӮ¬еҢ–еүӮзҡ„дё»иҰҒжҲҗеҲҶдёәпјҡ
д»ҘдёӢжҳҜдёҖз§Қеәҹй’’еӮ¬еҢ–еүӮеӣһ收е·Ҙиүәи·Ҝзәҝпјҡ
пјҲ1пјүвҖңй…ёжөёвҖқж—¶V2O5иҪ¬еҢ–дёәVO2+пјҢеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә___________ пјҲ2пјүвҖңжІүй’’вҖқеҫ—еҲ°еҒҸй’’й…ёй“өпјҲNH4VO3пјүжІүж·ҖпјҢеҶҷеҮәвҖңз……зғ§вҖқдёӯеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ____________гҖӮ IIIгҖҒж°§еҢ–й”ҢдёәзҷҪиүІзІүжң«пјҢеҸҜз”ЁдәҺж№ҝз–№гҖҒзҷЈзӯүзҡ®иӮӨз—…зҡ„жІ»з–—гҖӮзәҜеҢ–е·Ҙдёҡзә§ж°§еҢ–й”Ң(еҗ«жңүFe(в…Ў), Mn(в…Ў), Ni(в…Ў)зӯүжқӮиҙЁ)зҡ„жөҒзЁӢеҰӮдёӢ:
еңЁжң¬е®һйӘҢжқЎд»¶дёӢпјҢNi(в…Ў)дёҚиғҪиў«ж°§еҢ–пјӣй«ҳй”°й…ёй’ҫзҡ„иҝҳеҺҹдә§зү©жҳҜMnO2пјҢеӣһзӯ”дёӢеҲ—й—®йўҳ: еҸҚеә”в‘ЎдёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә___________пјҢ___________гҖӮ В |
|||||||||||||||
- иҘҝи—ҸеұұеҚ—第дәҢй«ҳзә§дёӯеӯҰ2021еұҠй«ҳдёүдёҠеҚҠе№ҙ第дёүж¬ЎжңҲиҖғзҗҶз»јеҢ–еӯҰж— зәёиҜ•еҚ·е®Ңж•ҙзүҲ
- йӮ»ж°ҙе®һйӘҢеӯҰж Ўй«ҳдёҖеҢ–еӯҰдёӢеҶҢејҖеӯҰиҖғиҜ•жЁЎжӢҹиҖғиҜ•з»ғд№
- еұұдёңзңҒжөҺеҚ—еёӮз« дёҳеёӮ第дёҖдёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠеҶҢ12жңҲжңҲиҖғеҢ–еӯҰиҜ•еҚ·еңЁзәҝз»ғд№
- й»‘йҫҷжұҹзңҒе“Ҳе°”ж»ЁеёӮ第еҚҒдёүдёӯеӯҰ2020-2021е№ҙеәҰй«ҳдёҖдёҠеӯҰжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·
- еҚ—жҳҢеёӮ2019е№ҙй«ҳдәҢеҢ–еӯҰдёҠжңҹй«ҳиҖғжЁЎжӢҹзҪ‘дёҠеңЁзәҝеҒҡйўҳ
- йҮҚеәҶеёӮ第дёҖдёӯеӯҰ2020еұҠй«ҳдёү10жңҲжңҲиҖғзҗҶз»јеҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- е№ҝиҘҝжІіжұ еёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•еҲ·йўҳз»ғд№
- зӣҲжұҹеҺҝ第дёҖй«ҳзә§дёӯеӯҰй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•еңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ