2018吉林高一上学期人教版高中化学期末考试
| 1. | 详细信息 |
|
下列有关实验室一般事故的预防和处理方法正确的是 A.燃着的酒精灯打翻失火,应立即用水浇灭 B.为了使过滤速率加快,可用玻棒在过滤器中轻轻搅拌,加速液体流动 C.蒸发食盐溶液时,发生液滴飞溅现象,应立即加水冷却 D.皮肤上沾有少量浓硫酸,可立即用大量水冲洗
|
|
| 2. | 详细信息 |
|
下列物质的用途错误的是 A.硅是制造太阳能电池的常用材料 B.二氧化硅是制造光导纤维的材料 C.水玻璃可用作木材防火剂 D.硅是制取水泥的原料
|
|
| 3. | 详细信息 |
|
胶体区别于其他分散系的本质特征是 A.胶体的分散质能通过滤纸孔隙,而浊液的分散质不能 B.胶体能产生丁达尔现象 C.胶体分散质粒子直径在1~100 nm之间 D.胶体在一定条件下能稳定存在
|
|
| 4. | 详细信息 |
|
下列物质的分离方法不正确的是 A.用结晶的方法分离汽油和水 B.用过滤的方法除去氯化钠溶液中的泥沙 C.用重结晶的方法从含有少量氯化钠的硝酸钾溶液中提取硝酸钾 D.蒸馏法分离乙酸(沸点118)和乙酸乙酯(沸点77.1)
|
|
| 5. | 详细信息 |
|
下列叙述正确的是 A.熔融状态下或在水溶液中能自身电离出自由移动的离子的化合物是电解质 B.凡是在水溶液里和熔化状态下都不能导电的物质叫非电解质 C.能导电的物质一定是电解质 D.某物质若不是电解质,就一定是非电解质
|
|
| 6. | 详细信息 |
|
下列说法正确的是 A.6.02×1023个分子的体积约是22.4L B.0.5mol H2的体积为11.2L C.标准状况下,1mol H2O的体积为22.4L D.标准状况下,体积相同的气体所含的分子数相同
|
|
| 7. | 详细信息 |
|
下列反应的离子方程式书写正确的是 A.硫酸亚铁溶液中通入氯气 Fe2++Cl2=Fe3++Cl- B.碳酸镁跟稀硫酸反应:MgCO3+2H+=Mg2++H2O+CO2↑ C.石灰乳与稀盐酸反应OH-+H+= 2H2O D.稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
|
|
| 8. | 详细信息 |
|
某合金与铁的物理性质比较如下
(注:硬度以金刚石为10作标准,导电性以银的导电性100为标准) 已知某合金耐腐蚀、强度大.从以上性能看,该合金不适合制成 A.门窗框 B.炉具 C.导线 D.飞机外壳
|
|
| 9. | 详细信息 |
|
铝制品具有较强的抗腐蚀性,主要是因为 A.铝的化学性质稳定 B.铝在常温时与氧气不反应[www.sh C.铝具有金属性,也具有非金属性 D.铝与氧气反应生成一层致密的氧化物薄膜
|
|
| 10. | 详细信息 |
|
下列氯化物可由金属和氯气反应制得,也可由金属与盐酸制得的是 A. CuCl2 B. FeCl2 C. FeCl3 D.MgCl2
|
|
| 11. | 详细信息 |
|
下列关于液氯和氯水的叙述中正确的是 A.液氯较氯水的漂白作用更强 B.液氯与氯水均有酸性 C.液氯是纯净物,氯水是混合物 D.液氯是无色的,氯水呈黄绿色
|
|
| 12. | 详细信息 |
|
能证明某溶液中含有氯化钠的是 A.焰色反应是黄色 B.溶液有咸味 C.取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀 D.既出现A中的现象,又出现C中的现象
|
|
| 13. | 详细信息 |
|
对Ⅰ~Ⅳ的实验操作现象判断正确的是
A.实验Ⅰ:产生红褐色沉淀 B.实验Ⅱ:溶液颜色变红 C.实验Ⅲ:放出大量气体 D.实验Ⅳ:先出现白色沉淀,后沉淀又溶解
|
|
| 14. | 详细信息 |
|
.下列叙述正确的是 A.Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 B.Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 C.钠在常温下不容易被氧化 D.Na2O2可作供氧剂,而Na2O不行
|
|
| 15. | 详细信息 |
|
将少量金属钠分别投入下列物质中,有气体放出,且溶液质量减轻的是 A.H2SO4 B.CuSO4 C.KNO3 D.KOH
|
|
| 16. | 详细信息 |
|
.下列反应的离子方程式书写正确的是 A. 氯气溶于水: B. 将铝粉投入氢氧化钠溶液中: C. 铜与氯化铁溶液反应: D. 过氧化钠与水反应:
|
|
| 17. | 详细信息 |
|
向物质的量浓度均为1 mol·L-1的AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液,下图[n表示Al(OH)3的物质的量、V表示NaOH溶液的体积]能正确表示这个反应过程的是
|
|
| 18. | 详细信息 |
|
|
|
| 19. | 详细信息 |
|
下列各组离子在溶液中能大量共存的是 A.Na+、Al3+、Cl-、 C.Ca2+、Na+、
|
|
| 20. | 详细信息 |
|
将9g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通 过足量的Na2O2固体,Na2O2固体增加的质量为 A.8g B.9g C.12g D.13.5g
|
|
| 21. | 详细信息 |
|
下列情况会对人体健康造成较大危害的是 A、自来水中通入少量Cl2进行消毒杀菌 B、用SO2漂白食品 C、用食醋清洗热水瓶胆内壁附着的水垢 D、用小苏打发酵面团制作馒头
|
|
| 22. | 详细信息 |
|
下列变化中,属于还原反应的是 A.Cl-→Cl2 B.FeCl2→FeCl3 C.C→CO2 D. KMnO4→MnO2
|
|
| 23. | 详细信息 |
|
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入 NaOH溶液体积的关系如下图所示,由此确定,原溶液中含有的阳离子是
A. Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+ C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
|
|
| 24. | 详细信息 |
|
除去Na2CO3 固体中少量NaHCO3的最佳方法是 A.加入适量盐酸 B.加热 C.加入NaOH溶液 D.配成溶液后通入CO2
|
|
| 25. | 详细信息 |
|
有NaCl、FeCl2、FeCl3、MgCl2、AlCl3、NH4Cl六种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是 A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
|
|
| 26. | 详细信息 |
|
(1)下列物质能导电的是________;属于碱的是________;属于非电解质的是 ①HCl气体 ②Ca(OH)2固体 ③KNO3固体 ④SO2 ⑤KNO3溶液 (2)某化学反应的反应物和产物如下: Al+NaNO3+H2O―→Al(OH)3+N2↑+NaAlO2 a.该反应的氧化剂是__________________________; b.该反应的氧化产物是________________________;
|
|
| 27. | 详细信息 |
|
(1)在下列反应中:A.2F2+2H2O=4HF+O2 B.2Na+2H2O=2NaOH+H2↑ C.3NO2+H2O=2HNO3+NO D.2H2O 其中水只作氧化剂的是 ,水只作还原剂的是 ,水既作氧 化剂又作还原剂的是 ,水既不作氧化剂又不作还原剂的是 (2)新制氯水中含有多种成分:将紫色石蕊试液滴入氯水中,溶液显红色,起作用的成 分是 ;过一会儿,溶液的颜色逐渐褪去,起作用的成分 是 ;往氯水中滴入硝酸银溶液,产生白色沉淀,起作用的成分 是 ;氯水能使淀粉碘化钾试纸变蓝,起作用的成分是 。 (3)将过量的二氧化碳气体通入烧碱溶液中,然后将反应后的溶液分成二等份,分别加 入与所得溶液溶质等物质的量的硝酸、氢氧化钙溶液。请分别写出发生反应的离子 方程式: ① 。 ② 。
|
|
| 28. | 详细信息 | ||
|
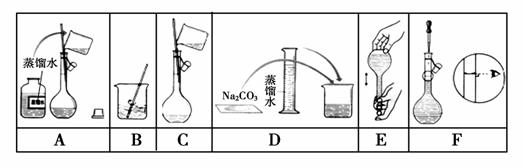
下图是某小组同学配制100 mL 0.100 mol·L-1Na2CO3溶液的一些关键步骤和操作图。
(1)配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、_________、___________。 (2)配制过程的先后顺序为(用字母A~F填写)________。 (3)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将________(填“偏 高”、“偏低”、“不变”);步骤F称为________,如果俯视刻度线,配得溶 液的浓度将________(填“偏高”、“偏低”、“不变”)。 化学试题 第6页(共6页) 浓度会________(填“偏高”、“偏低”、“不变”)。 (5)若配制NaOH 溶液,在步骤B之后,需________,才进行下一步操作。
|
|||
| 29. | 详细信息 |
|
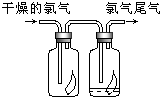
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用 溶液吸收多余的氯气,原理是(用化学方程式表示)______________________________。 (3)根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是__________(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是__________(用字母代号填)。 A.O2 B.H2 C.CO2 D.HClO
|
|
| 30. | 详细信息 |
|
在实验室里,某同学取一小块金属钠做钠与水反应的实验。试完成下列问 题: (1)切开的金属钠暴露在空气中,最先观察到的现象是_____________________,所 发生反应的化学方程式是____________ 。 (2)将钠投入水中后,钠熔化成一个小球,根据这一现象你能得出的结论是 ①____________________________ ,②_____________________________ 。 将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是_____ _。 A.有气体生成 B.钠熔化成小球并在液面上游动 C.烧杯底部有银白色的金属钙生成 D.溶液变浑浊 (3)钠与水反应的离子方程式为___________________________。 (4)根据上述实验过程中钠所发生的有关变化,试说明金属钠保存在煤油中的目的是 __________________________。
|
|