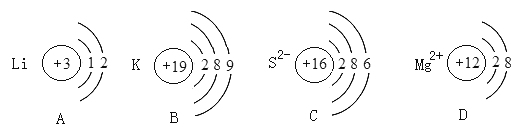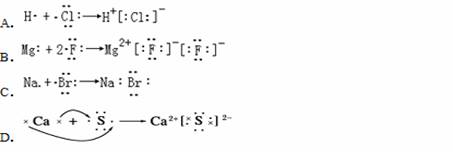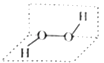2018安徽高一下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列有关原子或离子的结构示意图正确的是 ( )
A. A B. B C. C D. D
|
|
| 2. | 详细信息 |
|
在元素周期表的金属元素和非金属元素交界处,最容易找到的材料是( )
|
|
| 3. | 详细信息 |
|
关于现行的元素周期表的说法正确的是( )
|
|
| 4. | 详细信息 |
|
下列气态氢化物最稳定的是( )
|
|
| 5. | 详细信息 |
|
X、Y代表两种非金属元素,下列不能说明非金属性X比Y强的是( )
|
|
| 6. | 详细信息 |
|
下列元素中,属于第二周期VIA族的是( )
|
|
| 7. | 详细信息 |
|
不能作为判断氯、磷两种元素非金属性强弱的依据的是( )
|
|
| 8. | 详细信息 | ||||||||||||||||||
|
5种短周期元素L-T的信息如下表,有关叙述正确的是( )
A.沸点:H2T>H2R B.热稳定性:H2T<H2R C.与稀盐酸反应的剧烈程度:L单质<Q单质 D.L2+与R2-的核外电子数相等
|
|||||||||||||||||||
| 9. | 详细信息 |
|
下列递变规律不正确的是( ) A. Na、Mg、Al的还原性依次减弱 B. I、Br、Cl的非金属性性依次增强 C. C、N、O 的原子半径依次增大 D. P、S、Cl的最高正化合价依次升高
|
|
| 10. | 详细信息 | |||||
|
A、B、C、D、E五种元素同周期,且从左到右按原子序数的递增(原子序数为五个连续的自然数)的顺序排列如下:
下列说法正确的是( ) A.若HnCOm为强酸,则D元素肯定是活泼的非金属元素 B.若A(OH)n为强碱,则B(OH)m也一定为强碱 C.若C的最高正化合价为+5价,则五种元素均为非金属元素 D.若D的最低负化合价为-2价,则E的最高正价为+6价
|
||||||
| 11. | 详细信息 |
|
.下列相关关系正确的是( ) A. 热稳定性:H2O>HF>H2S B. 原子半径:Na>Mg>O C. 酸性:H3PO4>H2SO4>HClO4 D. 离子半径:Cl->S2->K+
|
|
| 12. | 详细信息 |
|
下列关于元素周期表的说法正确的是( )。 A. 能生成碱的金属元素都在第ⅠA族 B. 原子序数为14的元素位于元素周期表的第三周期第ⅣA族 C. 稀有气体元素原子的最外层电子数均为8 D. 第二周期第ⅣA族元素的原子核电荷数和中子数一定为6
|
|
| 13. | 详细信息 |
|
下列表示电子式的形成过程正确的是( )
|
|
| 14. | 详细信息 |
|
下列各组顺序的排列正确的是( ) A. 最高正化合价:F>O>N>C B.离子半径:F->O2->Na+>Al3+ C. 热稳定性:PH3<H2S<HCl<HF D. 单质的还原性:Al>Mg>Na>K
|
|
| 15. | 详细信息 |
|
.下列关于化学键的说法不正确的是( ) A.并不是所有物质都含有化学键 B.只有非金属原子间才能形成共价键 C.单质不可能含有离子键 D.共价化合物中不可能含有离子键
|
|
| 16. | 详细信息 |
|
下列表示物质结构的化学用语正确的是( ) A.苯分子的比例模型: B.HF的电子式:H:F C.Cl-离子的结构示意图: D.NH4Cl的电子式:
|
|
| 17. | 详细信息 |
|
根据元素周期表和元素周期律分析,下列推断中错误的是( ) A. 铍的原子失去电子能力比镁弱 B. 砹的氢化物不稳定 C. 硒化氢比硫化氢稳定 D. 氢氧化锶比氢氧化钙的碱性强
|
|
| 18. | 详细信息 |
|
下列各项中表达正确的是( ) A. H、D、T表示同一种核素 B. F的结构示意图 C. Na2O的电子式 D. MgCl2的形成过程
|
|
| 19. | 详细信息 |
|
.门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是( ) A. X单质不易与水反应 B. XO2可被碳或氢还原为X C. XCl4的沸点比SiCl4的高 D. XH4的稳定性比SiH4的高
|
|
| 20. | 详细信息 |
|
X、Y和Z是短周期元素组成的三种单质,X的组成元素是第三周期原子半径最大的元素;Y和Z均由元素R组成,Y由两个原子组成,R最外层电子数是内层电子数的3倍,下列推断正确的是( ) A.Y和Z互为同位素 B.X和Y能化合成两种化合物 C.X和Y化合的产物中一定不含有共价键 D.X离子比R的离子半径大
|
|
| 21. | 详细信息 |
|
下列叙述中,能说明金属a的活泼性肯定比金属b的活泼性强的是( ) A. a原子的最外层电子数比B原子的最外层电子数少 B. a原子电子层数比b原子的电子层数多 C. 1mol a 从酸中置换H+生成的H2比1 mol b从酸中置换H+生成的H2多 D. 常温时,a能从水中置换出氢,而b不能
|
|
| 22. | 详细信息 |
|
元素周期表中的位置反映了元素的性质。第三周期元素中,得电子能力最强的是( ) A. Na B. Si C. S D. Cl
|
|
| 23. | 详细信息 |
|
当镁原子由1s22s22p63s2→1s22s22p63p2时,以下认识正确的是 A. 镁原子由基态转化成激发态,这一过程中吸收能量 B. 镁原子由激发态转化成基态,这一过程中释放能量 C. 转化后位于p能级上的两个电子处于同一轨道,且自旋状态相同 D. 转化后镁原子与硅原子电子层结构相同,化学性质相似
|
|
| 24. | 详细信息 |
|
过氧化氢(H2O2)被称为绿色氧化剂,其分子结构如图所示.两个氢原子位于不重合的两个平面上,而两个氧原子位于两平面的交线上.下列有关说法正确的是( )
|
|
| 25. | 详细信息 |
|
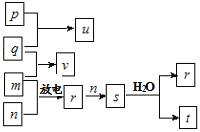
短周期主族元素a、b、c、d的原子序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是元素d、a、b、c的气体单质,p和s均为有色气体,v的水溶液呈碱性。常温下,0.1mol/L t溶液与0.1mol/L u溶液的pH 均为1。
下列说法正确的是( ) A. v能分别与u、t反应生成离子化合物 B. 元素的非金属性:b>c>a C. 原子半径:b<c<d D. d的氧化物对应的水化物均为强酸
|
|
| 26. | 详细信息 |
|
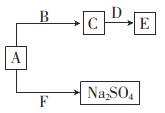
已知五种短周期元素在周期表中的相对位置如图所示。
(1)表中五种元素金属性最强的元素为_______(填元素符号),c、e两元素形成的离子化合物c2e的电子式为___________。 (2)c、d、e三种元素的简单离子中,半径最小的是________(用元素符号表示)。 (3)b、e两元素分别与a形成的最简单气态化合物的稳定性的关系为____________(用化学式表示)。 (4)已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成。它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体。
① 写出物质E的化学式:_________。 ②写出A与F反应的化学方程式:_____________________。
|
|
| 27. | 详细信息 |
|
现有A、B、C、D、E五种原子序数依次增大的短周期元素,其中在所有的短周期元素中,A的原子半径与D的原子半径之比最小(不包括稀有气体),C与A、B、D均能形成多种常见化合物,B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐,化合物AE常温下为气体。回答下列问题: (1)A分别与B、C形成的最简单化合物中,稳定性 > (用分子式表示),其中A与B形成的最简单化合物分子的空间构型为 ; (2)化合物甲、乙均是由上述五种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1∶1∶1,其中乙是某种家用消毒液的有效成分,则化合物甲的电子式为 。 (3)化合物丙由C和D两种元素组成,其中C和D的原子个数比为1∶1,则丙中含有的化学键类型是 ; (4)B元素的最高价氧化物对应的水化物与其氢化物反应生成的盐的水溶液呈 性(填“酸”、“碱”或“中”),用离子方程式解释原因 ; (5)写出实验室制取单质E的离子方程式是 。
|
|
| 28. | 详细信息 |
|
短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1∶1和2∶1的两种液态化合物;E单质用于净化水质。请回答: (1)E的原子结构示意图是__________________。 下列可以验证C与D两元素非金属性强弱的实验事实是___________ (填写编号)。 A.比较这两种元素的气态氢化物的沸点 B.比较只有这两种元素所形成的化合物中的化合价 C.比较这两种元素的气态氢化物的稳定性 (2)由A、B两种元素组成的最简单的化合物,写出其电子式____。 (3)均由A、B、C、D四种元素组成的某无机化合物,既可以与盐酸反应又可以与NaOH溶液反应,其化学式为______________________。 (4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下: ①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式________________________________。 ②上述反应生成的两种碱继续作用,得到Fe3O4。写出该反应的化学方程式_____________。
|
|