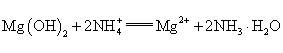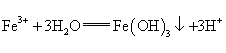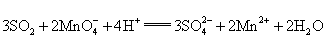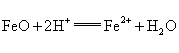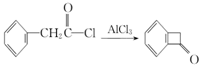2020江西高三上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
《本草图经》中关于绿矾的分解有如下描述:“绿矾形似朴消(Na2SO4·10H2O)而绿色,取此物置于铁板上,聚炭,封之囊袋,吹令火炽,其矾即沸,流出,色赤如融金汁者是真也。”对此段 话的说明中肯定错误的是( ) A.绿矾的化学式为FeSO4·7H2O B.绿矾分解过程中没有发生电子的转移 C.“色赤”物质可能是Fe2O3 D.流出的液体中可能含有硫酸
|
|
| 2. | 详细信息 |
|
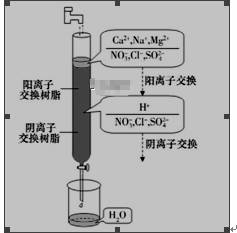
离子交换法净化水过程如图所示。下列说法错误的是( )
A.水中的NO3—、SO42—、Cl—通过阴离子树脂后被除去 B.经过阳离子交换树脂后,水中阳离子的总数不变 C.通过净化处理后,水的导电性降低 D.阴离子树脂填充段存在反应H++OH—==H2O
|
|
| 3. | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列有关叙述正确的是 A.44 g由CO2和N2O组成的混合气体中含有的氧原子数为2NA B.pH=1的H3PO4溶液中,含有0.1NA个H+ C.12 g Mg在空气中完全燃烧生成MgO和Mg3N2,转移电子数为NA D. 0.1mol白磷(P4)或四氯化碳中所含的共价键数目均为0.4NA
|
|
| 4. | 详细信息 |
|
根据下表提供的数据可知,在溶液中能大量共存的微粒组是( )
A. H2CO3,HCO3﹣,CH3COO﹣,CN﹣ B. HCO3﹣,CH3COOH,CN﹣,CO32﹣ C. HCN,HCO3﹣,CN﹣,CO32﹣ D. HCN,HCO3﹣,CH3COO﹣,CN﹣
|
|
| 5. | 详细信息 |
|
氮化铝(AlN)是一种重要的无机非金属原料,常温下可发生反应:AlN+NaOH+H2O
A.量气管中的液体应为水 B.用长颈漏斗代替分液漏斗,有利于控制反应速率 C.反应结束时,a、b两管液面的差值即为产生气体的 体积 D.若其他操作均正确,实验结束时按乙图读数,测出的气体体积偏大
|
|
| 6. | 详细信息 |
|
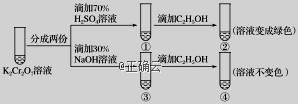
K2Cr2O7溶液中存在平衡:Cr2O72- (橙色)+H2O⇋2CrO42- (黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄 C.对比②和④可知K2Cr2O7酸性溶液氧化性强 B.②中Cr2O72- 被C2H5OH还原 D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
|
|
| 7. | 详细信息 |
|
在混合体系中,下列反应先后顺序判断正确的是( ) A. 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-,Br-,Fe2+ B. 在含等物质的量的Fe3+,Cu2+、H+的溶液中加入Zn:Fe3+,Cu2+、H+、Fe2+ C. 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:KOH,Ba(OH)2,BaCO3、 K2CO3 D. 在含等物质的量的AlO2-、OH-,CO32-溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH- 、 CO32-
|
|
| 8. | 详细信息 |
|
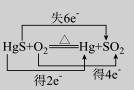
汞(熔点-39℃,沸点356℃)是制造电池、电极的重要原料,历史上曾用“灼烧辰砂法”制取汞.目前工业上制粗汞的一种流程图如下.
A.洗涤粗汞可用5%的盐酸代替5%的硝酸 B.辰砂与氧化钙加热反应时, C.“灼烧辰砂法”过程中电子转移的方向和数目可表示为: D.减压蒸馏的目的是降低汞的沸点,提高分离效率
|
|
| 9. | 详细信息 | |||||||||||||||
|
下列离子方程式能用来解释相应实验现象的是( )
|
||||||||||||||||
| 10. | 详细信息 |
|
肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图。已知200℃时:反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=−32.9 kJ·mol−1;反应Ⅱ:N2H4(g)+H2(g)=2NH3(g) ΔH2=−41.8 kJ·mol−1, 下列说法不正确的是( )
A.图所示过程①是放热反应 B.反应Ⅱ的能量过程示意图如图所示 C.断开3 mol N2H4(g)的化学键吸收的能量大于形成1 molN2(g)和4 mol NH3(g)的化学键释放的能量 D.200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)=N2(g)+2H2(g) ΔH=+50.7 kJ·mol−1
|
|
| 11. | 详细信息 |
|
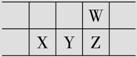
今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( ) A.原子半径:W<X B.常温常压下,Y单质为固态 C.气态氢化物热稳定性:Z<W D.X的最高价氧化物的水化物是强碱
|
|
| 12. | 详细信息 |
|
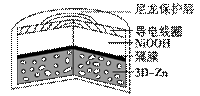
为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D−Zn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高 B.充电时阳极反应为Ni(OH)2(s)+OH−(aq)−e− C.放电时负极反应为Zn(s)+2OH−(aq)−2e− D.放电过程中OH−通过隔膜从负极区移向正极区
|
|
| 13. | 详细信息 |
|
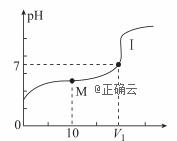
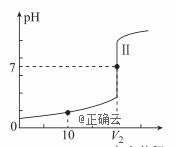
(1)用
①滴定醋酸的曲线是________(填“Ⅰ”或“Ⅱ”). ② (2)25℃时,
|
|
| 14. | 详细信息 |
|
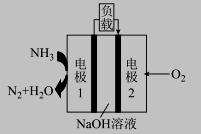
氮、磷及其化合物在科研及生产中均有着重要的应用. (1)室温下,0.1 mol/L的亚硝酸HNO2、次氯酸的电离常数Ka分别为: (2)羟胺NH2OH可看成是氨分子内的1个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性.已知NH2OH在水溶液中呈弱碱性的原理与NH3水溶液中相似,请用电离方程式表示其原因_____ _ (3)亚硝酸钠与氯化钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生一种红棕色刺激性气味气体和一种无色气体,其中的无色气体遇到空气会呈红棕色,该反应的离子方程式为_______________________________________. (4)某液氨一液氧燃料电池示意图如下,该燃料电池的工作效率为50%,现用作电源电解500ml的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3mol/L,则该过程中消耗氨气的质量为________(假设溶液电解前后体积不变).
|
|
| 15. | 详细信息 |
|
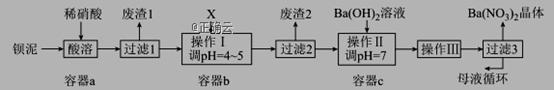
钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:
已知:ⅰ.Fe(HO)3和Fe(HO)2完全沉淀时,溶液的pH分别为3.2和9.7. ⅱ. Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小. ⅲ. (1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和BaCO3溶液中,充分搅拌,过滤,洗涤.用离子方程式说明提纯原理:__________________________________. (2)上述流程酸溶时, Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为:________________ (3)该厂结合本厂实际,选用的X为________(从下列选项中选择); ① 废渣2为______________________________________(写出化学式). (4)过滤3后的母液应循环到容器________中.(填“a”、“b”或“c”) (5)称取w g晶体溶于蒸馏水,加人足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为________.
|
|
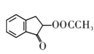
| 16. | 详细信息 |
|
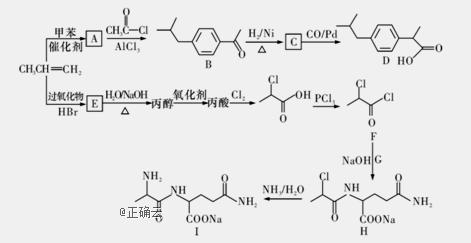
以丙烯为原料合成抗炎药物D和机体免疫增强制剂I的合成路线如图所示(部分反应条件和产物已经略去):
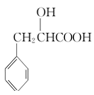
请回答下列问题: (1)由丙烯生成A的反应类型为_____; (2)D中官能团的名称为_________; (3)化合物G的化学式为C5H10O3N2,则其结构简式为________; (4)A→B反应的化学方程式为__________; (5)A的同分异构体中属于苯的同系物(不包含)的共有______(不考虑立体异构)种,其中核磁共振氢谱有四组峰的且苯环上只有一个取代基的结构简式是________; (6)已知:
|
|