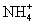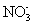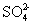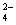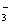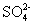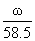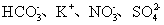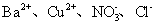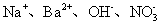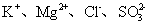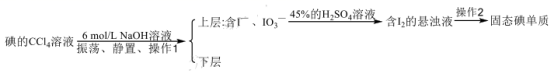四川省2020-2021学年高一上学期期中考试化学试题含解析
| 1. | 详细信息 |
|
学好化学,提高生活质量。下列说法不正确的是 A . 腌制咸鸭蛋利用了半透膜的渗析原理 B . 夏日的傍晚常常看到万丈霞光穿云而过美不胜收与胶体的性质有关 C . 病人在服用胃舒平 ( 主要成分为氢氧化铝 ) 期间可以多吃酸性食物 D . 食物腐败、植物光合作用都与氧化还原反应有关 |
|
| 2. | 详细信息 |
|
进行化学实验时应强化安全意识。对下列事故或药品的处理正确的是 A . 酒精不小心洒在实验桌上,并燃烧起来,应立即用水扑灭 B . 金属钠着火时用泡沫灭火器灭火 C . 不慎将浓碱溶液沾在皮肤上,要立即用硫酸或盐酸冲洗 D . 实验室做钠的实验时,余下的钠屑放回原试剂瓶 |
|
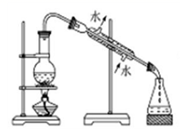
| 3. | 详细信息 | |||||||||||||||
|
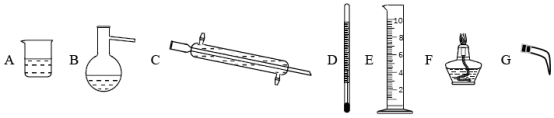
完成下列实验所需选择的装置或仪器都正确的是
A . A B . B C . C D . D |
||||||||||||||||
| 4. | 详细信息 |
|
下列实验操作中正确的是 A . 进行蒸发操作时,待混合物中的水分完全蒸干后,及时熄灭酒精灯 B . 进行蒸馏操作时,应使温度计水银球伸入液面下 C . 进行蒸馏操作时,应弃去达到被提纯液体沸点前蒸出的馏分 D . 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
|
| 5. | 详细信息 |
|
不规范的实验操作会导致实验结果的误差,下列关于误差分析的判断正确的是 A . 用浓硫酸配制稀硫酸时,量筒量取浓硫酸仰视会使所配溶液浓度偏高 B . 用托盘天平称取药品时药品和砝码位置颠倒药品质量一定偏低 C . 配制 1 mol·L -1 的 NaOH 溶液时未恢复至室温就转移并定容会使所得溶液浓度偏低 D . 容量瓶内壁附有水珠而未干燥处理就直接用于配制,会使所配溶液浓度偏低 |
|
| 6. | 详细信息 |
|
下列说法正确的是 A . 可使用 250mL 容量瓶分两次完成 490mL 该浓度的 BaCl 2 溶液的配制 B . 20gNaOH 溶于 1L 水,可配得 0.5mol/LNaOH 溶液 C . 5mL0.3mol/LNa 2 SO 4 溶液和 5mL0.6mol/LNaNO 3 溶液 Na + 物质的量浓度相等 D . 100mL0.1mol/L 硫酸溶液中含有的氢离子数约为 6.02×10 21 |
|
| 7. | 详细信息 | |||||||||||||||||||||||||
|
下列物质分类正确的是
A . A B . B C . C D . D |
||||||||||||||||||||||||||
| 8. | 详细信息 |
|
下列说法正确的是 A . 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 B . 直径介于 1nm ~ 100nm 之间的微粒不能称为胶体 C . 1mol 饱和 FeCl 3 滴入沸水中转化为氢氧化铁胶体后能生成 N A 个胶粒 D . 电泳现象证明某些胶体是带电的 |
|
| 9. | 详细信息 |
|
下列各组离子在指定溶液中一定能大量共存的是 A . 碳酸钠溶液中: B . 能使酚酞变红的溶液中: Na + 、 Ba 2+ 、 Cl - 、 C . 与铝反应产生无色无气味气体的溶液中: Na + 、 K + 、 D . 常温下 pH=1 的溶液中: K + 、 Fe 2+ 、 |
|
| 10. | 详细信息 |
|
下列离子方程式书写正确的是 A . 铁与 H 2 SO 4 溶液反应: 2Fe+6H + =2Fe 3+ +3H 2 ↑ B . 碳酸银加入稀硝酸中,有气泡产生: Ag 2 CO 3 +2H + =2Ag + +CO 2 ↑+H 2 O C . 碳酸钡与盐酸: D . 硫酸溶液与氢氧化钡溶液反应: H + + |
|
| 11. | 详细信息 |
|
重金属离子具有毒性。实验室中有甲、乙两种重金属离子的废液,甲废液经化验呈碱性,主要为有毒离子为 Ba 2 + ,如将甲、乙两废液按一定比例混合,毒性明显降低。则乙废液中可能含有的离子是 A . Cu 2 + 和 SO |
|
| 12. | 详细信息 |
|
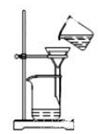
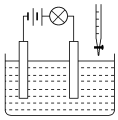
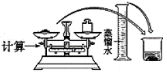
在做溶液导电性的实验装置中盛一定量的 CuSO 4 溶液,此时通电,灯泡发光,再不断地加入某种物质,会发现灯泡逐渐变暗,直至熄灭,持续加入该物质灯泡会再次逐渐变亮,据此分析加入的物质是 A . Zn 粒 B . BaCl 2 溶液 C . KOH 溶液 D . Ba ( OH ) 2 溶液 |
|
| 13. | 详细信息 |
|
下列有关氧化还原反应的叙述正确的是 A . 金属单质在氧化还原反应中只能作还原剂,非金属单质只能作氧化剂 B . 化合物中某元素处于最高价,则该元素只能被还原 C . 失电子越多的还原剂,其还原性越强 D . 在氧化还原反应中,有一种元素被氧化,肯定有另一种元素被还原 |
|
| 14. | 详细信息 |
|
下列说法不正确的是 A . 复分解反应一定不是氧化还原反应 B . 置换反应一定是氧化还原反应 C . 有单质参加的反应一定是氧化还原反应 D . 有单质生成的分解反应一定是氧化还原反应 |
|
| 15. | 详细信息 |
|
下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是 A . CaO + H 2 O = Ca(OH) 2 B . 3NO 2 + 2H 2 O = 2HNO 3 +NO C . 2H 2 O |
|
| 16. | 详细信息 |
|
对反应 Al 2 O 3 +N 2 +3C A . Al 2 O 3 是氧化剂, C 是还原剂 B . CO 是氧化产物 C . AlN 中氮元素的化合价为 +3 D . N 2 发生了氧化反应 |
|
| 17. | 详细信息 |
|
根据反应 (1) ~ (4), 可以判断下列 4 个物质的氧化性由强到弱的正确顺序是 (1)Cl 2 +2KI=2KCl+I 2 (2)2FeCl 2 +Cl 2 =2FeCl 3 (3)2FeCl 3 +2HI=2FeCl 2 +2HCl+I 2 (4)H 2 S+I 2 =S+2HI A . S > I 2 > Fe 3+ > Cl 2 B . Cl 2 > Fe 3+ > I 2 > S C . Fe 3+ > Cl 2 > S > I 2 D . Cl 2 > I 2 > Fe 3+ > S |
|
| 18. | 详细信息 |
|
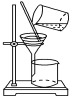
人类的生活与生产离不开金属。下列对金属的利用不是由金属的活动性决定的是( ) A . 用铁回收含银废液中的银 B . 用锌与稀硫酸反应制取氢气 C . 用金银制作具有保存价值的物品 D . 用铝合金制作门窗框架 |
|
| 19. | 详细信息 |
|
下列关于金属铝的叙述 不正确 的是 A . 铝是地壳中含量最多的金属元素 B . 铝是比较活泼的金属,在化学反应中容易失去电子,表现出还原性 C . 铝箔在空气中用酒精灯加热可以熔化,且发生剧烈燃烧 D . 铝箔在空气中用酒精灯加热可以观察到铝熔化了但并不滴落。 |
|
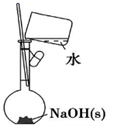
| 20. | 详细信息 | |||||||||||||||
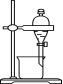
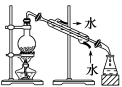
|
已知 Fe(OH) 3 为红褐色,下列关于钠的反应现象的叙述中,不正确的是
A . A B . B C . C D . D |
||||||||||||||||
| 21. | 详细信息 |
|
下列说法不正确的是( ) A . Na 2 O 2 可以作为呼吸面具或潜水艇里的氧气来源 B . 将 Na 2 O 加到酚酞溶液中,溶液先变红色后褪色 C . 可用水来检验某 Na 2 O 样品中是否含有 Na 2 O 2 D . 过氧化钠为淡黄色固体粉末 |
|
| 22. | 详细信息 |
|
设 N A 代表阿佛加德罗常数的值,下列说法正确的是 A . 6.4g 铜与足量稀硫酸反应生成氢气转移的电子数为 0.2N A B . 0.5molNO 2 与 11.2LO 3 所含的分子数均为 0.5N A C . 1molNa 与足量 O 2 反应,生成 Na 2 O 和 Na 2 O 2 混合物,钠得到电子总数为 N A D . 101kPa 、 4℃ 时, 18mL 水和 202kPa 、 27℃ 时 32gO 2 所含分子数均为 N A |
|
| 23. | 详细信息 |
|
Na 、 Mg 、 Al 分别与足量的稀盐酸反应,同温同压下,产生气体的体积相等,则 Na 、 Mg 、 Al 物质的量之比为 A . 1:2:3 B . 3:2:1 C . 6:3:2 D . 1:1:1 |
|
| 24. | 详细信息 |
|
高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,离子方程式如下 ( 未配平 ) : A . B . Mn 2+ 的还原性弱于 Fe 2+ C . 离子方程式中按物质顺序的化学计量数是: 1 、 5 、 8 、 1 、 5 、 4 D . 生成 1mol 水时,转移 2.5mol 电子 |
|
| 25. | 详细信息 |
|
黄铁矿( FeS 2 ,铁为 +2 价)与硝酸反应的产物有 Fe(NO 3 ) 3 和 H 2 SO 4 ,若反应中 FeS 2 和 HNO 3 物质的量之比是 1 ∶ 8 ,则 HNO 3 的还原产物及 1molFeS 2 反应时转移的电子数分别是 A . NO 2 8N A B . N 2 O 3 16N A C . N 2 O 32N A D . NO 15N A |
|
| 26. | 详细信息 |
|
在我们的日常生活中出现了 “ 加碘食盐 ” 、 “ 增铁酱油 ” 、 “ 高钙牛奶 ” 、 “ 富硒茶叶 ” 、 “ 含氟牙膏 ” 等商品这里的 “ 碘、铁、钙、硒、氟 ” 应理解为 A . 单质 B . 元素 C . 分子 D . 氧化物 |
|
| 27. | 详细信息 |
|
进行化学实验必须注意安全,下列几种处理事故的方法正确的是 ①金属钠着火时不能用水灭火 ②氢氧化钠固体洒落到地板上立即用水冲洗 ③不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 ④浓碱滴到皮肤上,先用水冲洗,再涂上 3%-5% 的硼酸溶液 A . ①② B . ②④ C . ①③④ D . ②③④ |
|
| 28. | 详细信息 |
|
下列实验操作正确的是( ) A . 制取少量蒸馏水 |
|
| 29. | 详细信息 |
|
下列实验操作中错误的是( ) A . 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 B . 蒸馏时,应使温度计的水银球靠近蒸馏烧瓶的瓶底 C . 过滤时,玻璃棒在引流过程中应放在三层滤纸处 D . 称量时,称量物放在称量纸上,置于托盘天平左盘,砝码放在托盘天平右盘的称量纸上 |
|
| 30. | 详细信息 |
|
下列操作会导致配制的溶液浓度偏小的是 A . 颠倒摇匀后发现凹液面低于刻度线又加水补上 B . 加水定容时俯视刻度线 C . 容量瓶内壁附有水珠而未干燥处理 D . 使用的砝码已生锈 |
|
| 31. | 详细信息 |
|
对 1mol/L 的 BaCl 2 溶液的有关叙述中,正确的是 A . 该溶液中 Cl - 浓度为 2mol/L B . 该溶液中 Ba 2+ 的物质的量是 1mol C . 可使用 500mL 容量瓶完成 100mL 该浓度的 BaCl 2 溶液的配制 D . 将 208gBaCl 2 固体溶解在 1L 水中,形成的溶液的浓度为 1mol/L |
|
| 32. | 详细信息 |
|
下列各组物质,按化合物、单质、混合物顺序排列的是 ( ) 。 A . 烧碱、液态氧、碘酒 B . 生石灰、白磷、熟石灰 C . 干冰、铁、氯化氢 D . 空气、氮气、胆矾 |
|
| 33. | 详细信息 |
|
下列说法正确的是 A . 可利用过滤的方法区别溶液和胶体 B . 制备 Fe(OH) 3 胶体通常是将 Fe(OH) 3 固体溶于沸水 C . 溶液、胶体、浊液的本质区别是分散剂粒子直径的大小 D . 在胶体的电泳实验中,带正电荷的胶粒将会朝着连接电源的负极一端移动 |
|
| 34. | 详细信息 |
|
下列各组离子在无色透明的酸性溶液中能大量共存的是 A . Mg 2+ 、 Al 3+ 、 SO C . Na + 、 Cl - 、 K + 、 Cu 2+ D . Na + 、 HCO |
|
| 35. | 详细信息 |
|
下列离子方程式书写正确的是 A . 醋酸溶液与碳酸氢钠溶液反应: H + +HCO B . 铜与氯化铁溶液反应: Cu+Fe 3+ =Cu 2+ + Fe 2+ C . CO 2 的尾气处理: CO 2 +2OH - =CO D . 铜粉与稀硫酸反应: 2Cu+2H + =Cu 2+ +H 2 ↑ |
|
| 36. | 详细信息 |
|
某河道两旁有甲乙两厂。它们排放的工业废水中 ( 均无沉淀 ) ,共含 K + 、 Ag + 、 Fe 3+ 、 C1 - 、 OH - 、 NO 3 - 六种离子。甲厂的废水明显呈碱性,请问乙厂的废水中含有几种离子? A . 1 B . 2 C . 3 D . 4 |
|
| 37. | 详细信息 |
|
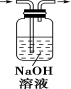
在电解质溶液的导电性装置 (如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是 A . 盐酸中逐滴加入食盐溶液 B . 硫酸中逐滴加入氢氧化钠溶液 C . 石灰乳中逐滴加入稀盐酸 D . 硫酸中逐滴加入氢氧化钡溶液 |
|
| 38. | 详细信息 |
|
下列有关氧化还原反应的叙述中,正确的是 A . 在氧化还原反应中,物质失去的电子数越多,其还原性越强 B . 阳离子只具有氧化性,阴离子只具有还原性 C . 在氧化还原反应中不一定所有元素的化合价都发生改变 D . 氧化剂被还原,化合价升高 |
|
| 39. | 详细信息 |
|
下列说法中正确的是 A . 化合反应一定氧化还原反应 B . 置换反应一定氧化还原反应 C . 分解反应一定氧化还原反应 D . 复分解反应一定氧化还原反应 |
|
| 40. | 详细信息 |
|
下列反应属于非氧化还原反应的是 A . Fe 2 O 3 + 3CO B . NH 4 NO 3 C . 2FeCl 2 +Cl 2 =2FeCl 3 D . Cu 2 (OH) 2 CO 3 |
|
| 41. | 详细信息 |
|
ClO 2 是一种高效杀菌剂。工业上可通过以下反应制得 ClO 2 : 2NaClO 3 +Na 2 SO 3 +H 2 SO 4 =2ClO 2 ↑+2Na 2 SO 4 +H 2 O 。下列说法不正确的是 A . NaClO 3 是氧化剂, Na 2 SO 3 是还原剂 B . Na 2 SO 3 被氧化 C . NaClO 3 发生氧化反应 D . ClO 2 是还原产物 |
|
| 42. | 详细信息 |
|
已知 I - 、 Fe 2+ 、 SO 2 和 H 2 O 2 均有还原性,它们在酸性溶液中的还原性强弱顺序为 H 2 O 2 < Fe 2+ < I - < SO 2 。则下列反应不能发生的是 A . 2Fe 3+ +SO 2 +2H 2 O=2Fe 2+ + B . H 2 O 2 +H 2 SO 4 =SO 2 ↑+O 2 ↑+2H 2 O C . I 2 +SO 2 +2H 2 O=H 2 SO 4 +2HI D . 2Fe 3+ +2I - =2Fe 2+ +I 2 |
|
| 43. | 详细信息 |
|
下列关于金属的叙述中正确的是( ) A . 所有的金属都是固态的 B . 金属具有导电性、导热性和延展性 C . 活泼的金属、或较活泼的金属能与酸反应,但不能与碱反应 D . 金属元素在自然界中都是以化合态存在的 |
|
| 44. | 详细信息 |
|
铝在空气中能够稳定存在的原因是 A . 性质不活泼 B . 还原性弱 C . 与氧气难反应 D . 表面有致密氧化膜 |
|
| 45. | 详细信息 |
|
将一小块钠投入到以下物质中,其中一种产生的现象与其余三种不同,这种物质是 A . 水 B . 稀 H 2 SO 4 C . MgCl 2 溶液 D . BaCl 2 溶液 |
|
| 46. | 详细信息 |
|
向紫色石蕊溶液中加入过量过氧化钠粉末,振荡,正确的叙述是 A . 最后溶液变蓝色 B . 溶液先变蓝色最后褪色 C . 溶液仍为紫色 D . 溶液先变红色最后褪色 |
|
| 47. | 详细信息 |
|
N A 表示阿伏伽德罗常数的值,下列叙述中正确的是 A . 常温常压下, 92g 的 NO 2 和 N 2 O 4 混合气体含有的氧原子数为 4N A B . 同温同压下,相同体积的氢气和氮气所含原子数均为 2N A 个 C . 1molNa 与足量 H 2 O 反应时得到电子的数目为 N A D . 标准状况下, 22.4L 四氯化碳所含分子数为 N A |
|
| 48. | 详细信息 |
|
等物质的量的 Na 、 Mg 、 Al 分别与足量的稀盐酸反应,同温同压下,产生气体的体积比为 A . 1 : 2 : 3 B . 3 : 2 : 1 C . 6 : 3 : 2 D . 1 : 1 : 1 |
|
| 49. | 详细信息 |
|
我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为 S + 2KNO 3 + 3C===K 2 S + N 2 ↑ + 3CO 2 ↑ ,下列说法正确的是 A . 氧化剂只有硫单质 B . 氧化产物为 K 2 S 和 N 2 C . 消耗单质硫 32g 的同时生成氮气 22.4L D . 生成 3mol CO 2 的同时转移电子数为 12N A |
|
| 50. | 详细信息 |
|
已知硫代硫酸钠可作为脱氯剂, 25.0 mL 0.100 mol·L -1 的 Na 2 S 2 O 3 溶液恰好把 224 mL( 标准状况下 )Cl 2 转化为 Cl - ,则 S 2 O A . S 2- B . S C . SO |
|
| 51. | 详细信息 |
|
下列物质的分类错误的是 A . 纯碱 —— 钠盐 B . H 2 SO 4 —— 强电解质 C . 氢氧化铁胶体 —— 无色分散系 D . H 2 O 2 —— 氧化物 |
|
| 52. | 详细信息 |
|
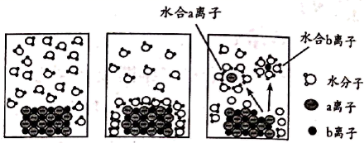
NaCl 是生活中必不可少的物质。将 ω g NaCl 固体完全溶于 1 L 水中,溶解和电离过程如图所示。下列说法正确的是 A . a 离子为 Na + B . 溶解和电离过程中,水分子与晶体不存在相互作用 C . 所得溶液中 c (Na + ) 等于 D . 若再加入 NaCl 固体至离子浓度不再变化时,则所得为饱和溶液 |
|
| 53. | 详细信息 |
|
常温下 , 下列各组离子一定能在指定溶液中大量共存的是( ) A . 与 Al 反应能放出 H 2 的溶液中: B . 能使石蕊试液变红的溶液中: C . 含大量 NaHSO 4 的溶液中: D . 溶液呈强碱性的溶液中: |
|
| 54. | 详细信息 |
|
人们可从钛铁矿 ( 主要成分 FeTiO 3 ) 制取金属钛 (Ti) ,其在一定条件下的主要反应有: ① FeTiO 3 +H 2 下列叙述错误的是 A . 反应 ①中的 H 2 是还原剂 B . 反应 ②中钛元素失电子 C . 反应 ③是置换反应 D . 反应 ②中 TiCl 4 不是氧化产物 |
|
| 55. | 详细信息 |
|
设 N A 为阿伏加德罗常数的值。下列叙述正确的是 A . 0.1mol FeCl 3 完全转化为氢氧化铁胶体,生成 0.1 N A 个胶粒 B . 5.6g 铁与足量高温水蒸气完全转化为 Fe 3 O 4 ,转移电子数为 0.3 N A C . 28g C 2 H 4 和 CO 的混合气体中含有的原子数为 N A D . 常温常压下, 11.2L CO 2 所含的质子数小于 11 N A |
|
| 56. | 详细信息 |
|
下列说法一定正确的是 A . HCl 和 NH 3 的水溶液能导电,则 HCl 和 NH 3 ·H 2 O 为电解质 B . 25 ℃时,醋酸溶液比醋酸钠溶液的导电能力弱 C . NaHCO 3 的电离方程式为 NaHCO 3 =Na + +H + + D . CaCO 3 的水溶液不易导电,故 CaCO 3 是弱电解质 |
|
| 57. | 详细信息 |
|
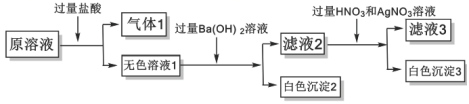
某溶液仅由 Na + 、 Cu 2+ 、 Ba 2+ 、 Fe 3+ 、 根据以上实验判断,下列推断错误的是 A . 气体 1 通入澄清石灰水中,溶液变浑浊 B . 白色沉淀 2 中加稀硝酸,沉淀不溶解 C . 原溶液中一定存在 Na + ,一定不存在 Cl - D . 滤液 2 中加入碳酸钠溶液一定会产生白色沉淀 |
|
| 58. | 详细信息 |
|
用等体积的 0.10mol·L -1 BaCl 2 溶液,可使相同体积的 Al 2 (SO 4 ) 3 、 NH 4 Al(SO 4 ) 2 、 Na 2 SO 4 三种溶液中的 A . 3 : 2 : 3 B . 2 : 3 : 6 C . 2 : 6 : 3 D . 1 : 1 : 1 |
|
| 59. | 详细信息 |
|
下列说法正确的是 A . NaHSO 4 溶液与过量 Ba(OH) 2 溶液反应时,发生中和的 OH - 与未反应的 OH - 之比为 1 : 1 B . PbO 2 +4HCl=PbCl 2 +Cl 2 ↑+2H 2 O 中,氧化剂和还原剂物质的量之比为 1 : 2 C . 3S+6KOH D . 3(NH 4 ) 2 SO 4 |
|
| 60. | 详细信息 | ||||||||
|
判断下列操作正确并可达到预期目的有
A . 均不可行 B . 均可行 C . 仅 1 项可行 D . 仅 2 项可行 |
|||||||||
| 61. | 详细信息 |
|
已知酸性: H 2 SO 3 >CH 3 COOH>H 2 CO 3 >HClO 。离子反应的一条规律,即酸性较强的物质发生 H + 转移反应,可以生成酸性相对较弱的物质,例如 2CH 3 COOH+ A . CO 2 +H 2 O+ClO - = B . C . SO 2 + D . ClO - +CH 3 COOH=HClO+CH 3 COO - |
|
| 62. | 详细信息 |
|
下列 “ 假说 ” 在化学发展过程中曾经起到一定作用,至今仍公认为化学原理的是 A . 18 世纪末化学家提出的 “ 与氧化合的反应为氧化反应,失去氧的反应为还原反应 ” B . 1808 年盖 · 吕萨克提出的 “ 同温同压下,相同体积的不同气体含有相同数目的原子 ” C . 1861 年 Graham 提出的 “ 胶体是一种粘性液体 ” D . 1887 年阿伦尼乌斯提出的 “ 电解质在溶液中会自发离解成带电的粒子 ” |
|
| 63. | 详细信息 |
|
下列对于 NH 4 HSO 4 溶液的说法错误的是 A . NH 4 HSO 4 不属于正盐 B . NH 4 HSO 4 在水中完全电离,产生 C . NH 4 HSO 4 与 NaOH 溶液反应离子方程式与相对用量无关 D . NH 4 HSO 4 与 NaOH 溶液反应包含了 H + 与 OH - 中和反应 |
|
| 64. | 详细信息 |
|
从矿物学资料查得一定条件下自然界存在如下反应 14CuSO 4 +5FeS 2 +12H 2 O=7Cu 2 S+5FeSO 4 +12H 2 SO 4 。下列说法正确的是 A . CuSO 4 是还原剂 B . 1 mol FeS 2 发生反应时有 2 mol 电子转移 C . 产物中的一部分 SO D . FeS 2 只作还原剂 |
|
| 65. | 详细信息 |
|
下列指定反应的离子方程式正确的是 A . 将 CO 2 通入 BaCl 2 溶液中: CO 2 +Ba 2+ +H 2 O=BaCO 3 ↓+2H + B . 醋酸溶解水垢中的碳酸钙: CaCO 3 +2H + =Ca 2+ +H 2 O+CO 2 ↑ C . 实验室制 Fe(OH) 3 胶体: Fe 3+ +3H 2 O ⇌ Fe(OH) 3 ↓+3H + D . Na 2 HPO 4 溶液中加入过量澄清石灰水: 2 |
|
| 66. | 详细信息 |
|
标准状况下,有一支充满 HCl 与空气 ( 混合气体密度是氦 8.5 倍 ) 的大试管,倒立于水槽中,液体进入试管,液面稳定后所得盐酸 ( 假定 HCl 未向水槽扩散 ) 浓度为 A . 0.045mol·L -1 B . 0.030mol·L -1 C . 0.015mol·L -1 D . 0.090mol·L -1 |
|
| 67. | 详细信息 |
|
将 40mL 1 . 5mol · L - 1 的 CuSO 4 溶液与 30mL 3mol · L - 1 的 NaOH 溶液混合,生成浅蓝色沉淀,假如溶液中 c ( Cu 2 + )或 c ( OH - )都已变得很小,可忽略,则生成沉淀的组成可表示为 A . Cu ( OH ) 2 B . CuSO 4 · Cu ( OH ) 2 C . CuSO 4 · 2Cu ( OH ) 2 D . CuSO 4 · 3Cu ( OH ) 2 |
|
| 68. | 详细信息 |
|
标准状况下 aL 氨溶于水 ( 水的密度近似为 1.0g/mL) 中,得 VmL 氨水,其密度为 ρg/cm 3 ,溶质的质量分数为 ω ,物质的量浓度为 cmol/L ,则下列说法正确的是 ① ω=35a/Vρ ② ρ<1.0g/cm 3 ③等体积稀释上述溶液,所得溶液质量分数大于 ω/2 ④ c=1000a/22.4V A . ①② B . ③④ C . ②④ D . ①③ |
|
| 69. | 详细信息 |
|
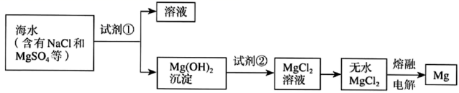
镁及其合金是一种用途很广泛的金属材料。大量的镁是从海水中提取的,其主要步骤如下: (1) 加入试剂 ①后获得纯净 Mg(OH) 2 沉淀的操作是:过滤、 _______ 。 (2) 写出加入试剂 ②所发生的离子方程式 _______ 。 (3) 无水 MgCl 2 在熔融状态下通电后会产生 Mg 和 Cl 2 ,若生产 12 吨 Mg 单质,同时产生标准状况下的 Cl 2 体积为 _______ m 3 (4) 副产物 Cl 2 和 NO 2 在室温下可以完全化合得到气体 A ,为了测定化合物 A 的分子组成,进行以下实验: Cl 2 和 NO 2 以两种不同比例混合时,测得平均摩尔质量为 51 g/mol 和 61 g/mol ,则 Cl 2 在后一混合气体中的体积百分数为 _______ ;各取 5 L 两种混合气体,各自充分化合后的总体积均变为 4 L ,写出反应的化学方程式 _______ 。 |
|
| 70. | 详细信息 | ||||||||||
|
能将 KI 氧化为 I 2 的若干种氧化剂有 H 2 O 2 、 Cl 2 、 KIO 3 、 HNO 3 、 KClO 3 、 KMnO 4 等。 (1) 上述试剂最适合贴上的一个标签是 _______ ( 填序号 ) 。 A. (2) 配平方程式: KClO 3 +KI+H 2 SO 4 =K 2 SO 4 +KCl+I 2 +H 2 O , ____________ 。已知过量 KClO 3 会引起副反应: KClO 3 +I 2 →KIO 3 +Cl 2 ,据此判断: I 2 和 Cl 2 相比,氧化性较强的是 _______ 。 (3) 写出 KI 溶液与 Cl 2 反应的离子方程式为 _______ 。 (4) 以单线桥法表示下列氧化还原反应的电子转移: H 2 O 2 +2H + +3I - = (5) 已知下列四种氧化剂 ( 氧化 KI 后 ) 对应的还原产物情况如下:
请判断,等物质的量的四种氧化剂分别与足量 KI 作用,得到 I 2 最多的是 _______ 。 (6) 根据信息 “ 氧化性 Cl 2 >Br 2 >HNO 3 >I 2 ” 思考:对于 I - 、 Br - 混合溶液,若控制性氧化 I - 而不氧化 Br - ,请提出两种合理的氧化方案: ①加入 _______ ; ②加入 _______ 。 |
|||||||||||
| 71. | 详细信息 |
|
有如下物质: ①铁丝② NaOH 溶液 ③ NaHSO 4 固体 ④ CO 2 ⑤酒精⑥蒸馏水⑦ CCl 4 ⑧熔融的 KNO 3 ⑨红褐色的氢氧化铁胶体 ( 1 ) 以上物质中,属于电解质的是 _______ ( 填序号,下同 ) ,属于非电解质的是 _______ 。 ( 2 ) 已知蒸馏水有非常微弱的导电性,上述物质除 ⑥外,能导电的是 _______ 。 ( 3 ) 分离 ⑤与⑥的混合液所用的方法是 ____ ;分离 ⑥与⑦的混合液所用的方法是 ____ 。 ( 4 ) 物质 ③溶于水的电离方程式为 _______ ( 5 ) 向 ⑨的溶液中逐渐滴加③的溶液,看到的现象是 _______ |
|
| 72. | 详细信息 |
|
国际化学年的中国宣传口号是 “ 化学 —— 我们的生活,我们的未来 ” 。学习化学应该明白 “ 从生活中来,到生活中去 ” 的道理。请填空: ( 1 ) 金属钠着火时,不能用水灭火,原因是 _______ ( 用离子方程式表示 ) 。 ( 2 ) 常温下铁遇水不反应,但在高温条件下二者能发生反应,书写二者反应的化学方程式 ___ 。 ( 3 ) 热水瓶用久后,瓶胆内常附着一层水垢 ( 主要成分是 CaCO 3 ) ,用食醋能较好的清除,其原理是 _______ ( 用离子方程式表示 ) 。 ( 4 ) 铝合金材料在生活生产中应用广泛,如铝合金门窗、飞机外壳、航空航天等,且具有密度小、易加工、不易腐蚀等优点, Al 与氢氧化钠溶液反应的离子方程式为 ___ 。 ( 5 ) 设计实验检验实验室用 KClO 3 和 MnO 2 制取氧气后的产物中是否存在 Cl - ____ 。 |
|
| 73. | 详细信息 |
|
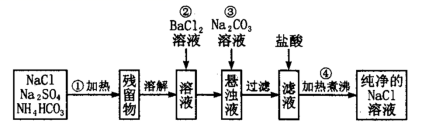
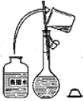
I. 实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如图: ( 1 ) 配制溶液时,一般可以分为以下几个主要步骤: ①称量②计算③稀释④定容⑤转移⑥洗涤并转移⑦装瓶⑧冷却⑨上下颠倒摇匀。其正确的操作顺序为 _______ ( 填序号 ) ( 2 ) 配制 480mL0.50mol/L 的稀硫酸,需取该浓硫酸 _______ mL 。 ( 3 ) 完成此实验需用到的仪器有量筒、烧杯、玻璃棒、 _______ 、 _______ 。 II. 实验室里需要纯净的氯化钠溶液,现只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案: ( 4 ) 操作 ①中发生的化学反应方程式为: NH 4 HCO 3 ( 5 ) 操作 ③的目的是 _______ ,操作 ③能否用硝酸钡溶液代替氯化钡 _______ ( 填 “ 能 ” 或 “ 不能 ”) 原因是: _______ ; ( 6 ) 为了达到实验目的,进行操作 ②后,为证明溶液中 A . 静置,向上层清液中滴加硫酸钠溶液,若有沉淀生成,则 B . 静置,取上层清液于试管中,滴加硫酸钠溶液,若有沉淀生成,则 C . 静置,取上层清液于试管中,滴加氯化钡溶液,若无沉淀生成,则 D . 静置,取上层清液于试管中,滴加硝酸银溶液,若有沉淀生成,则 |
|
| 74. | 详细信息 |
|
完成下列各题 ( 1 ) 请完成并配平如下化学方程式,再用双线桥标明电子转移的方向和数目: KMnO 4 +HBr=Br 2 +MnBr 2 +KBr+_______ , _______ 。 HBr 在上述反应中体现的性质有 _______ ,氧化剂与还原剂的物质的量之比为 _______ 。若反应消耗 0.1mol/LKMnO 4 溶液 1L 时,转移电子数为 _______ 。 ( 2 ) NaH 可在野外作生氢剂。反应原理为 NaH+H 2 O=NaOH+H 2 ↑ ,该反应中氧化产物和还原产物的质量比为 _______ 。 ( 3 ) 工业废水中的 |
|
| 75. | 详细信息 |
|
现有下列六种物质: ①铝② Na 2 CO 3 固体 ③ CO 2 ④液态 HCl ⑤ NaOH 溶液 ⑥红褐色的氢氧化铁胶体 ( 1 ) 上述物质中属于电解质的有 ___________ ( 填序号,下同 ) ,能导电的是 ___________ 。 ( 2 ) 写出 ②在水中的电离方程式: ___________ 。 ( 3 ) 上述物质中有两种物质在水溶液中发生反应,其离子方程式为 H + + OH - =H 2 O ,则该反应的化学方程式为 ___________ 。 ( 4 ) 向 ⑥中逐渐滴加④的溶液,看到的现象是 ___________ 。 |
|
| 76. | 详细信息 |
|
书写下列反应的离子反应方程式 (1) 醋酸与碳酸钙反应: ___________ (2) 过氧化钠与水反应: ___________ (3) 硫酸与氢氧化钡反应: ___________ (4) 铝与氢氧化钠溶液反应: ___________ (5) 设计实验检验实验室粗盐中是否存在 SO |
|
| 77. | 详细信息 |
|
回答下列问题: ( 1 ) 草酸是一种常见的厕所清洁剂,它能与高锰酸钾溶液发生反应: ___________KMnO 4 +___________H 2 C 2 O 4 +___________H 2 SO 4 =___________K 2 SO 4 +___________MnSO 4 +___________CO 2 +__________ ① 补上产物配平方程式,并用双线桥表示出电子的转移方向和数目 ___________ 。 ② 上述反应中 H 2 C 2 O 4 表现的性质有 ___________ ,氧化剂与还原剂的物质的量之比为 ___________ ,若标况下生成 5.6L 的气体,则转移电子的数目为 ___________ 。 ( 2 ) 将 SO 2 通入酸性 KMnO 4 溶液中,溶液褪色,生成 Mn 2+ ,写出发生反应的离子方程式 ___________ ( 3 ) 在一定条件下, PbO 2 与 Cr 3+ 反应,产物是 Cr 2 O |
|
| 78. | 详细信息 |
|
将质量为 5.4g 的铝箔 ( 有小孔 ) 包裹 4.6g 金属钠,投入到盛有足量水的烧杯中,可生成标况下气体 _______ 升 ( 写出发生反应的方程式并计算 ) 。 |
|
| 79. | 详细信息 |
|
将 70 克由 Na 2 O 2 和 Na 2 O 组成的混合物跟 98 克 H 2 O 充分反应后,所得 NaOH 溶液中溶质的质量分数为 50% 。 ( 注意:无计算过程不给分 ) (1) 求原混合物中过氧化钠和氧化钠的质量 ___________ ; (2) 产生的气体标况下体积 ___________ 。 |
|
| 80. | 详细信息 |
|
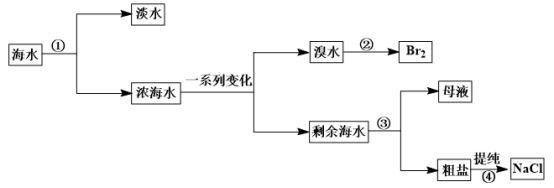
从海水中提取蒸馏水、溴、食盐过程过如下: ( 1 ) 从海水中获取淡水的方法 ①实验操作是 ___________ ,需要的玻璃仪器有:酒精灯、冷凝管、牛角管、锥形瓶、 ___________ 、 ___________ 。 ( 2 ) 从溴水中获得单质溴时,采用的方法是萃取、 ___________ 、蒸馏。下列可选作萃取剂的是 ___________ A .酒精 B .苯 C . CCl 4 ( 3 ) 粗盐含有 Ca 2+ 、 Mg 2+ 、 SO A . ①②③④⑤ B . ②①③④⑤ C . ③②①④⑤ D . ②③①④⑤ ( 4 ) 实验室用上述方法制得的 NaCl 配制 240ml0.1mol/LNaCl 溶液。需要用托盘天平称量 NaCl 固体 ___________ g ;配制时,一般可分为以下几个步骤: ①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为 ___________ 。完成此实验要用到的仪器有烧杯、玻璃棒、 ___________ 、 ___________ 。在该实验中要用到容量瓶,使用容量瓶首先要 ___________ 。 |
|
| 81. | 详细信息 | ||||||||||||
|
浩瀚的海洋约占地球表面积的 71% ,它是一个巨大的宝藏。海水中水储量约为 1.3×10 18 吨,约占地球上总水量的 97% 。 (1) 海水淡化主要有蒸馏法。实验室进行水蒸馏的装置有 _______ ( 选填必要序号 ) 。 (2) 某苦卤水中主要含有 Mg 2+ 、 (3) 海藻中富含碘元素,实验室模拟海藻提取 KI 的流程如下: 在灼烧、溶解、过滤、蒸发四个步骤中,均要使用到的一种实验仪器为 _______ 。 (4) 配制 100mL 0.2mol/LKI 溶液的操作如下,请正确排序 _______ ( 填数字序号 ) 。
(5) 溶解了 CO 2 的水可以溶解自然界中的碳酸钙,产生含 (6) 海水中含有大量矿物质,你认为海水中会富含石油吗? _______ ( 填 “ 会 ” 或 “ 不会 ”) 。 |
|||||||||||||
| 82. | 详细信息 |
|
从 I 2 —CCl 4 溶液中提取碘用反萃取法,其流程如下: (1) 常选择有机溶剂 CCl 4 萃取水溶液中的 I 2 ,选择 CCl 4 做萃取剂的原因有: CCl 4 与水不反应也 _______ ; I 2 在 CCl 4 中溶解 _______ ( 填 “ 大于 ” 或 “ 小于 ”)I 2 在水中溶解。 (2)“ 配制 100g 质量分数为 45%H 2 SO 4 溶液 ” 一定不会用到 “ 配制 100mL 6mol/LNaOH 溶液 ” 中的 _______ 仪器 ( 填名称 ) 。 (3) 对所配制 NaOH 溶液进行测定,发现其浓度偏低,可能的原因是 _______ ( 填序号 ) 。 A. 用生锈砝码称量 NaOH 固体 B. 容量瓶用蒸馏水洗涤后未干燥 C. 将溶解后未冷却的 NaOH 溶液立即转入容量瓶,洗涤、定容 D. 转移溶液时,有少量溶液不慎洒到容量瓶外 E. 俯视容量瓶刻线进行定容 F. 定容后,倒置摇匀容量瓶,发现液面低于刻度线,便补水至刻线处 (4) 上述提取过程中的操作 1 用到的玻璃仪器除了烧杯外,还有 _______ ,操作 2 名称是 _______ 。 (5) 碘单质与浓 NaOH 溶液发生的反应为: 3I 2 +6NaOH=5NaI+NaIO 3 +3H 2 O ,像这种将富集在四氯化碳中的碘单质利用化学转化法重新富集在水中的方法即为反萃取法。指出上述反应中氧化剂与还原剂的物质的量之比为 _______ 。 |
|