2019四川高二上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
下列能级中轨道数为3的是( ) A.s能级 B.p能级 C.d能级 D.f能级
|
|
| 2. | 详细信息 |
|
下列有关化学用语表示正确的是( ) A.次氯酸的结构式:H—Cl—O
C.氯离子结构示意图: D.质子数为35、中子数为45的溴原子:
|
|
| 3. | 详细信息 |
|
下列有关物质性质的说法错误的是( ) A.热稳定性:HCl>HI B.原子半径:Na>Mg C.碱性:KOH>NaOH D.电
|
|
| 4. | 详细信息 |
|
下列说法中正确的是( ) A.1s电子云呈球形,表示电子绕原子核做圆周运动 B.电子云图中的小黑点密度大,说明该原子核外空间电子数目多 C.霓虹灯发出有色光与核外电子跃迁有关 D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素
|
|
| 5. | 详细信息 |
|
下列判断正确的是( ) A.水分子很稳定是因为水分子间存在氢键 B.晶体中一定存在化学键 C.正四面体分子中键角可能是109°28′或60° D.根据主族元素最高正价与族序数的关系,推出卤族元素最高正价都是+7
|
|
| 6. | 详细信息 |
|
下列物质中,难溶于CCl4的是( ) A.溴单质 B. 水 C. 苯
|
|
| 7. | 详细信息 |
|
下列说法正确的是:( ) A.CH2=CH-CH3中其杂化类型有sp3 和sp2,其中有2个π键,7个σ键。 B.SiO2和N2O互为等电子体,故性质相似。 C.分子晶体内一定只含范德华力 D.CO2分子的VSEPR模型是直线型。
|
|
| 8. | 详细信息 |
|
“类推”是一种重要的方法,但有时会产生错误的结论,下列类推结论中正确的是( ) A.第2周期元素氢化物的稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是: B.ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 D.干冰(CO2)是分子晶体,则SiO2也是分子晶体
|
|
| 9. | 详细信息 |
|
下面有关晶体的叙述中,不正确的是( ) A.金刚石为网状结构,由共 B.氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 C.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 D.金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构
|
|
| 10. | 详细信息 |
|
下列有关说法不正确的是( ) A.SO42-的空间构型为正四面体 B.O2、CO2、N2都是非极性分子 C.酸性:H2CO3<H3PO4<H2SO4<HClO D.晶体熔点:碳化硅>晶体硅>Na>H2O>H2S
|
|
| 11. | 详细信息 |
|
关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物的下列说法中 A.配位体是Cl-和H2O,配位数是6 B.中心离子的化合价是+3, C.内界和外界中的Cl-的数目比是1:2 D.加入足量AgNO3溶液,所有Cl-均被完全沉淀
|
|
| 12. | 详细信息 |
|
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( ) A.沉淀溶解后,将生成深蓝色的配离子[Cu(NH3)4] 2+ B.反应后溶液中不存在任何沉淀,因此反应前 C.向反 D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
|
|
| 13. | 详细信息 |
|
下列说法正确的是( ) A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 B.基态Cr原子的外围电子排布为3d44s2 C.金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈 的相互作用 D.卤素单质的键能按从小到大顺序为I—I、 Br—Br、F—F、Cl—Cl
|
|
| 14. | 详细信息 |
|
设NA为阿伏加德罗常数,下列叙述正确的是( ) A.在含4 mol Si-O键的石英晶体中,氧原子的数目为2NA B.12g金刚石中含有的C—C键数目为4NA C.18 g重水(D2O)中含有的电子数目为10NA D.1 mol过氧化钠晶体中含有的离子数4NA
|
|
| 15. | 详细信息 |
|
关于如图所示的有机物说法不正确的是( ) A.该分子中有1个手性碳,为手性分子 B.该有机物能形成分子内氢键 C.1 mol该有机物分子中有10 mol C—C σ键 D.采用sp、sp2和sp3杂化的碳原子数目之比为2 :7 :2
|
|
| 16. | 详细信息 |
|
下列说法不正确的是( ) A.晶体中原子呈周期性有序排列,有自范性 B.硬度:MgO>CaO>BaO>SrO C.离子键没有方向性和饱和性,而共价键一般有方向性和饱和性 D.NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因并不完全相同
|
|
| 17. | 详细信息 |
|
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备手机电池的重要材料,X原子核外只有3个能级且每个能级有2个电子,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是( ) A. 元素W、Y、Z的离子半径大小: Z> Y>W B. 元素Z可与元素X形成共价化合物XZ2 C. 元素Y的单质与氢氧化钠溶液或 D. 元素W、X的氯化物中,各原子均满足8电子的稳定结构
|
|
| 18. | 详细信息 |
|
已知某元素原子的价电子构型为3s 23p3,下列说法不正确的是( ) A.该元素的名称是磷 B.它位于第三周期第ⅤA族 C.该元素原子核外有2个未成对电子 D.它的气态氢化物化学式为PH3
|
|
| 19. | 详细信息 |
|
下列化合物中含有手性碳原子的是( ) A.CH2
|
|
| 20. | 详细信息 |
|
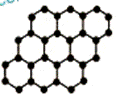
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是( )
B.石墨烯 C.石墨烯从石墨剥离出来需破坏化学键 D.石墨烯中的C原子数和C—C键数之比为2:3
|
|
| 21. | 详细信息 |
|
2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想。运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质 (1)通过计算可得出该氮氢化合物的分子式为 (2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的物质,其中一种为气体,则该反应的化学方程式为 。 (3)已知该氮氢化合物与NH3一样属于非电解质,工业上通常以NaClO溶液氧化NH3来制得,则该反应的离子方程式是
|
|
| 22. | 详细信息 |
|
请你根据已学知识,回答下列问题: (1)以下能级符号不正确的是______(填序号) A.1s B. 2d C.3p D.4f (2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,熔化时需克服的作用力是 (3)下列物质中,只含有极性键的非极性分子是 ,既含有离子键又含有共价键的化合物是 __,同时存在σ键和π键的单质分子是 (以上均填序号) A.N2 B. CO2 C.CHCl3 D.C2H4 E. CaCl2 F. NH4Cl (4)用“>”、“=”或“<” 填空: ①第一电离能的大小Mg______Al ② 熔点的高低KCl ______ MgO
|
|
| 23. | 详细信息 | ||||||||||||
|
有关短周期元素X、Y、Z、M、N的信息如下:
请回答下列问题: (1)Z的元素符号是________ ,Z元素原子的价电子排布图为_______________ (2)Y元素的原子结构示意图为________,X元素的简单氢化物的沸点比Z元素氢化物的沸点高的原因是____________________________ (3)化合物N2X2与CO2反应的化学方程式为____________________________。 (4) M元素的最高价氧化物对应的水化物与其最简单的气态氢化物可反应生成盐R,则盐R中含有的化学键类型有______________(写出2种即可)。
|
|||||||||||||
| 24. | 详细信息 | |||||||||
|
自然界存在丰富的碳、氮、氧、硅、磷、铁、铜等元素,它们可形成单质及许多化合物。请回答下列问题: (1)铁原子核外电子排布式为_________________________________。 (2)铁能与CO形成配合物Fe(CO)5,其熔点为-20.5 ℃,沸点为102 ℃,易溶于CCl4,据此判断Fe(CO)5晶体属于_____________ (填晶体类型)。 (3)KSCN溶液可用于检验________(填离子符号)。C、N、O、Si四种元素的第一电离能由大到小的顺序为__________________(用元素符号表示)。 (4)亚磷酸(H3PO3与过量NaOH溶液充分反应生成亚磷酸氢二钠(Na2HPO3),则 亚磷酸的结构式为_____________。 (5)铜晶体中铜原子的堆积方式如图1所示。某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(黑点代表铜原子),则
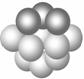
图1 图 2 ①铜晶体中,每个铜原子周围距离最近的铜原子数目为___________。
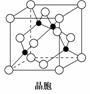
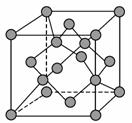
(6) 金刚石晶胞结构模型如右图,立方BN结构与 金刚石相似,硬度与金刚石相当。如果阿伏加德 常数为NA,立方BN的密度为a g·cm-3,摩尔质量 为b g·mol-1,则该晶胞的边长为_____________cm (用含a、b代数式表示)。
|
||||||||||
- 高中化学人教版 选修三 第3章 晶体结构与性质 金属晶体的原子堆积模型
- 2017-2018年高二12月月考化学考卷带参考答案和解析(安徽省铜陵市第一中学)
- 2017,2018年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
- 高中化学人教版 选修三 第3章 晶体结构与性质 分子晶体
- 2018届高三上学期第四次检测理综化学在线测验(四川省南充高级中学)
- 2018年至2019年高一上期第一次半月考化学考试(云南省曲靖市会泽县一中)
- 2017-2018年高一上学期第四次月考化学试卷(河南省南阳市第一中学)
- 2017-2018年高二上册12月月考化学在线测验(辽宁省瓦房店市高级中学)