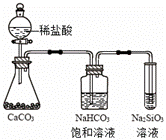
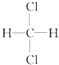2017福建高一下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
苏轼的《格物粗谈》有这样的记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”按照现代科技观点,该文中的“气”是指( ) A. 脱落酸 B. 甲烷 C. 生长素 D. 乙烯
|
|
| 2. | 详细信息 |
|
化学版《青花瓷》中所描绘的“蓝色絮状的沉淀跃然试管底 铜离子遇氢氧根 再也不分离”、“无色酚酞面对碱 羞涩脸绯红 紫色石蕊遇到碱 青蓝慢淡出”等现象大家耳熟能详,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox, 铜为+2价),下列关于硅酸铜钡的说法不正确的是( ) A、可用氧化物形式表示为BaO•CuO•2SiO2 B、性质稳定,不易脱色 C、易溶解于强酸和强碱 D、x等于6
|
|
| 3. | 详细信息 |
|
下列说法不正确的是( ) A、13C表示核内有6个质子,核外有7个电子的一种核素 B、氧气O2和臭氧O3互为同素异形体 C、CH3OCH3和CH3CH2OH互为同分异构体 D、磁性纳米材料是直径为1~100nm(1nm=10﹣9m)的磁性粒子分散在基础物质中,这种材料具有胶体的性质。
|
|
| 4. | 详细信息 |
|
根据元素周期表和元素周期律,判断下列叙述不正确的是( ) A、气态氢化物的稳定性:H2O>NH3>SiH4 B、氢元素与其他元素可形成共价化合物或离子化合物 C、 D、用中文“
|
|
| 5. | 详细信息 |
|
研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价的砷(As)元素,但它对人体是无毒的,砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C=砒霜,下面有关解释不正确的应该是( ) A、青菜中含有维生素C B、维生素C具有还原性 C、致人中毒过程中砷发生还原反应 D、砒霜是氧化产物
|
|
| 6. | 详细信息 |
|
下列说法正确的是( ) A、医用酒精的浓度通常是95% B、食用花生油和鸡蛋清都能发生水解反应 C、淀粉、纤维素和油脂都属于天然高分子化合物 D、合成纤维和光导纤维都是新型无机非金属材料
|
|
| 7. | 详细信息 |
|
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( ) A.原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) B.Y分别与Z、W形成的化合物中化学键类型相同 C.X的最高价氧化物对应的水化物的酸性比W的弱 D.Y的气态简单氢化物的热稳定性比W的强
|
|
| 8. | 详细信息 |
|
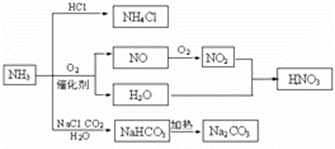
NH3是一种重要的化工原料,可以制备一系列物质(见图)。下列说法正确的是( )
A、NH4Cl和NaHCO3都是常用的化肥 B、NH4Cl、HNO3和Na2CO3受热时都易分解 C、NH3和NO2在一定条件下可发生氧化还原反应 D、图中所涉及的盐类物质都属于正盐
|
|
| 9. | 详细信息 |
|
下列分子中,其中子总数为24的是( ) A、18O3 B、2H217O2 C、14N16O2 D、14C16O2
|
|
| 10. | 详细信息 | ||||||||||
|
有A,B,C,D主族元素,有关它们的一些信息如表所示:
则下列有关说法中正确的是( ) A、元素A的单质可能是一种有色的固体物质,其氢化物HAt易溶于水,很稳定
|
|||||||||||
| 11. | 详细信息 |
|
下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( ) A、在空气中敞口久置的浓硫酸,溶液质量增大(难挥发性) B、在加热条件下铜与浓硫酸反应(强氧化性、酸性) C、蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性) D、浓硫酸与少量胆矾晶体混合,晶体由蓝色变成白色(脱水性)
|
|
| 12. | 详细信息 |
|
下列有关硫酸和硝酸的说法中正确的是( ) A、将过量的Zn投入一定量的浓H2SO4中,最终生成的气体只有SO2 B、向50mL12mol•L﹣1的浓硝酸中加入足量铜片其充分反应,生成0.3molNO2 C、向装有Fe(NO3)2溶液的试管中加入稀H2SO4 , 在管口观察到红棕色气体 D、运输保存浓硫酸的槽罐车一旦泄露后应立即用大量水冲洗
|
|
| 13. | 详细信息 | |||||||||||||||
|
完成下列实验所选择的装置或仪器不正确的是( )
|
||||||||||||||||
| 14. | 详细信息 |
|
下列说法正确的是( ) ①离子化合物中一定含离子键,也可能含共价键 ②共价化合物中可能含离子键 ③含金属元素的化合物不一定是离子化合物④由非金属元素组成的化合物一定是共价化合物 ⑤由分子组成的物质中一定存在化学键 ⑥熔融状态下能导电的化合物一定是离子化合物 A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
|
|
| 15. | 详细信息 |
|
四联苯 A.3种 B.4种 C.5种 D.6种
|
|
| 16. | 详细信息 |
|
我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖。已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( ) A、能发生加成反应,不能发生取代反应 B、一定条件下,能够发生水解反应 C、标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2 D、与乙醇发生酯化反应生成产物的分子式为C8H16O4
|
|
| 17. | 详细信息 | ||||||||||||||||||||||||||||||
|
下列给出的各组物质,不能完成下列转化的是( )
|
|||||||||||||||||||||||||||||||
| 18. | 详细信息 |
|
下列有关有机物的说法正确的是( ) A、乙酸溶液、葡萄糖溶液、淀粉溶液可用新制Cu(OH)2悬浊液鉴别 B、淀粉和纤维素的化学式都是(C6H10O5)n , 因此它们互为同分异构体 C、分馏煤焦油可以得到苯和甲苯,说明煤中含有苯和甲苯等芳香烃 D、乙烯、苯、四氯化碳分子中所有原子都在同一平面上
|
|
| 19. | 详细信息 |
|
1mol某烷烃完全燃烧,需要5mol的氧气,这种烷烃的分子式是( ) A、C3H8 B、C4H10 C、C5H12 D、C6H14
|
|
| 20. | 详细信息 |
|
下列有机化学反应方程式书写及反应类型均正确的是( ) A、CH2=CH2+HCl
|
|
| 21. | 详细信息 |
|
物质A的分子式为C12H12,结构简式为如右图,则 A的苯环上的二溴代物的异构体数目有( ) A.8种 B.9种 C.10种 D.11种
|
|
| 22. | 详细信息 |
|
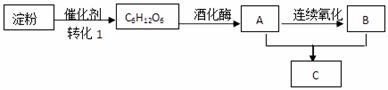
一些常见有机物的转化如图下列说法正确的是( )
A、上述有机物中只有C6H12O6属于糖类物质 B、物质A和B都属于电解质 C、物质C和油脂类物质互为同系物 D、转化1可在人体内完成,该催化剂属于蛋白质
|
|
| 23. | 详细信息 |
|
有机物甲的分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,在相同的温度和压强下,同质量的乙和丙的蒸气所占体积相同,则甲可能结构有( ) A.8种 B.14种 C.16种 D.18种
|
|
| 24. | 详细信息 |
|
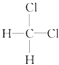
按要求完成下面每一小题: (1)下列各物质中,互为同位素的是________,互为同素异形体的是________,互为同系物的是________,互为同分异构体的是________。 ①金刚石与石墨 ②12C与14C ③乙酸和甲酸甲酯 ④ ⑥ (2)已知TiCl4在通常情况下是无色液体,熔点为﹣37℃,沸点为136℃,可知TiCl4为________晶体。 (3)相对分子质量为72的烷烃,它的一氯代物只有一种,此烷烃的结构简式为__________ __。 (4)写出在光照条件下,甲烷与氯气发生反应生成气态有机物的化学方程式:________ _。
|
|
| 25. | 详细信息 | |||||||||||||||||||||||||||||||||||||||||||||
|
如表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
(1)这些元素中,化学性质最不活泼原子的原子结构示意图为______ _____;气态氢化物中,最稳定的是________ ____;最高价氧化物对应水化物中,酸性最强的是_______ _____。 (2)①和④两种元素的原子按1:1组成的常见化合物的电子式为________ ____。 (3)②、③的单质中更容易与①的单质反应的是________ ____(用化学式表示)。 (4)④、⑦、⑧、⑨的简单离子半径由大到小的顺序为__________ __ (用离子符号和“>”表示)。 (5)⑥和⑧的最高价氧化物对应水化物之间发生反应的离子方程式________ ____。 (6) ⑤⑨⑪三种元素的单质沸点由高到低的顺序是_________ ___(用化学式和“>”表示)。 (7) ⑦⑧两元素相比较,金属性较强的是_________ ___ (填名称),可以验证该结论的实验 是_________ ___(填字母)。 A.将在空气中放置已久的这两种元素的块状单质分别放入热水中 B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应 C.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液 D.比较这两种元素的气态氢化物的稳定性
|
||||||||||||||||||||||||||||||||||||||||||||||
| 26. | 详细信息 | ||||||||||
|
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH。 ②有关有机物的沸点: (1) 该实验有机反应物中含有的官能团有_____ ____ ___(填写名称)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者(设18O在CH3CH2OH中),写出能表示18O位置的化学方程式______________ ____ _____, 反应类型是________ ____。 (2) 与书中采用的实验装置的不同之处是:这位同学采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中,在此处球形干燥管的作用除了使乙酸乙酯充分冷凝外还有______ ______;加热一段时间后,可观察到烧杯D中液面________(填“上”或“下”)有无色油状液体生成,若分离该液体混合物,需要用到的玻璃仪器是________ ____,这种方法叫做________。 (3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出_______ _____;再加入无水硫酸钠,然后进行蒸馏,收集产品乙酸乙酯时,温度应控制在________左右。 (4)乙酸可使紫色石蕊试液变红,说明乙酸具有________ ____性,写出乙酸与碳酸钠溶液反应的离子方程式_________ ____ ____ ___。
|
|||||||||||
| 27. | 详细信息 |
|
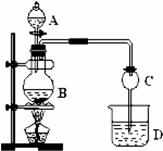
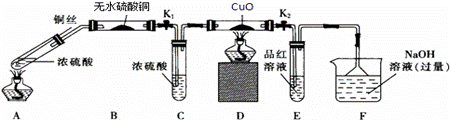
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验. 实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实
(1) A装置的试管中发生反应的化学方程式是______ ____ ______;F装置的烧杯中发生反应的离子方程式是______ ____ ______;B装置中的现象是____ ___。 (2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是_______ _____ 。 (3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是______ ______。 (4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子,需将溶液稀释,操作方法是_______ ____ ___ ______。 实验Ⅱ:反应产物的定量探究 (5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+bH2SO4 (6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液中振荡,生成的I2恰好与20.00mL 0.30mol•L﹣1的Na2S2O3溶液反应,若反应消耗铜的质量为6.4g,则硫酸铜的产率为_______ __。 (已知2Cu2++4I﹣=2CuI+I2, 2S2O32﹣+I2=S4O62﹣+2I﹣) 【注:硫酸铜的产率指的是硫酸铜的实际产量与理论产量的比值】
|
|