2018湖北高二下学期人教版高中化学同步练习
| 1. | 详细信息 |
|
2017年世界环境日我国的主题为"绿水青山就是金山银山”。下列说法应该提倡的是( ) A.推广使用电子支付 B.禁止使用塑料制品 C.普及使用家庭轿车 D.填埋处理废旧电池
|
|
| 2. | 详细信息 |
|
下列有关有机化合物的说法正确的是( ) A.“地沟油”“塑化剂”均属于高分子化合物,都对健康有害 B.石油的裂化和煤的干熘都属于化学变化 C.等质量的葡萄糖和果糖在人体内完全氧化释放的能量相等 D.聚氯乙烯制品易造成白色污染,可采用焚烧法处理
|
|
| 3. | 详细信息 |
|
某气态的烷烃与烯烃的混合气体9 g,其密度为同状况下H2密度的11.25倍,将混合气体通过足量的溴水,溴水增重4.2 g,则原混合气体的组成为( ) A.甲烷,乙烯 B.乙烷,乙烯 C.甲烷,丙烯 D.甲烷,丁烯
|
|
| 4. | 详细信息 |
|
下列说法错误的是( ) A.石油中含有C5~C11的烷烃,通过石油的分馏可得到汽油 B.含C20以上的重油经催化裂化可以得到汽油 C.开采天然气应做到安全规范地操作 D.煤中含有苯和甲苯,可用分馏的方法把它们分离出来
|
|
| 5. | 详细信息 |
|
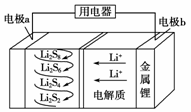
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8===8Li2Sx(2≤x≤8)。下列说法错误的是( )
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-===3Li2S4 B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g C.石墨烯的作用主要是提高电极a的导电性 D.电池充电时间越长,电池中Li2S2的量越多
|
|
| 6. | 详细信息 |
|
某烃有两种或两种以上的同分异构体,其中一种烃的一氯代物只有一种,则这种烃可能是( ) ①分子中含7个碳原子的芳香烃 ②分子中含4个碳原子的烷烃 ③分子中含6个碳原子的单烯烃 ④分子中含8个碳原子的烷烃 A.③④ B.②③ C.①② D.②④
|
|
| 7. | 详细信息 | |||||||||||||||||||||||||
|
为了探究温度、硫酸铜对锌与稀硫酸反应速率的影响规律,某同学设计如下方案:
下列推断合理的是( ) A.为了选择Ⅱ和Ⅲ实验探究硫酸铜对反应速率的影响,必须控制t=25 B.待测物理量是收集等体积(相同条件)气体所需要的时间,时间越长,反应越快 C.根据该方案,还可以探究硫酸浓度对反应速率的影响 D.根据该实验方案得出反应速率大小可能是Ⅲ>Ⅱ>Ⅰ>Ⅳ
|
||||||||||||||||||||||||||
| 8. | 详细信息 |
|
.以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2 (g)
A.a点的平衡常数小于b点 B.b点,v正(CO2)=v逆(H2O) C.a点,H2和H2O物质的量相等 D.其他条件恒定,充入更多H2,v(CO2)不变
|
|
| 9. | 详细信息 |
|
有两种有机物Q( A.二者的核磁共振氢谱中均只出现两种峰且峰面积之比为3∶2 B.二者在NaOH醇溶液中均可发生消去反应 C.一定条件下,二者在NaOH溶液中均可发生取代反应 D.Q的一氯代物只有1种,P的一溴代物有2种
|
|
| 10. | 详细信息 |
|
元素“氦、铷、铯”等是用下列哪种科学方法发现的( ) A.红外光谱 B.质谱 C.原子光谱 D.核磁共振谱
|
|
| 11. | 详细信息 |
|
列说法中正确的是( ) A.所有非金属元素都分布在p区 B.最外层电子数为2的元素都分布在s区 C.元素周期表中第ⅢB族到第ⅡB族10个纵行的元素都是金属元素 D.同一主族元素从上到下,金属性呈周期性变化
|
|
| 12. | 详细信息 |
|
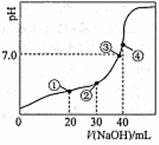
A.点①、③、④所示溶液中,点③所示溶液H2O的电离程度最小 B.点②所示溶液中:2c(H+)+c(HC2O4-)+3c(H2C2O4)=2c(OH-)+c(C2O42-) C.点③所示溶液中:c(HC2O4-)+2c(C2O42-)=2c(Na+) D.滴定过程中可能出现:c(Na+)>c(HC2O4-)=c(C2O42-)>c(OH-)>c(H+)
|
|
| 13. | 详细信息 |
|
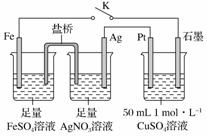
某小组用如图装置进行实验,下列说法正确的是( ) A.盐桥中的电解质可以用KCl B.闭合K,石墨电极上只生成铜 C.闭合K,电子流动方向为Ag电极→盐桥→Fe电极 D.导线中流过0.15 mol e-时,加入5.55 g Cu2(OH)2CO3,CuSO4溶液可恢复原组成
|
|
| 14. | 详细信息 | |||||||||||||||
|
.室温下,将0.05 mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是( )
|
||||||||||||||||
| 15. | 详细信息 |
|
有关糖类物质的叙述中正确的是( ) A.糖类物质又叫碳水化合物,其分子式都可用Cm(H2O)n表示 B.糖类一般是多羟基醛或多羟基酮,以及能水解产生它们的物质 C.葡萄糖、蔗糖、淀粉都能发生水解反应 D.蔗糖水解后向混合液中加入新制Cu(OH)2悬浊液,加热后可得红色沉淀
|
|
| 16. | 详细信息 |
|
下列对氨基酸和蛋白质的描述正确的是( ) A.蛋白质水解的最终产物是氨基酸 B.氨基酸和蛋白质遇重金属离子均会变性 C.α氨基丙酸与α氨基苯丙酸混合物脱水成肽,只生成2种二肽 D.氨基酸溶于过量氢氧化钠溶液中生成的离子,在电场作用下向负极移动
|
|
| 17. | 详细信息 |
|
下列叙述错误的是( ) A.用金属钠可区分乙醇和乙醚 B.用酸性高锰酸钾溶液可区分己烷和3己烯 C.用水可区分苯和溴苯 D.用新制的银氨溶液可区分甲酸甲酯和乙醛
|
|
| 18. | 详细信息 |
|
.分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有( ) A.15种 B.28种 C.32种 D.40种
|
|
| 19. | 详细信息 |
|
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大 B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小 C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小 D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
|
|
| 20. | 详细信息 |
|
下列关于有机化合物的说法正确的是( ) A.糖类、油脂、蛋白质都属于天然高分子化合物 B.分子式为C2H6O、C4H10的有机物都有2种同分异构体 C.乙烯和苯都能使酸性KMnO4溶液褪色 D.可用热的NaOH溶液除去乙酸乙酯中的乙酸杂质
|
|
| 21. | 详细信息 |
|
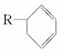
按要求回答下列问题: (1) (2) (3)某烃的分子式为C4H4,它是合成橡胶的中间体,它有多种同分异构体。 ①试写出它的一种链式结构的同分异构体的结构简式____________________。 ②它有一种同分异构体,每个碳原子均达饱和,且碳与碳的夹角相同,该分子中碳原子形成的空间构型为____________形。 (4)化合物A是合成天然橡胶的单体,分子式为C5H8。A的结构简式为(提示:有甲基支链的二烯烃)____________________。 (5)写出
|
|
| 22. | 详细信息 |
|
(1) 等物质的量浓度的下列溶液中,①NH4Cl ②NH4HCO3 ③ NH4HSO4 ④ (NH4)2SO4 pH由大到小的顺序是(填编号,下同)__________________;NH4+的浓度由大到小的顺序是_____________
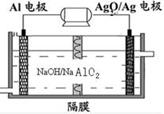
(3)铝电池性能优越,AlAg2O电池可用作水下动力电源,其原理如图所示。 ①此电池的负极电极反应式是 ; ②溶液中的阴离子向________电极移动,(填“Al”或“Ag2O/Ag”,下同)向外电路释放电子的电极是_________________ 。
|
|
| 23. | 详细信息 |
|
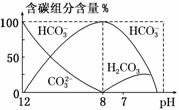
回答下列问题: ①在同一溶液中,H2CO3、HCO3、CO ②当pH=7时,溶液中含碳元素的主要微粒为____________________,溶液中各种离子的物质的量浓度的大小关系为__________________________________; ③已知在25 ℃时,CO
|
|
| 24. | 详细信息 |
|
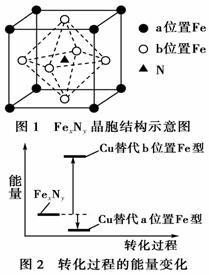
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。 (1)Fe3+基态核外电子排布式为__________。 (2)丙酮( (3)C、H、O三种元素的电负性由小到大的顺序为________。 (4)乙醇的沸点高于丙酮,这是因为________。 (5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为________。
|
|
| 25. | 详细信息 |
|
某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。 (1)A的分子式为________________。 (2)A与溴的四氯化碳溶液反应的化学方程式为________________________________________, 反应类型是________________。 (3)已知: (4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式:______________________________。 (5)在一定条件下,由A聚合得到的高分子化合物的结构简式为__________。
|
|
| 26. | 详细信息 | ||||||||||||
|
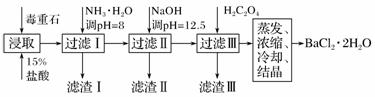
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
(1)
加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是_________________________。 已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。 (2)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。 已知:2CrO 步骤Ⅰ 移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。 步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。 滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的________(填“上方”或“下方”)。BaCl2溶液的浓度为________ mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将________(填“偏大”或“偏小”)。
|
|||||||||||||
 )
) )
)