2017西藏高二下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
化学在生产和生活中有着广泛的应用,下列说法不正确的是 ( ) A. 二氧化硫具有漂白性,可广泛用于食品的增白 B. 鉴别蚕丝和人造丝(纤维素)的方法之一是灼烧,有烧焦羽毛气味的是蚕丝 C. 农村兴建沼气池将秸秆发酵产生沼气,可减少因焚烧带来的环境污染 D. 用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯可达到保鲜的目的
|
|
| 2. | 详细信息 |
|
能与Na反应放出H2,又能使溴水褪色,但不能使pH试纸变色的物质是( ) A. CH2===CH—COOH B. CH2===CH—CH2OH C. CH2===CH—CHO D. CH2===CH—COOCH3
|
|
| 3. | 详细信息 |
|
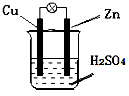
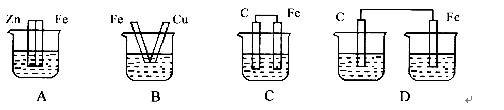
下图各装置中,不能构成原电池的是(烧杯中所盛液体都是稀硫( )
A. A B. B C. C D. D
|
|
| 4. | 详细信息 |
|
如图,X、Y、Z、M、N是元素周期表中前四周期中的五种元素,其中M原子的最外层电子数比次外层电子数多4。下列说法不正确的是( )
A. M形成的常见氢化物有2种 B. M、Y、N的气态氢化物稳定性依次减弱 C. X、Y、Z的含氧酸酸性依次增强 D. Y的一种氧化物是大气污染物,是形成酸雨的主要物质
|
|
| 5. | 详细信息 |
|
2016年1月5日,江西省国土资源厅宣布,该省地质工作者在浮梁县发现超大型钨铜矿。下列有关 A. 它们是钨的三种元素 B. 它们互为同位素 C.
|
|
| 6. | 详细信息 |
|
用NA表示阿伏加德罗常数的数值,下列说法正确的是( ) A. 1 mol苯分子中含有碳碳双键的数目为3 NA B. 标准状况下,11.2 L CCl4中含有的共价键数目为2 NA C. 1 mol乙烯和乙醇的混合物完全燃烧时消耗O2的分子数为3 NA D. 常温常压下,0.5 mol 羟基含有的电子总数为5 NA
|
|
| 7. | 详细信息 |
|
决定化学反应速率的主要因素是( ) A. 参加反应物本身的性质 B. 催化剂 C. 温度和压强以及反应物的接触面 D. 反应物的浓度
|
|
| 8. | 详细信息 |
|
下列化学用语表示正确的是( ) A. 一氯乙烷的结构式 CH3Cl B. 丁烷的结构简式CH3(CH2)2CH3 C. CCl4的电子式
|
|
| 9. | 详细信息 |
|
如图为铜锌原电池示意图,下列关于锌铜原电池的说法正确的是( )
A. 负极发生的反应是:2H+ +2e—=H2↑ B. 溶液中SO42-向铜片的方向移动 C. 该装置实现了化学能转化为电能 D. 若生成0.2mol H2,则有6.5克锌被还原
|
|
| 10. | 详细信息 |
|
下列实验现象中,由于发生取代反应而引起的是( ) A. 乙烯通入溴的四氯化碳溶液中,溶液褪色 B. 甲烷和氯气的混合气体在光照后,瓶壁上有油状液滴附着 C. 苯滴加到溴水中,振荡后水层接近无色 D. 将灼热的铜丝迅速插入乙醇中,反复多次,有刺激性气味产生
|
|
| 11. | 详细信息 |
|
分析下列物质中化学键类型(填字母代号): A.乙烯 B.醋酸钠 C.过氧化钠 D.苛性钠 E.氯化镁 F.氮气 (1)只含离子键的是_____; (2)只含非极性键的是_____; (3)只含离子键和极性键的是_____; (4)只含离子键和非极性键的是_____; (5)同时含有离子键、非极性键和极性键的是_____。
|
|
| 12. | 详细信息 |
|
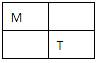
L、M、R、T、W是原子序数依次增大的短周期主族元素,M、T在周期表中的相对位置如下表;L与R原子的最外层电子数相同,R的单质是一种常见的半导体材料。
请回答下列问题: (1)T原子的结构示意图为________,元素W在周期表中位于第________族,M单质分子的电子式为________。 (2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶盛放氢氧化钠溶液的原因是(用化学方程式表示)______________________ 。 (3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)________。 a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R b.高温下,L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T d.同温、同物质的量浓度的Na2LO3和Na2TO4溶液的pH:Na2LO3>Na2TO4,则非金属性T强于L 工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可用于工业炼铁。制备RW4的化学方程式为____________________________。
|
|
| 13. | 详细信息 |
|
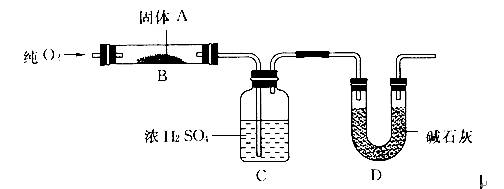
实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图所示(铁架台、铁夹、酒精灯等未画出):
取17.1 g A放入B装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题: (1)通入过量O2的目的是________。 (2)C装置的作用是________;D装置的作用是________。 (3)通过该实验,能否确定A中是否含有氧元素_______________。 (4)若A的摩尔质量为342 g/mol,C装置增重9.9 g,D装置增重26.4 g,则A的分子式为________________。 (5)写出A燃烧的化学方程式:__________________ 。 (6)A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为_________________。
|
|
| 14. | 详细信息 |
|
丙烯(CH2=CH—CH3)是一种重要的基本化工原料。结合以下合成路线,回答下列问题。
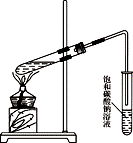
(1)丙烯中所含官能团的名称是_____。 (2)工业上常利用丙烯和氯化氢的反应来制备F,该反应的反应类型是_____。 (3)以丙烯为原料合成有机高分子化合物D。丙烯→D的化学方程式是_____。 (4)已知:2CH3CHO+O2 以丙烯为原料可以合成一种有香味的物质E。实验室可通过下图所示装置来实现。
① A→B的化学方程式是:_____。 ② A+C→E的化学方程式是:_____。 ③若要把制得的E分离出来,应采用的实验操作是_______(填操作名称)。
|
|
- 2018届高三上学期期末考试化学考卷带参考答案和解析(甘肃省武威市第一中学)
- 2016-2017年高一上册化学期中考试考试题(广东省汕头市潮阳区城郊中学)
- 2016-2017年高一上半年化学期中考试考卷带参考答案和解析(福建省泉州市惠南中学)
- 2017-2018年高一12月月考化学考试(山西省祁县中学)
- 2018年高考化学二轮专题复习 专题十一:水溶液中的离子平衡(备考)
- 2017-2018年高一上学期期末考试化学考题带答案和解析(甘肃省武威市第一中学)
- 高中化学人教版 选修三 第3章 晶体结构与性质 晶体与非晶体
- 2016 - 2017年度第二学期期末在线测验高二化学在线测验(北京市西城区)
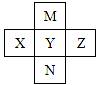
 D.
D.