2019жө·еҚ—й«ҳдәҢдёӢеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еӣҫеғҸдёӯжүҖеҸ‘з”ҹ A. зҮғж”ҫзғҹиҠұ C. зҮғзғ§иңЎзғӣ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ғзҙ дҪҚдәҺdеҢәзҡ„жҳҜ A. CВ В В В В В В В В В В В В В В В В В B. CaВ В В В В В В В В В В В В В В В В C. CrВ В В В В В В В В В В В В В В В В D. Ga
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁзҡ„еҲҶеӯҗдёӯпјҢй”®и§’жңҖеӨ§зҡ„жҳҜ A. H2OВ В В В В В В В В В В В В В В В В B. BF3В В В В В В В В В В В В В В В В В C. CH4В В В В В В В В В В В В В В В В В D. NH3
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
д№ҷзғҜеҲҶеӯҗдёӯзўіеҺҹеӯҗзҡ„жқӮеҢ–зұ»еһӢдёә(гҖҖгҖҖ ) A. spжқӮеҢ–В В В В В В В В В В В В В B. sp2жқӮеҢ–В В В В В В В В В В В В C. sp3жқӮеҢ–В В В В В В В В В В В В В D. йғҪдёҚжҳҜ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—дәӢе®һпјҢдёҚиғҪз”Ёж°ўй”®зҹҘиҜҶи§ЈйҮҠзҡ„жҳҜ (В В В В В ) A. ж°ҙжҜ”зЎ«еҢ–ж°ўзЁіе®ҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В B. ж°ҙе’Ңд№ҷйҶҮеҸҜд»Ҙе®Ңе…Ёдә’жә¶ C. еҶ°зҡ„еҜҶеәҰжҜ”ж¶ІжҖҒж°ҙзҡ„еҜҶеәҰе°ҸВ В В В В В В В В В В В В В В В В В D. ж°ҹеҢ–ж°ўзҡ„жІёзӮ№й«ҳдәҺж°ҜеҢ–ж°ў
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢәеҲ«жҷ¶дҪ“дёҺйқһжҷ¶дҪ“зҡ„жңҖ科еӯҰзҡ„ж–№жі•жҳҜ(В В В ) A. и§ӮеҜҹиҮӘиҢғжҖ§В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В B. и§ӮеҜҹеҗ„еҗ‘ејӮжҖ§ C. жөӢе®ҡеӣәе®ҡзҶ”зӮ№В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В D. иҝӣиЎҢXпјҚе°„зәҝиЎҚе°„е®һйӘҢ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁж ёз”өиҚ·ж•°дёә26зҡ„е…ғзҙ Feзҡ„еҺҹеӯҗж ёеӨ–3dгҖҒ4s иҪЁйҒ“еҶ…пјҢдёӢеҲ—з”өеӯҗжҺ’еёғеӣҫжӯЈзЎ®зҡ„жҳҜпјҲпјү A. C.
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҸҸиҝ°дёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү A. CS2В дёәз©әй—ҙжһ„еһӢдёәVеҪўзҡ„жһҒжҖ§еҲҶеӯҗ B. еҸҢеҺҹеӯҗжҲ–еӨҡеҺҹеӯҗеҪўжҲҗзҡ„ж°”дҪ“еҚ•иҙЁдёӯпјҢдёҖе®ҡжңүПғй”®пјҢеҸҜиғҪжңүПҖй”® C. ж°ўеҺҹеӯҗз”өеӯҗдә‘зҡ„дёҖдёӘе°Ҹй»‘зӮ№иЎЁзӨәдёҖдёӘз”өеӯҗ D. SiF4е’ҢSO32-В зҡ„дёӯеҝғеҺҹеӯҗеқҮдёәsp3жқӮеҢ–
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
ж¶Іж°ЁжҳҜеҜҢж°ўзү©иҙЁпјҢжҳҜж°ўиғҪзҡ„зҗҶжғіиҪҪдҪ“гҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A. NH3еҲҶеӯҗдёӯж°®еҺҹеӯҗзҡ„жқӮеҢ–ж–№ејҸдёәsp3жқӮеҢ– B. [Cu(NH3)4]2пјӢдёӯпјҢNH3еҲҶеӯҗжҳҜй…ҚдҪ“ C. зӣёеҗҢеҺӢејәдёӢпјҢNH3зҡ„жІёзӮ№жҜ”PH3зҡ„жІёзӮ№дҪҺ D. NH4+дёҺPH4+гҖҒCH4гҖҒBH4-дә’дёәзӯүз”өеӯҗдҪ“
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
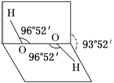
е·ІзҹҘH2O2еҲҶеӯҗзҡ„з©әй—ҙз»“жһ„еҸҜеңЁдәҢйқўи§’дёӯиЎЁзӨәпјҢеҰӮеӣҫжүҖзӨәпјҢдёӢеҲ—жңүе…іH2O2з»“жһ„зҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
A. H2O2дёӯжңү3дёӘПғй”®гҖҒ1дёӘПҖй”® B. H2O2дёәйқһжһҒжҖ§еҲҶеӯҗ C. H2O2дёӯж°§еҺҹеӯҗдёәsp3жқӮеҢ– D. H2O2жІёзӮ№й«ҳиҫҫ158 в„ғпјҢеҸҜжҺЁжөӢH2O2еҲҶеӯҗй—ҙеҸҜеҪўжҲҗж°ўй”®
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
й«ҳжё©дёӢпјҢи¶…ж°§еҢ–й’ҫжҷ¶дҪ“е‘Ҳз«Ӣж–№дҪ“з»“жһ„пјҢжҷ¶дҪ“дёӯж°§зҡ„еҢ–еҗҲд»·йғЁеҲҶдёә0д»·пјҢйғЁеҲҶдёә-2д»·гҖӮеҰӮеӣҫжүҖзӨәдёәи¶…ж°§еҢ–й’ҫжҷ¶дҪ“зҡ„дёҖдёӘжҷ¶иғһпјҢеҲҷдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
A. и¶…ж°§еҢ–й’ҫзҡ„еҢ–еӯҰејҸдёәKO2пјҢжҜҸдёӘжҷ¶иғһеҗ«жңү4дёӘKпјӢе’Ң4дёӘO2- B. жҷ¶дҪ“дёӯжҜҸдёӘKпјӢе‘Ёеӣҙжңү8дёӘO2-пјҢжҜҸдёӘO2-е‘Ёеӣҙжңү8дёӘKпјӢ C. жҷ¶дҪ“дёӯдёҺжҜҸдёӘKпјӢи·қзҰ»жңҖиҝ‘зҡ„KпјӢжңү8дёӘ D. жҷ¶дҪ“дёӯдёҺжҜҸдёӘKпјӢи·қзҰ»жңҖиҝ‘зҡ„KпјӢжңү6дёӘ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іжҷ¶дҪ“зҡ„еҸҷиҝ°дёӯпјҢжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү A. ж°ҜеҢ–й’ е’Ңж°ҜеҢ–й“Ҝжҷ¶дҪ“дёӯпјҢйҳізҰ»еӯҗзҡ„й…ҚдҪҚж•°еқҮдёә6 B. йҮ‘еҲҡзҹідёәдёүз»ҙзҪ‘зҠ¶з»“жһ„пјҢз”ұзўіеҺҹеӯҗд»Ҙsp3жқӮеҢ–иҪЁйҒ“еҪўжҲҗе…ұд»·й”® C. йҮ‘еұһй’ зҡ„жҷ¶дҪ“йҮҮз”ЁдҪ“еҝғз«Ӣж–№е Ҷз§ҜпјҢжҜҸдёӘжҷ¶иғһеҗ«2дёӘеҺҹеӯҗпјҢй…ҚдҪҚж•°дёә8 D. е№ІеҶ°жҷ¶дҪ“дёӯпјҢжҜҸдёӘCO2еҲҶеӯҗе‘Ёеӣҙзҙ§йӮ»8дёӘCO2еҲҶеӯҗ
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
зҹӯе‘Ёжңҹе…ғзҙ DгҖҒEгҖҒXгҖҒYгҖҒZеҺҹеӯҗеәҸж•°йҖҗжёҗеўһеӨ§гҖӮе®ғ们зҡ„жңҖз®Җж°ўеҢ–зү©еҲҶеӯҗзҡ„з©әй—ҙжһ„еһӢдҫқж¬ЎжҳҜжӯЈеӣӣйқўдҪ“гҖҒдёүи§’й”ҘеҪўгҖҒжӯЈеӣӣйқўдҪ“гҖҒи§’еҪў(VеҪў)гҖҒзӣҙзәҝеҪўгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)Yзҡ„жңҖй«ҳд»·ж°§еҢ–зү©зҡ„еҢ–еӯҰејҸдёә________пјӣZзҡ„ж ёеӨ–з”өеӯҗжҺ’еёғејҸжҳҜ________пјӣ (2)Dзҡ„жңҖй«ҳд»·ж°§еҢ–зү©дёҺEзҡ„дёҖз§Қж°§еҢ–зү©дёәзӯүз”өеӯҗдҪ“пјҢеҶҷеҮәEзҡ„ж°§еҢ–зү©зҡ„еҢ–еӯҰејҸ________пјӣ (3)Dе’ҢYеҪўжҲҗзҡ„еҢ–еҗҲзү©пјҢе…¶еҲҶеӯҗзҡ„з©әй—ҙжһ„еһӢдёә________пјӣDеҺҹеӯҗзҡ„иҪЁйҒ“жқӮеҢ–ж–№ејҸжҳҜ________пјӣ (4)йҮ‘еұһй•Ғе’ҢEзҡ„еҚ•иҙЁеңЁй«ҳжё©дёӢеҸҚеә”еҫ—еҲ°зҡ„дә§зү©дёҺж°ҙеҸҚеә”з”ҹжҲҗдёӨз§ҚзўұжҖ§зү©иҙЁпјҢиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜ________гҖӮ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||
|
(1)иҜ·е°ҶдёӢеҲ—еҸҳеҢ–иҝҮзЁӢдёӯз ҙеқҸзҡ„еҫ®зІ’й—ҙдҪңз”ЁеҠӣеҗҚз§°зҡ„зј–еҸ·еЎ«еңЁжЁӘзәҝдёҠпјҡ AпјҺе…ұд»·й”®В В В В В В В В BпјҺзҰ»еӯҗй”®В В В В В CпјҺйҮ‘еұһй”® В В В В В В В В DпјҺеҲҶеӯҗй—ҙдҪңз”ЁеҠӣ в‘ ж°ўж°§еҢ–й’ зҶ”еҢ–_____пјӣв‘Ўе№ІеҶ°еҚҮеҚҺ_____пјӣ в‘ўдәҢж°§еҢ–зЎ…зҶ”еҢ–_____пјӣв‘Јй’ зҶ”еҢ–_____гҖӮ (2)еҚ•иҙЁзЎјжңүж— е®ҡеҪўе’Ңжҷ¶дҪ“дёӨз§ҚпјҢеҸӮиҖғдёӢиЎЁж•°жҚ®гҖӮ
в‘ ж №жҚ®иЎЁдёӯж•°жҚ®еҲӨж–ӯжҷ¶дҪ“зЎјзҡ„жҷ¶дҪ“зұ»еһӢеұһдәҺ_______жҷ¶дҪ“пјӣ в‘ЎиҜ·и§ЈйҮҠйҮ‘еҲҡзҹізҡ„зҶ”жІёзӮ№й«ҳдәҺжҷ¶дҪ“зЎ…зҡ„еҺҹеӣ жҳҜ_________гҖӮ гҖҗзӯ”жЎҲгҖ‘В В В (1). BВ В В (2). DВ В В (3). AВ В В (4). CВ В В (5). еҺҹеӯҗВ В В (6). CвҖ”Cй”®й•ҝжҜ”SiвҖ”Siй”®й•ҝзҹӯпјҢжүҖд»ҘCвҖ”Cй”®иғҪжҜ”SiвҖ”Siй”®иғҪеӨ§пјҢзҶ”еҢ–жҲ–жұҪеҢ–жүҖйңҖиҰҒзҡ„иғҪйҮҸеӨҡпјҢжүҖд»ҘйҮ‘еҲҡзҹізҡ„зҶ”гҖҒжІёзӮ№жҜ”жҷ¶дҪ“зЎ…й«ҳ
|
|||||||||||||||||
| 15. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
иҜ·з”ЁCгҖҒHгҖҒOгҖҒNгҖҒSВ дә”з§Қе…ғзҙ еӣһзӯ”дёӢеҲ—й—®йўҳ (1)йҷӨHВ еӨ–пјҢе…¶е®ғеӣӣз§Қе…ғзҙ дёӯпјҢ第дёҖз”өзҰ»иғҪжңҖеӨ§зҡ„е…ғзҙ еҹәжҖҒеҺҹеӯҗз”өеӯҗжҺ’еёғеӣҫдёә______________пјҢз”өиҙҹжҖ§жңҖеӨ§зҡ„е…ғзҙ еҹәжҖҒеҺҹеӯҗж ёеӨ–з”өеӯҗиҝҗеҠЁзҠ¶жҖҒе…ұжңү_________з§ҚгҖӮ (2)дә”з§Қе…ғзҙ дёӯпјҢз”ұе…¶дёӯдёӨз§Қе…ғзҙ жһ„жҲҗз”ІгҖҒд№ҷгҖҒдёҷгҖҒдёҒеӣӣз§ҚеҲҶеӯҗпјҢжүҖеҗ«еҺҹеӯҗзҡ„ж•°зӣ®дҫқж¬Ўдёә3гҖҒ4гҖҒ6гҖҒ8пјҢйғҪеҗ«жңү18В дёӘз”өеӯҗгҖӮз”Іе’Ңд№ҷзҡ„дё»иҰҒзү©зҗҶжҖ§иҙЁжҜ”иҫғеҰӮдёӢпјҡ
в‘ 1molВ д№ҷеҲҶеӯҗеҗ«жңү_________дёӘПғй”®пјӣ в‘ЎдёҒеҲҶеӯҗзҡ„дёӯеҝғеҺҹеӯҗйҮҮеҸ–_________жқӮеҢ–ж–№ејҸпјӣз”ІеҲҶеӯҗзҡ„VSEPRжЁЎеһӢдёә_________пјҢдёҷеҲҶеӯҗдёә_________В (вҖңжһҒжҖ§вҖқжҲ–вҖңйқһжһҒжҖ§вҖқ)В еҲҶеӯҗгҖӮ
|
|||||||||||||
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
дёңжҷӢгҖҠеҚҺйҳіеӣҪеҝ—В·еҚ—дёӯеҝ—гҖӢеҚ·еӣӣдёӯе·Іжңүе…ідәҺзҷҪй“ң пјҲ1пјүй•Қе…ғзҙ еҹәжҖҒеҺҹеӯҗзҡ„з”өеӯҗжҺ’еёғејҸдёә______пјҢ3dиғҪзә§дёҠзҡ„жңӘжҲҗеҜ№з”өеӯҗж•°дёә_______гҖӮ пјҲ2пјүзЎ«й…ёй•Қжә¶дәҺж°Ёж°ҙеҪўжҲҗ[Ni(NH3)6]SO4и“қиүІжә¶ж¶ІгҖӮ в‘ [Ni(NH3)6]SO4дёӯйҳҙзҰ»еӯҗзҡ„з«ӢдҪ“жһ„еһӢжҳҜ________гҖӮ в‘ЎеңЁ[Ni(NH3)6]SO4дёӯNi2+дёҺNH3д№Ӣй—ҙеҪўжҲҗзҡ„еҢ–еӯҰй”®з§°дёә_______пјҢжҸҗдҫӣеӯӨз”өеӯҗеҜ№зҡ„жҲҗй”®еҺҹеӯҗжҳҜ________гҖӮ пјҲ3пјүеҚ•иҙЁй“ңеҸҠй•ҚйғҪжҳҜз”ұ______й”®еҪўжҲҗзҡ„жҷ¶дҪ“пјӣе…ғзҙ й“ңдёҺй•Қзҡ„第дәҢз”өзҰ»иғҪеҲҶеҲ«дёәпјҡICu=1 958 kJВ·molвҖ“1гҖҒINi=1 753 kJВ·molвҖ“1пјҢICu> INiзҡ„еҺҹеӣ жҳҜ_______________________гҖӮ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
(1)CгҖҒNгҖҒOгҖҒAlгҖҒSiгҖҒCuжҳҜеёёи§Ғзҡ„е…ӯз§Қе…ғзҙ гҖӮ в‘ SiдҪҚдәҺе…ғзҙ е‘Ёжңҹ表第________е‘Ёжңҹ第________ж—ҸгҖӮ в‘ЎCзҡ„еҹәжҖҒеҺҹеӯҗж ёеӨ–з”өеӯҗжҺ’еёғејҸдёә________пјӣCuзҡ„еҹәжҖҒеҺҹеӯҗжңҖеӨ–еұӮжңү________дёӘз”өеӯҗгҖӮ (2)в‘ NгҖҒAlгҖҒSiгҖҒZnеӣӣз§Қе…ғзҙ дёӯпјҢжңүдёҖз§Қе…ғзҙ зҡ„з”өзҰ»иғҪж•°жҚ®еҰӮдёӢпјҡ
еҲҷиҜҘе…ғзҙ жҳҜ________(еЎ«еҶҷе…ғзҙ з¬ҰеҸ·)гҖӮ в‘ЎеҹәжҖҒй”—(Ge)еҺҹеӯҗзҡ„з”өеӯҗжҺ’еёғејҸжҳҜ________гҖӮGeзҡ„жңҖй«ҳд»·ж°ҜеҢ–зү©зҡ„еҲҶеӯҗејҸжҳҜ________гҖӮ в‘ўGeе…ғзҙ еҸҜиғҪзҡ„жҖ§иҙЁжҲ–еә”з”Ёжңү________гҖӮ AпјҺжҳҜдёҖз§Қжҙ»жіј CпјҺе…¶еҚ•иҙЁеҸҜдҪңдёәеҚҠеҜјдҪ“жқҗж–ҷВ В В В В DпјҺе…¶жңҖй«ҳд»·ж°ҜеҢ–зү©зҡ„жІёзӮ№дҪҺдәҺе…¶жәҙеҢ–зү©зҡ„жІёзӮ№
|
|||||||||||||
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
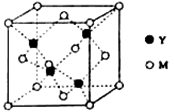
MжҳҜ第еӣӣе‘Ёжңҹе…ғзҙ пјҢжңҖеӨ–еұӮеҸӘжңү1дёӘз”өеӯҗпјҢж¬ЎеӨ–еұӮзҡ„жүҖжңүеҺҹеӯҗиҪЁйҒ“еқҮе……ж»Ўз”өеӯҗгҖӮе…ғзҙ Yзҡ„иҙҹдёҖд»·зҰ»еӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°дёҺж¬ЎеӨ–еұӮзҡ„зӣёеҗҢгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)еҚ•иҙЁMзҡ„жҷ¶дҪ“зұ»еһӢдёә________пјҢе…¶дёӯMеҺҹеӯҗзҡ„й…ҚдҪҚж•°дёә________гҖӮ (2)е…ғзҙ YеҹәжҖҒеҺҹеӯҗзҡ„ж ёеӨ–з”өеӯҗжҺ’еёғејҸдёә________пјҢе…¶еҗҢе‘Ёжңҹе…ғзҙ дёӯпјҢ第дёҖз”өзҰ»иғҪжңҖеӨ§зҡ„жҳҜ________(еҶҷе…ғзҙ з¬ҰеҸ·)гҖӮ (3)MдёҺYеҪўжҲҗзҡ„дёҖз§ҚеҢ–еҗҲзү©зҡ„з«Ӣж–№жҷ¶иғһеҰӮеӣҫжүҖзӨәгҖӮ
в‘ иҜҘеҢ–еҗҲзү©зҡ„еҢ–еӯҰејҸдёә________пјҢе·ІзҹҘжҷ¶иғһеҸӮж•°aпјқ0.542 nmпјҢжӯӨжҷ¶дҪ“зҡ„еҜҶеәҰдёә__________gВ·cmпјҚ3гҖӮ(еҶҷеҮәи®Ўз®—ејҸпјҢдёҚиҰҒжұӮи®Ўз®—з»“жһңгҖӮйҳҝдјҸеҠ еҫ·зҪ—еёёж•°дёәNA) в‘ЎжӯӨеҢ–еҗҲзү©зҡ„ж°Ёж°ҙжә¶ж¶ІйҒҮеҲ°з©әж°”иў«ж°§еҢ–дёәж·ұи“қиүІпјҢе…¶дёӯйҳізҰ»еӯҗзҡ„еҢ–еӯҰејҸдёә________гҖӮ
|
|
- 2018иҮі2019й«ҳдәҢ5жңҲиҒ”иҖғеҢ–еӯҰйўҳејҖеҚ·жңүзӣҠпјҲиҫҪе®ҒзңҒеҮӨеҹҺеёӮпјү
- 2018-2019е№ҙй«ҳдёҖдёҠеҶҢ第дёүж¬Ўж•ҷеӯҰиҙЁйҮҸжЈҖжөӢеҢ–еӯҰйўҳејҖеҚ·жңүзӣҠпјҲеұұиҘҝзңҒеҝ»е·һеёӮе®һйӘҢдёӯеӯҰпјү
- жө·еҚ—зңҒдёҮе®ҒеёӮеҢ—дә¬еёҲиҢғеӨ§еӯҰдёҮе®Ғйҷ„еұһдёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёӢеҶҢејҖеӯҰиҖғиҜ•еҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- дә‘еҚ—зңҒејҘеӢ’еёӮ第дёҖдёӯеӯҰ2020-2021е№ҙй«ҳдәҢдёӢеҚҠе№ҙејҖеӯҰжөӢиҜ•еҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ
- зҹіе®¶еә„е®һйӘҢдёӯеӯҰй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҲиҖғиҜ•еҚ·иҖғиҜ•е®Ңж•ҙзүҲ
- ж№–ж№ҳж•ҷиӮІдёүж–°жҺўзҙўеҚҸдҪңдҪ“ 2020-2021е№ҙй«ҳдёҖ11жңҲиҒ”иҖғеҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ
- 2019е№ҙж№–еҚ—зңҒйғҙе·һеёӮй«ҳдёү第дёҖж¬Ўж•ҷеӯҰиҙЁйҮҸзӣ‘жөӢеҢ–еӯҰиҖғиҜ•е®Ңж•ҙзүҲ
- 2018иҮі2019е№ҙй«ҳдёҖеҗҺеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲеҢ—дә¬еёҲиҢғеӨ§еӯҰйҷ„еұһдёӯеӯҰпјү
 В В В В В В В В В В В В В В В В B. йң“иҷ№зҒҜе№ҝе‘Ҡ
В В В В В В В В В В В В В В В В B. йң“иҷ№зҒҜе№ҝе‘Ҡ
 В В В В В В В В В В В В В В В В В В D. е№ійқўй•ңжҲҗеғҸ
В В В В В В В В В В В В В В В В В В D. е№ійқўй•ңжҲҗеғҸ