2018江西高三上学期人教版高中化学高考模拟
| 1. | 详细信息 | ||||||||||||||||||
|
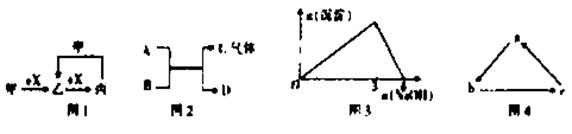
分类法是一种行之有效、简单易行的科学方法。某同学用如下表所示的形式对所学知识进行分类,其中甲与乙、丙、丁是包含关系。其中正确的组合是
A.①② B. ②③⑤ C. ③④⑤ D. ①④⑤
|
|||||||||||||||||||
| 2. | 详细信息 |
|
标准状况下VL氨气溶解在1L水中(水的密度近似为lg/ml),所得溶液的密度为ρg/ml,质量分数为W,物质浓度为cmol/L,则下列关系中不正确的是 A. W= 17V/(17V+22400) B. W= 17c/(l000ρ) C.ρ= (17V+ 22400)/(22.4 + 22.4V) D. c=1000Vρ/(17V+22400)
|
|
| 3. | 详细信息 |
|
用二氧化硅和金属氧化物的形式表示硅酸盐的形成,不正确的是 A.正长石[KAlSi3O8]:K2O·Al2O3·3SiO2 B.镁橄榄石[Mg2SiO4]:2MgO·SiO2 C.钙沸石[CaAl2Si3O10·3H2O]: CaO·Al2O3·3SiO2·3H2O D.高岭石[Al2(Si2O5)(OH)4]:Al2O3·2SiO2·2H2O
|
|
| 4. | 详细信息 |
|
下列化学用语表示正确的是 A.甲酸甲酯的结构简式:HCOOCH3 B.Cl-的结构示意图: C.中子数为16的硫原子:
|
|
| 5. | 详细信息 | |||||||||||||||
|
根据下列金属的熔沸点:
A.Cu与Al B.Fe与Na C. Fe与Cu D . Al与Na
|
||||||||||||||||
| 6. | 详细信息 |
|
含有下列各组离子的溶液中,通入(或加入)过量的某种物质后仍能大量共存的是 A.H+、Ba2+、Fe3+、NO3-,通入SO2气体 B.AlO2-、Na+、Br-、SO42-,通入CO2气体 C.Ca2+、Cl-、K+、H+,通入CO2气体 D.HCO3-、Na+、I-、HS-,加入AlCl3溶液
|
|
| 7. | 详细信息 |
|
设NA为阿伏伽德罗常数的值,下列说法正确的是 A.25℃时,100mLpH=2的新制氯水中:n(OH-)+n(ClO-)+n(HClO)=0.001NA B.22.4L氯气与足量镁粉充分反应后,转移的电子数为2NA C.7.8g的Na2S和Na2O2的混合物中所含离子数为0.3NA D.含0.2molH2SO4的浓硫酸与足量的铜反应,转移的电子数为0.2NA
|
|
| 8. | 详细信息 | ||||||||||||||||||||
|
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
|
|||||||||||||||||||||
| 9. | 详细信息 |
|
甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,他们之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是
A.若甲为Al(OH)3,则戊可能为NaOH B.若甲为Na2CO3,则丁可能为CO2 C.若甲为N2,则丁可能为O2 D.若甲为Fe,则戊可能是盐酸
|
|
| 10. | 详细信息 |
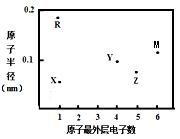
|
短周期元素X、Y、Z、M、R的原子半径和最外层电子数之间的关系如右图所示。下列说法正确的是
A.化合物X2M是弱电解质 B.Y、Z的氧化物均能溶于水 C.M的单质在常温下为气体 D.化合物RX中含共价键
|
|
| 11. | 详细信息 |
|
下列反应的离子方程式表达正确的是 A.FeCl3溶液中滴加HI溶液:2Fe3++2HI==2Fe2++2H++I2 B.Na2S2O3溶液中滴加过量稀H2SO4:3S2O32-+2H+=4S↓+2SO42-+H2O C.NH4HCO3溶液中滴加少量Ba(OH)2溶液:NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3·H2O+H2O D.1 mol•L-1 NaAlO2溶液和4mol•L-1的HCl溶液等体积混合:AlO2-+4H+ =Al3++2H2O
|
|
| 12. | 详细信息 |
|
如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是
A.过氧化钠 B.钠 C.氧化钠 D.钾
|
|
| 13. | 详细信息 | |||||||||||||||
|
一种白色固体可能由Na+、Ba2+、Cl-、Br-、HCO3-、SO32-、SO42-离子中的若干种组成,陶宝同学设计实验检验其组成,记录如下:
下列关于固体组成的结论错误的是 A. 肯定不含Ba2+,一定含有Cl- B.至少含有SO32-、SO42-中的一种离子 C. 肯定含有HCO3-和Br- D.无需焰色反应即可断定溶液中含有Na+
|
||||||||||||||||
| 14. | 详细信息 |
|
下列有关物质转化关系的说法中不正确的是
A.图1中甲可能是Cl2,X可能是Fe B.图2中反应一定是置换反应或复分解反应 C.图3中是向某溶液中滴加NaOH溶液的变化图像,原溶质可能是Al2(SO4)3 D.图4中a可能为NaOH,b可能为Na2CO3,c可能为NaHCO3
|
|
| 15. | 详细信息 |
|
某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成硫单质2.4g,FeCl2 0.425mol和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是 A.该磁黄铁矿中FexS的x=0.85 B.生成的H2S气体在标准状况下的体积为2.24L C.100mL的盐酸中HCl物质的量浓度为7.5mol/L D.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
|
|
| 16. | 详细信息 |
|
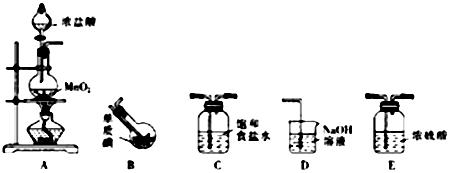
一氯化碘(沸点97.4℃)是一种红棕色易挥发的液体,不溶于水,溶于乙醇和乙酸。某校研究性学习小组的同学拟制备一氯化碘。回答下列问题: (1)甲组同学拟利用干燥、纯净的氯气与碘反应制备一氯化碘,其装置如下:(已知碘与氯气的反应为放热反应)
①各装置连接顺序为A→_________________;A装置中发生反应的离子方程式为_____________________________。 ②B装置烧瓶需放在冷水中,其目的是_____________________,D装置的作用是_________________。 ③将B装置得到的液态产物进一提纯可得到较纯净的ICl,则提纯采取的操作方法是______________。(2)乙组同学采用的是最新报道的制一氯化碘的方法。即在三颈烧瓶中加入粗碘和盐酸,控制温度约50℃,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘。则发生反应的化学方程式为_______________________________。 (3)设计实验证明: ①ICl的氧化性比I2强:__________________________。 ②ICl与乙烯作用发生加成反应:_________________________。
|
|
| 17. | 详细信息 |
|
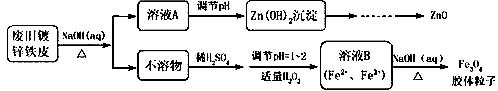
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题: (1)用NaOH溶液处理废旧镀锌铁皮的作用有______________。 A.去除油污 B.溶解镀锌层 C.去除铁锈 D.钝化 (2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是_____、洗涤、灼烧。 (3)Fe3O4胶体粒子能否用减压过滤法实现固液分离?_____________(填“能”或“不能”),理由是___________________。 (4)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是________________。 (5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000 mol/L的K2Cr2O7标准溶液250mL,应准确称取_____g K2Cr2O7(保留四位有效数字,已知M(K2Cr2O7)= 294.0 g/mol)。
|
|
| 18. | 详细信息 |
|
钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业利用碘、NaOH和铁屑为原料可生产碘化钠,其生产流程如图所示:
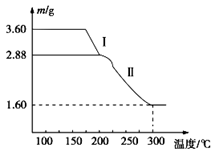
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1∶1,则该反应的离子方程式为__________________________ 。 (2)生产流程中加入过量铁屑的目的是_________________________,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是__________________________ _______。 (3)溶液2中除含有H+外,一定含有的阳离子是______ _______;试设计实验证实该金属阳离子的存在:_____________________。 (4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60 g草酸亚铁晶体(相对分子质量是180)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:
①分析图中数据,根据信息写出过程I发生的化学方程式:______________________ ______。 ②300℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式:________ ____。
|
|
| 19. | 详细信息 |
|
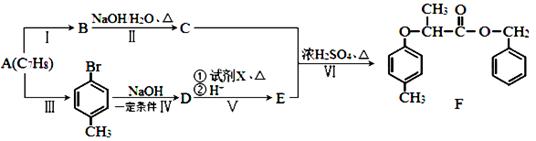
有机物F是一种香料,其合成路线如图所示:
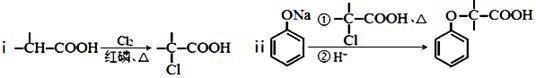
已知: (1)A的名称为___________,D转化为E时①处试剂的结构简式为 _____________________,步骤Ⅵ的反应类型为 _______________________。 (2)步骤Ⅱ反应的化学方程式为______________________________________。 (3)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3溶液发生显色反应,③能发生水解反应和银镜反应)的E的同分异构体有___________种,其中核磁共振氢谱峰面积比为6︰2︰2︰1︰1的分子结构简式为_______________________________。 ⑷依据题中信息,完成以为(CH3) 2CHCH2OH原料制取的合成(CH3)2CClCOOH路线图。 合成路线图示例如下:CH2=CH2
|
|