吉林省长春市第二十九中学2021届高三上半期期末考试化学在线测验完整版
| 1. 选择题 | 详细信息 |
|
下列实验操作正确的是( ) A. 先装好药品,再检查装置的气密性 B. 先用双手捂紧试管,再将导管插入水中检查装置的气密性 C. 氢气还原氧化铜的实验,先通一段时间的氢气,后加热 D. 稀释浓硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌 |
|
| 2. 选择题 | 详细信息 |
|
下列说法正确的是 A. 18O2和16O2互为同位素 B. 正己烷和2,2−二甲基丙烷互为同系物 C. C60和C70是具有相同质子数的不同核素 D. H2NCH2COOCH3和CH3CH2NO2是同分异构体 |
|
| 3. 选择题 | 详细信息 | ||||||||||||||||||||
根据SO2通入不同溶液中的实验现象,所得结论不正确的是( )
|
|||||||||||||||||||||
| 4. 选择题 | 详细信息 |
|
下列解释工业生产或应用的化学用语中,不正确的是 A. FeCl3溶液刻蚀铜电路板:2Fe3++Cu==2Fe2++Cu2+ B. Na2O2用作供氧剂:Na2O2+H2O==2NaOH +O2↑ C. 氯气制漂白液:Cl2+2NaOH==NaCl+NaClO +H2O D. Na2CO3溶液处理水垢:CaSO4(s)+CO32− |
|
| 5. 选择题 | 详细信息 | ||||||||||||||||||||
下图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是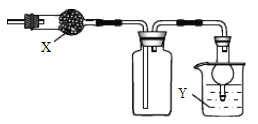
|
|||||||||||||||||||||
| 6. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值。用次氯酸钠处理氨氮(NH3)废水的主要化学反应方程式为:3NaClO+2NH3•H2O=3NaCl+N2↑+5H2O。下列说法正确的是 A.1L0.1mol•L-1的NaClO溶液中,ClO-的数目小于0.1NA B.当反应转移电子6NA,则生成22.4LN2 C.0.lmol•L-1的氨水中,c(NH4+)+c(NH3•H2O)=0.lmol•L-1 D.溶液中水的电离程度:氨水大于NaClO溶液 |
|
| 7. 选择题 | 详细信息 |
|
古往今来传颂着许多与酒相关的古诗词,其中“葡萄美酒夜光杯,欲饮琵琶马上催”较好地表达了战士出征前开杯畅饮的豪迈情怀。下列说法错误的是( ) A.忽略酒精和水之外的其它成分,葡萄酒的度数越高密度越小 B.古代琵琶的琴弦主要由牛筋制成,牛筋的主要成分是蛋白质 C.制作夜光杯的鸳鸯玉的主要成分为3MgO•4SiO2•H2O,属于氧化物 D.红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯 |
|
| 8. 选择题 | 详细信息 |
|
有机物G( A.分子式为C11H14O B.一氯代物有8种(不考虑立体异构) C.所有碳原子可能在同一平面上 D.能发生取代、加成、氧化反应 |
|
| 9. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.因SO2具有漂白性,所以能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色 B.能使品红溶液褪色的物质不一定是SO2 C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同 D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好 |
|
| 10. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.36 g由35Cl和37Cl组成的氯气中所含质子数一定为17NA B.一定条件下,6.4 g铜与过量的硫粉反应,转移电子数目为0.2NA C.常温常压下,水蒸气通过过氧化钠使其增重4 g时,反应中转移的电子数为2NA D.0.4 mol NH3与0.6 mol O2在加热及催化剂条件下充分反应,得到NO的分子数为0.4NA |
|
| 11. 选择题 | 详细信息 |
.室温下,向20 mL某醋酸溶液中滴入等浓度的NaOH溶液,溶液中水电离出的氢离子浓度随加入的NaOH溶液体积的变化如图所示。下列分析正确的是( )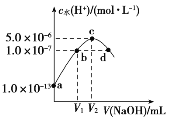 A.醋酸溶液浓度为0.1 mol·L-1 B.V1=20 mL C.c点所示溶液中c(CH3COOH)=c(OH-)-c(H+) D.d点所示溶液中c(Na+)=c(CH3COO-) |
|
| 12. 选择题 | 详细信息 |
将二氧化钛(TiO2)光电极嵌入到新型钠离子电池的正极,由于光电势的补偿,电池的充电电位下降。该光电极辅助充电时的工作原理如图所示,下列说法错误的是 A.充电时阳极的电极反应式为3I--2e-=I3- B.放电时,a极发生氧化反应 C.放电时,正、负极反应的微粒数目比为4:3 D.辅助充电时,光能转化为电能,再转化为化学能 |
|
| 13. 选择题 | 详细信息 |
|
根据元素周期表和元素周期律,判断下列叙述不正确的是 A.气态氢化物的稳定性:H2O>NH3>SiH4 B.氢元素与其他元素可形成共价化合物或离子化合物 C.如图所示实验可证明元素的非金属性:Cl>C>Si  D.用中文“ |
|
| 14. 选择题 | 详细信息 |
BeCl2是有机反应的催化剂。铍和氯气反应的能量变化如图所示。下列说法正确的是( ) A.E2是正反应的活化能 B.该反应的ΔH<0 C.加入催化剂,ΔH减小 D.ΔH = E2 - E1 |
|
| 15. | 详细信息 | ||||
|
SO2随意排放会造成严重的大气污染。下列是某小组同学设计处理烟气(主要含SO2、N2、O2、粉尘)中SO2的方法。 (1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:  ①“吸收装置”中发生反应的离子方程式是___________。 ②合成塔中每合成1 mol气体放出热量92.3 kJ(25 ℃、101 kPa),反应的热化学方程式是___________。 ③上述流程中循环利用的物质是___________。 (2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2。 ①该反应的离子方程式是___________(反应a)。为验证该反应,同学们将SO2通入0.05 mol·L-1 FeCl3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色。 关于红褐色液体,以下是同学们的分析推测与实验。
②利用胶体的___________(填性质)可以检验步骤ⅰ中是否得到了Fe(OH)3胶体。 |
|||||
| 16. | 详细信息 |
|
随着科学技术的发展和环保要求不断提高,CO2的捕集利用技术成为研究的重点。 Ⅰ.工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应: NH3(l)+H2O(l)+CO2(g) 2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq)+H2O(l)+CO2(g) 则ΔH3=___________(用含ΔH1、ΔH2的代数式表示)。 Ⅱ.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的化学反应方程式为CO2(g)+4H2(g) (1)该反应的ΔS___________0(填“>”“<”或“=”),该反应的ΔH___________0(填“>”或“<”)。 (2)在恒容密闭容器中通入等物质的量的CO2和H2并发生上述反应,T ℃下,CO2物质的量浓度c(CO2)随时间t变化的曲线如图所示。下列能说明反应达到平衡状态的是___________(填字母代号)。  A.体系压强保持不变 B.混合气体密度保持不变 C.甲烷和水蒸气的物质的量之比保持不变 D.H2的质量分数保持不变 (3)T ℃下,反应前20 s的平均反应速率v(H2)=___________(用含a、b的代数式表示)。 (4)T ℃下,该反应的平衡常数K=___________(用含a、b的代数式表示)。 (5)若降低温度,反应重新达到平衡,则v(正)___________;CO2转化率___________(填“增大”“减小”或“不变”)。 |
|
| 17. | 详细信息 |
|
2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。 (1)自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈________,可以认为存在锂元素。 A.紫红色 B.紫色 C.黄色 (2)工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下: 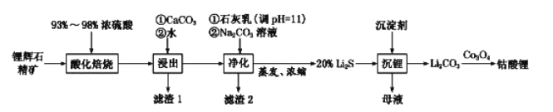 已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图1。 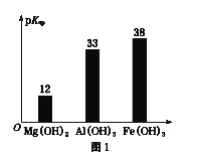 回答下列问题: ①锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为________。 ②为提高“酸化焙烧”效率,常采取的措施是________。 ③向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______。(已知:完全沉淀后离子浓度低于1×l0-5)mol/L) ④“沉锂”过程所获得的“母液”中仍含有大量的Li+,可将其加入到“___________”步骤中。 ⑤Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为__________ (3)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LiCoO2+C6 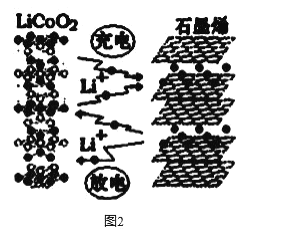 下列关于该电池的说法正确的是___________(填字母)。 A.电池反应式中过程1为放电过程 B.该电池若用隔膜可选用质子交换膜 C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度 D.充电时,LiCoO2 极发生的电极反应为LiCoO2-xe-=xLi++Li1-xCoO2 E.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收 |
|
| 18. 综合题 | 详细信息 |
|
钾、氟及锌的相关化合物用途非常广泛。回答下列问题: (1)基态锌原子的价电子排布式为___________;K、F、Zn的电负性从大到小的顺序为___________。 (2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________。 (3)OF2分子的几何构型为___________,中心原子的杂化类型为___________。 (4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在___________;与O3-互为等电子体的分子为___________ (任 写一种 )。 (5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。 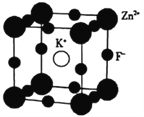 ①晶胞中Zn2+的配位数为___________个。 ②晶胞中紧邻的两个F-间的距离为_______________________(列出算式即可)nm。 ③该晶体的密度为___________(列出算式即可,用NA表示阿伏加德罗常数的数值)g·cm-3。 |
|
最近更新



