2020дә‘еҚ—й«ҳдёҖдёҠеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҜҶеәҰдёә0.910 gВ·cm-3ж°Ёж°ҙпјҢиҙЁйҮҸеҲҶж•°дёә25.0%пјҢиҜҘж°Ёж°ҙз”ЁзӯүдҪ“з§Ҝзҡ„ж°ҙзЁҖйҮҠеҗҺпјҢжүҖеҫ—жә¶ж¶Ізҡ„иҙЁйҮҸеҲҶж•°дёә(В В ) AпјҺзӯүдәҺ12.5%В В В В В В В В В В В BпјҺеӨ§дәҺ12.5%В В В В В В В В В В В CпјҺе°ҸдәҺ12.5%В В В В В В В В В В В DпјҺж— жі•зЎ®е®ҡ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…із”өи§ЈиҙЁзҡ„иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В В В В пјү AпјҺж°ўж°§еҢ–й’ еӣәдҪ“жә¶дәҺж°ҙеҗҺиғҪеҜјз”өпјҢжүҖд»Ҙж°ўж°§еҢ–й’ жҳҜз”өи§ЈиҙЁ BпјҺдәҢж°§еҢ–зўіж°ҙжә¶ж¶ІиғҪеӨҹеҜјз”өпјҢжүҖд»ҘдәҢж°§еҢ–зўіжҳҜз”өи§ЈиҙЁ CпјҺй“ҒгҖҒй“ңиғҪеҜјз”өпјҢжүҖд»Ҙй“ҒгҖҒй“ңдёәз”өи§ЈиҙЁ DпјҺж°ҜеҢ–й“Ғжә¶ж¶ІиғҪеӨҹеҜјз”өпјҢжүҖд»Ҙж°ҜеҢ–й“Ғжә¶ж¶ІжҳҜз”өи§ЈиҙЁ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰжҙ»еҠЁе…ҙи¶Је°Ҹз»„еңЁдёҖж¬Ўе®һйӘҢжҺўз©¶жҙ»еҠЁдёӯпјҢеңЁдёҖдёӘе®һйӘҢжЎҢдёҠж”ҫзқҖеӣӣз§ҚеҢ–еӯҰиҚҜе“ҒпјҢ瓶еЈҒдёҠеҲҶеҲ«еҶҷзқҖзҷҪз Ӯзі–гҖҒе°ҸйәҰйқўзІүгҖҒеҠ зўҳйЈҹзӣҗе’ҢйЈҹз”Ёе‘ізІҫгҖӮдёәдәҶиҝӣдёҖжӯҘзЎ®е®ҡе®ғ们зҡ„е®һзү©е’ҢеҗҚз§°жҳҜеҗҰзӣёз¬ҰиҖҢиҝӣиЎҢеҢ–еӯҰе®һйӘҢпјҢдёӢеҲ—еҒҡжі•дёӯеҝ…йЎ»еҲ¶жӯўзҡ„жҳҜпјҲВ В В В В пјү AпјҺе°ҸиҗҢеҗҢеӯҰйҖҡиҝҮи§ӮеҜҹжҜ”иҫғе®ғ们зҡ„еӨ–и§ӮзҠ¶жҖҒ BпјҺе°Ҹжҷ“еҗҢеӯҰе…Ҳеҗ„еҸ–е°‘йҮҸй…ҚжҲҗдәҶжә¶ж¶І CпјҺе°Ҹи¶…еҗҢеӯҰеҗ„еҸ–е°‘йҮҸеҲҶеҲ«ж”ҫеңЁеҳҙйҮҢе°қдәҶе°қ DпјҺе°ҸеҮӨеҗҢеӯҰз”ЁеҢ–еӯҰж–№жі•иҝӣиЎҢйүҙеҲ«
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ҘдёҡдёҠе°ҶNa2CO3е’ҢNa2Sд»Ҙ1:2зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”й…ҚжҲҗжә¶ж¶ІпјҢеҶҚйҖҡе…ҘSO2пјҢеҸҜеҲ¶еҸ–Na2S2O3пјҢеҗҢж—¶ж”ҫеҮәCO2пјҺдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү AпјҺзЎ«е…ғзҙ ж—ўиў«ж°§еҢ–пјҢеҸҲиў«иҝҳеҺҹ BпјҺж°§еҢ–еүӮдёҺиҝҳеҺҹеүӮзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә2:1 CпјҺзӣёеҗҢжқЎд»¶дёӢпјҢжҜҸеҗёж”¶10m3SO2е°ұдјҡж”ҫеҮә2.5m3CO2 DпјҺиӢҘз”ҹжҲҗ2.24LCO2пјҢеҲҷиҪ¬з§»0.8molз”өеӯҗ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—йҖүйЎ№дёӯзҡ„зү©иҙЁжүҖеҗ«жҢҮе®ҡеҺҹеӯҗж•°зӣ®дёҖе®ҡзӣёзӯүзҡ„жҳҜ(гҖҖгҖҖ) AпјҺжё©еәҰе’ҢеҺӢејәдёҚеҗҢпјҢзӣёеҗҢиҙЁйҮҸзҡ„дёҖж°§еҢ–дәҢж°®е’ҢдәҢж°§еҢ–зўідёӨз§Қж°”дҪ“зҡ„жҖ»еҺҹеӯҗж•° BпјҺзӯүжё©зӯүеҺӢдёӢпјҢзӣёеҗҢдҪ“з§Ҝзҡ„д№ҷзғҜе’Ңд№ҷзӮ”гҖҒд№ҷзғ·зҡ„ж··еҗҲж°”дҪ“зҡ„жҖ»еҺҹеӯҗж•° CпјҺзӯүжё©зӯүеҺӢдёӢпјҢзӣёеҗҢдҪ“з§Ҝзҡ„ж°§ж°”е’ҢиҮӯж°§дёӨз§Қж°”дҪ“дёӯзҡ„ж°§еҺҹеӯҗж•° DпјҺзӣёеҗҢзү©иҙЁзҡ„йҮҸгҖҒдёҚеҗҢдҪ“з§Ҝзҡ„ж°Ёж°”е’Ңз”Ізғ·дёӨз§Қж°”дҪ“дёӯзҡ„ж°ўеҺҹеӯҗж•°
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
жө·ж°ҙжҸҗжәҙиҝҮзЁӢдёӯпјҢе°Ҷжәҙеҗ№е…Ҙеҗёж”¶еЎ”пјҢдҪҝжәҙи’ёж°”е’Ңеҗёж”¶еүӮSO2еҸ‘з”ҹдҪңз”Ёд»ҘиҫҫеҲ°еҜҢйӣҶзҡ„зӣ®зҡ„пјҢеҢ–еӯҰеҸҚеә”дёәBr2+SO2+2H2O=2HBr+H2SO4пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү AпјҺBr2еңЁеҸҚеә”дёӯиЎЁзҺ°ж°§еҢ–жҖ§ BпјҺSO2еңЁеҸҚеә”дёӯиў«иҝҳеҺҹ CпјҺBr2еңЁеҸҚеә”дёӯеӨұеҺ»з”өеӯҗ DпјҺ1mol Br2еңЁеҸҚеә”дёӯеҫ—еҲ°1molз”өеӯҗ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ідәҺз”өи§ЈиҙЁз”өзҰ»зҡ„дёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү AпјҺж—ўдә§з”ҹйҳізҰ»еӯҗеҸҲдә§з”ҹйҳҙзҰ»еӯҗВ В BпјҺдә§з”ҹзҡ„йҳізҰ»еӯҗдёҺйҳҙзҰ»еӯҗзҡ„жҖ»ж•°дёҖе®ҡзӣёзӯү CпјҺдә§з”ҹзҡ„йҳізҰ»еӯҗдёҺйҳҙзҰ»еӯҗзҡ„иҙЁйҮҸдёҖе®ҡзӣёзӯү DпјҺдә§з”ҹзҡ„йҳізҰ»еӯҗдёҺйҳҙзҰ»еӯҗзҡ„жө“еәҰдёҖе®ҡзӣёзӯү
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘжҹҗй…ёжҖ§жә¶ж¶Ідёӯеҗ«жңүBa2+гҖҒFe3+пјҢеҲҷдёӢиҝ°зҰ»еӯҗз»„дёӯиғҪдёҺдёҠиҝ°зҰ»еӯҗе…ұеӯҳзҡ„жҳҜ AпјҺNO3-гҖҒCl-В В В В В В В В В В В В В BпјҺCO32-гҖҒCl-В В В В В В В В В В В В В CпјҺNO3-гҖҒSO42-В В В В В В В В В В DпјҺOH-гҖҒNO3-
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
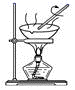
дёӢеӣҫжҳҜе…ідәҺи’ёеҸ‘зҡ„е®һйӘҢзӨәж„ҸеӣҫпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
AпјҺз»„иЈ…е®һйӘҢиЈ…зҪ®ж—¶пјҢеә”е…Ҳеӣәе®ҡеҘҪй“ҒеңҲпјҢж”ҫдёҠи’ёеҸ‘зҡҝпјҢеҶҚж”ҫй…’зІҫзҒҜ BпјҺз»ҷи’ёеҸ‘зҡҝеҶ…жүҖзӣӣж¶ІдҪ“еҠ зғӯж—¶пјҢеҝ…йЎ»еһ«дёҠзҹіжЈүзҪ‘ CпјҺзҺ»з’ғжЈ’зҡ„дҪңз”ЁжҳҜжҗ…жӢҢпјҢйҳІжӯўеӣ еұҖйғЁиҝҮзғӯиҖҢдҪҝеӣәдҪ“иҝёжә… DпјҺи’ёеҸ‘зҡ„иҝҮзЁӢдёӯпјҢз”Ёй…’зІҫзҒҜдёҖзӣҙеҠ зғӯеҲ°е…ЁйғЁеӣәдҪ“жһҗеҮәпјҢжІЎжңүж°ҙеҲҶ
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷ1.12 gй“ҒзІүеҠ е…ҘеҲ°25 mL 2 molВ·LпјҚ1зҡ„ж°ҜеҢ–й“Ғжә¶ж¶ІдёӯпјҢе……еҲҶеҸҚеә”еҗҺпјҢе…¶з»“жһңжҳҜ(гҖҖгҖҖ) AпјҺй“ҒзІүеү©дҪҷпјҢжә¶ж¶Іе‘Ҳжө…з»ҝиүІпјҢClпјҚеҹәжң¬дёҚеҸҳ BпјҺеҗ‘жә¶ж¶Ідёӯж»ҙе…Ҙж— иүІзЎ«ж°°еҢ–й’ҫжә¶ж¶ІпјҢд»Қж— иүІ CпјҺжә¶ж¶ІдёӯFe2пјӢдёҺFe3пјӢзү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә6вҲ¶1 DпјҺж°§еҢ–дә§зү©дёҺиҝҳеҺҹдә§зү©зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә2вҲ¶5
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜ в‘ е°ҶйҮ‘еұһNaжҠ•е…Ҙж°ҙдёӯпјҡ2NaпјӢ2H2Oпјқ2Na+пјӢ2OH-пјӢH2вҶ‘ в‘ЎеңЁзЎ«й…ёжә¶ж¶ІдёӯеҠ е…Ҙж°ўж°§еҢ–й’Ўжә¶ж¶ІиҮідёӯжҖ§пјҡBa2+пјӢOH-пјӢH+пјӢSO42-пјқBaSO4вҶ“пјӢH2O в‘ўзўій…ёж°ўй’ҷжә¶ж¶Ідёӯж»ҙеҠ зӣҗй…ёпјҡHCO3пјҚпјӢH+пјқCO2вҶ‘пјӢH2O в‘Јзўій…ёй’ҷдёӯж»ҙеҠ зӣҗй…ёпјҡCO32-пјҚпјӢ2H+пјқCO2вҶ‘пјӢH2O AпјҺв‘ в‘ўВ В В В В В В В В В В В В В В В В В В В В BпјҺв‘Ўв‘ЈВ В В В В В В В В В В В В В В В В В В В В CпјҺв‘ в‘Ўв‘ўВ В В В В В В В В В В В В В В В В DпјҺв‘ в‘ўв‘Ј
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯпјҢеҸӘжңүж°§еҢ–жҖ§гҖҒеҸӘжңүиҝҳеҺҹжҖ§пјҢж—ўжңүж°§еҢ–жҖ§еҸҲжңүиҝҳеҺҹжҖ§зҡ„йЎәеәҸжҺ’еҲ—зҡ„дёҖз»„жҳҜ AпјҺF2гҖҒKгҖҒHClВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В BпјҺCl2гҖҒAlгҖҒH2 CпјҺNO2гҖҒNaгҖҒBr2В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В DпјҺO2гҖҒSO2гҖҒH2O
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺйҮ‘еұһе…ғзҙ зү№еҫҒзҡ„еҸҷиҝ°пјҢжӯЈзЎ®зҡ„жҳҜ AпјҺйҮ‘еұһе…ғзҙ зҡ„еҺҹеӯҗеҸӘжңүиҝҳеҺҹжҖ§пјҢзҰ»еӯҗеҸӘжңүж°§еҢ–жҖ§ BпјҺйҮ‘еұһе…ғзҙ еңЁеҢ–еҗҲзү©дёӯдёҖе®ҡжҳҫжӯЈд»· CпјҺйҮ‘еұһеҚ•иҙЁйғҪеҸҜд»Ҙе’Ңй…ёеҸҚеә”зҪ®жҚўеҮәж°ўж°” DпјҺйҮ‘еұһе…ғзҙ зҡ„еҚ•иҙЁеңЁеёёжё©дёӢеқҮдёәеӣәдҪ“
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
120в„ғгҖҒ101.3 kPaпјҢз”Ізғ·пјҲCH4пјүе’ҢиҝҮйҮҸзҡ„O2зҡ„ж··еҗҲзү©пјҢз”Ёз”өзҒ«иҠұеј•зҮғпјҲCH4+2O2=CO2+2H2OпјүеҗҺпјҢжҒўеӨҚеҲ°еҺҹжқҘзҡ„жё©еәҰе’ҢеҺӢејәпјҢжөӢеҫ—еҸҚеә”еҗҺж°”дҪ“еҜҶеәҰдёәзӣёеҗҢжқЎд»¶дёӢH2еҜҶеәҰзҡ„15еҖҚпјҢеҲҷеҺҹж··еҗҲж°”дҪ“дёӯз”Ізғ·е’Ңж°§ж°”зҡ„дҪ“з§ҜжҜ”дёәпјҲВ пјү AпјҺ2вҲ¶1В В В В В В В В В В В В В В В В В В В В В BпјҺ1вҲ¶2В В В В В В В В В В В В В В В В В В В В В CпјҺ1вҲ¶7В В В В В В В В В В В В В В В В В В В В В DпјҺ7вҲ¶1
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жә¶ж¶Ідёӯ,Cl-зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёҺ50 mL 1 molВ·L-1AlCl3жә¶ж¶ІдёӯCl-зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰзӣёзӯүзҡ„жҳҜ(гҖҖгҖҖ) AпјҺ150 mL 3 molВ·L-1KClжә¶ж¶І BпјҺ75 mL 2.5 molВ·L-1MgCl2жә¶ж¶І CпјҺ100 mL 1 molВ·L-1NaClжә¶ж¶І DпјҺ25 mL 2 molВ·L-1AlCl3жә¶ж¶І
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҳеҢ–иҝҮзЁӢдёӯпјҢз”»жЁӘзәҝзҡ„е…ғзҙ иў«ж°§еҢ–зҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺCO2вҶ’COВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В BпјҺFeCl3вҶ’FeCl2 CпјҺHClвҶ’AgClВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В DпјҺKIвҶ’I2
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
й“қеҺҹеӯҗдёҺж°Ҝж°”еҸҚеә”ж—¶еӨұеҺ»3дёӘз”өеӯҗпјҢй’ еҺҹеӯҗдёҺж°Ҝж°”еҸҚеә”ж—¶еӨұеҺ»1дёӘз”өеӯҗпјҢз”ұжӯӨеҫ—еҮәзҡ„дёӢеҲ—з»“и®әдёӯдёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү AпјҺй“қзҡ„жҙ»жіјжҖ§жҜ”й’ зҡ„жҙ»жіјжҖ§ејә BпјҺдёҚиғҪиҜҙжҳҺй“қе’Ңй’ жҙ»жіјжҖ§зҡ„ејәејұ CпјҺеңЁз”ҹжҲҗзҡ„ж°ҜеҢ–зү©дёӯй’ е…ғзҙ дёәпјӢ1д»· DпјҺеңЁз”ҹжҲҗзҡ„ж°ҜеҢ–зү©дёӯй“қе…ғзҙ дёәпјӢ3д»·
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗжә¶ж¶Ідёӯеҗ«HпјӢгҖҒSO42пјҚгҖҒNO3-дёүз§ҚзҰ»еӯҗпјҢе…¶дёӯHпјӢгҖҒSO42пјҚзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰеҲҶеҲ«дёә7.0 molВ·LпјҚ1е’Ң2.0 molВ·LпјҚ1гҖӮеҸ–иҜҘжә¶ж¶І20 mLпјҢеҠ е…Ҙ3.2 gй“ңзІүпјҢеҠ зғӯдҪҝе®ғ们充еҲҶеҸҚеә”пјҢдә§з”ҹзҡ„ж°”дҪ“еңЁж ҮеҮҶзҠ¶еҶөдёӢзҡ„дҪ“з§ҜзәҰдёә( ) AпјҺ0.75 LВ В В В В В В В В В В В В В В В В В В BпјҺ0.336 LВ В В В В В В В В В В В В В В В В CпјҺ1.5 LВ В В В В В В В В В В В В В В В В В В В В DпјҺ0.448 L
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
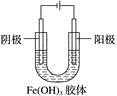
еңЁеҰӮеӣҫжүҖзӨәзҡ„иЈ…зҪ®дёӯпјҢUеһӢз®ЎеҶ…зӣӣжңүж°ўж°§еҢ–й“Ғиғ¶дҪ“пјҢдёӨдёӘз®ЎеҸЈеҗ„жҸ’е…ҘдёҖдёӘзўіжЈ’дҪңдёәз”өжһҒгҖӮйҖҡз”өдёҖж®өж—¶й—ҙеҗҺпјҢдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
AпјҺFe(OH)3иғ¶дҪ“зІ’еӯҗеёҰжӯЈз”өиҚ·пјҢйҳҙжһҒйҷ„иҝ‘зҡ„йўңиүІеҸҳжө… BпјҺFe(OH)3иғ¶дҪ“зІ’еӯҗеёҰиҙҹз”өиҚ·пјҢйҳіжһҒйҷ„иҝ‘зҡ„йўңиүІеҸҳжө… CпјҺFe(OH)3иғ¶дҪ“зІ’еӯҗеҗ‘йҳҙжһҒ移еҠЁпјҢйҳҙжһҒйҷ„иҝ‘зҡ„йўңиүІеҸҳж·ұ DпјҺFe(OH)3иғ¶дҪ“зІ’еӯҗеҗ‘йҳіжһҒ移еҠЁпјҢйҳіжһҒйҷ„иҝ‘зҡ„йўңиүІеҸҳж·ұ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ё98%зҡ„жө“зЎ«й…ёй…ҚеҲ¶2molВ·L-1зҡ„зЁҖзЎ«й…ёпјҢдёӢеҲ—ж“ҚдҪңдҪҝжүҖй…Қжә¶ж¶Іжө“еәҰеҒҸдҪҺзҡ„жҳҜ AпјҺжңӘеҶ·еҚҙе°ұиҪ¬з§»гҖҒе®ҡе®№В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В BпјҺе®№йҮҸ瓶дёӯжңүе°‘йҮҸи’ёйҰҸж°ҙ CпјҺз”ЁйҮҸзӯ’йҮҸеҸ–жө“зЎ«й…ёж—¶пјҢдҝҜи§ҶиҜ»ж•°В В В В В В В В В В В В В В DпјҺе®ҡе®№ж—¶дҝҜи§ҶеҲ»еәҰзәҝи§ӮеҜҹж¶Ійқў
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
ж°°(CN)2гҖҒзЎ«ж°°(SCN)2зӯүз§°дёәжӢҹеҚӨзҙ пјҢе®ғ们дёҺеҚӨзҙ еҚ•иҙЁжҖ§иҙЁзӣёдјјпјҢе®ғ们зҡ„йҳҙзҰ»еӯҗд№ҹдёҺеҚӨзҙ йҳҙзҰ»еӯҗжҖ§иҙЁзӣёдјјгҖӮдҫӢеҰӮпјҡ2FeпјӢ3(SCN)2==2Fe(SCN)3гҖҒAgпјӢпјӢCNпјҚ== AgCNвҶ“(зҷҪ)гҖӮжӢҹеҚӨзҙ еҪўжҲҗзҡ„ж— ж°§й…ёе’Ңеҗ«ж°§й…ёдёҖиҲ¬жҜ”ж°ўеҚӨй…ёе’Ңж¬ЎеҚӨй…ёејұпјҢйҳҙзҰ»еӯҗзҡ„иҝҳеҺҹжҖ§дёҖиҲ¬жҜ”BrпјҚејәгҖӮдёӢеҲ—еҸҚеә”дёӯпјҢдёҚжӯЈзЎ®зҡ„жҳҜпјҲ В В В В В пјү AпјҺ2CNпјҚпјӢCl2= 2ClпјҚпјӢ(CN)2 BпјҺ(CN)2пјӢ2OHпјҚ=CNпјҚпјӢCNOпјҚпјӢH2O CпјҺ(SCN)2пјӢH2O = 2HпјӢпјӢSCNпјҚпјӢSCNOпјҚ DпјҺMnO2пјӢ4HSCNпјҲжө“пјү
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗжә¶ж¶ІдёӯеҠ е…Ҙй“қзІүпјҢжңүH2ж”ҫеҮәпјҢеңЁиҜҘжә¶ж¶ІдёӯдёҖе®ҡиғҪеӨ§йҮҸе…ұеӯҳзҡ„зҰ»еӯҗз»„жҳҜ AпјҺK+гҖҒMg2+гҖҒCl-гҖҒSO42-В В В В В В В В В В В В В В В В В В В В В В В В В В В В В BпјҺNa+гҖҒNH4+гҖҒSO42-гҖҒHCO3- CпјҺNa+гҖҒK+гҖҒSO42-гҖҒCl-В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В DпјҺK+гҖҒNa+гҖҒNO3-гҖҒCO32-
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёӢеҲ—зү©иҙЁзұ»еҲ«дёӯпјҢеүҚиҖ…еҢ…еҗ«еҗҺиҖ…зҡ„жҳҜ AпјҺж··еҗҲзү©В жә¶ж¶ІВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В BпјҺз”өи§ЈиҙЁВ еҢ–еҗҲзү© CпјҺжөҠж¶ІВ В В иғ¶дҪ“В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В DпјҺеҚ•иҙЁВ В В еҢ–еҗҲзү©
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁд№…зҪ®дәҺз©әж°”дёӯдјҡеҸ‘з”ҹзӣёеә”зҡ„еҸҳеҢ–пјҢе…¶дёӯеҸ‘з”ҹдәҶж°§еҢ–иҝҳеҺҹеҸҚеә”зҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺжө“зЎ«й…ёзҡ„дҪ“з§ҜеўһеӨ§В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В BпјҺй“қзҡ„иЎЁйқўз”ҹжҲҗиҮҙеҜҶзҡ„и–„иҶң CпјҺжҫ„жё…зҡ„зҹізҒ°ж°ҙеҸҳжө‘жөҠВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В DпјҺж°ўж°§еҢ–й’ зҡ„иЎЁйқўеҸ‘з”ҹжҪ®и§Ј
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸзҡ„д№ҰеҶҷжӯЈзЎ®зҡ„жҳҜпјҲВ В В В В пјү AпјҺз”ЁFeCl3жә¶ж¶Іи…җиҡҖеҚ°еҲ·з”өи·ҜжқҝпјҡFe3++Cu=Fe2++Cu2+ BпјҺж°Ҝж°”йҖҡе…ҘNaOHжә¶ж¶Ідёӯпјҡ2OH-+Cl2=Cl-+ClO-+H2O CпјҺй“Ғе’ҢзЁҖзЎ«й…ёеҸҚеә”пјҡ2Fe+6H+=2Fe3++3H2вҶ‘ DпјҺAlC13жә¶ж¶ІдёӯеҠ е…Ҙи¶ійҮҸзҡ„ж°Ёж°ҙпјҡAl3++3OH-=AlпјҲOHпјү3вҶ“
|
|
| 26. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёӢеҲ—ж“ҚдҪңдёӯпјҢдёҖиҲ¬жғ…еҶөдёӢдёҚиғҪзӣёдә’жҺҘи§Ұзҡ„жҳҜ(гҖҖгҖҖ) AпјҺиҝҮж»Өж—¶пјҢзҺ»з’ғжЈ’дёҺдёүеұӮж»Өзәё BпјҺз”ЁйҮҸзӯ’д»ҺйЈҹзӣҗжә¶ж¶ІдёӯйҮҸеҮә4.3 mLжә¶ж¶І CпјҺиҝҮж»Өж—¶пјҢзғ§жқҜеҶ…еЈҒдёҺжјҸж–—дёӢз«Ҝ DпјҺз”Ёиғ¶еӨҙж»ҙз®Ўеҗ‘иҜ•з®ЎеҶ…ж»ҙеҠ ж¶ІдҪ“ж—¶пјҢиғ¶еӨҙж»ҙз®Ўе°–з«ҜдёҺиҜ•з®ЎеҶ…еЈҒ
|
|
| 27. | иҜҰз»ҶдҝЎжҒҜ |
|
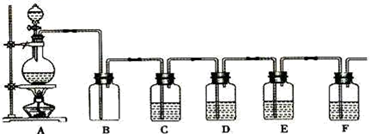
еҰӮеӣҫжҳҜдёӯеӯҰеҢ–еӯҰе®һйӘҢдёӯеёёи§Ғзҡ„еҲ¶еӨҮж°”дҪ“并иҝӣиЎҢжҹҗдәӣзү©иҙЁзҡ„жЈҖйӘҢе’ҢжҖ§иҙЁе®һйӘҢзҡ„иЈ…зҪ®пјҢAжҳҜеҲ¶еӨҮж°”дҪ“зҡ„иЈ…зҪ®пјҢCгҖҒDгҖҒEгҖҒFдёӯзӣӣиЈ…зҡ„ж¶ІдҪ“еҸҜиғҪзӣёеҗҢпјҢд№ҹеҸҜиғҪдёҚеҗҢгҖӮиҜ•еӣһзӯ”пјҡ
пјҲ1пјүеҰӮжһңAдёӯзҡ„еӣәдҪ“зү©иҙЁжҳҜзўіпјҢеҲҶж¶ІжјҸж–—дёӯзӣӣиЈ…зҡ„жҳҜжө“зЎ«й…ёпјҢиҜ•еҶҷеҮәеҸ‘з”ҹзҡ„еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸпјҡ____пјҢиӢҘиҰҒжЈҖйӘҢз”ҹжҲҗзҡ„дә§зү©пјҢеҲҷBгҖҒCгҖҒDгҖҒEгҖҒFдёӯеә”еҲҶеҲ«еҠ е…Ҙзҡ„иҜ•еүӮдёә__гҖҒ__гҖҒ__гҖҒ__гҖҒ__пјҢEдёӯиҜ•еүӮе’ҢCдёӯзӣёеҗҢпјҢEдёӯиҜ•еүӮжүҖиө·зҡ„дҪңз”Ё__пјҢBиЈ…зҪ®йҷӨеҸҜжЈҖеҮәжҹҗдә§зү©еӨ–пјҢиҝҳеҸҜиө·еҲ°__дҪңз”ЁгҖӮ пјҲ2пјүиӢҘиҝӣиЎҢдёҠиҝ°е®һйӘҢж—¶еңЁFдёӯеҫ—еҲ°10.0 gеӣәдҪ“пјҢеҲҷAдёӯеҸ‘з”ҹеҸҚеә”иҪ¬з§»зҡ„з”өеӯҗж•°дёә__дёӘгҖӮ
|
|
| 28. | иҜҰз»ҶдҝЎжҒҜ |
|
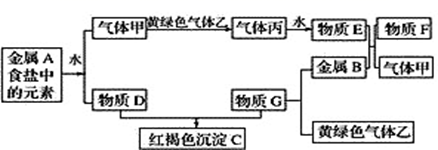
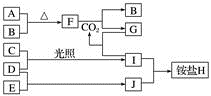
зҺ°жңүйҮ‘еұһеҚ•иҙЁAгҖҒBе’Ңж°”дҪ“з”ІгҖҒд№ҷгҖҒдёҷеҸҠзү©иҙЁCгҖҒDгҖҒEгҖҒFгҖҒGпјҢе®ғ们д№Ӣй—ҙиғҪеҸ‘з”ҹеҰӮеӣҫеҸҚеә”пјҲеӣҫдёӯжңүдәӣеҸҚеә”зҡ„дә§зү©е’ҢеҸҚеә”зҡ„жқЎд»¶жІЎжңүе…ЁйғЁж ҮеҮәпјүгҖӮ
иҜ·ж №жҚ®д»ҘдёҠдҝЎжҒҜеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)еҶҷеҮәдёӢеҲ—зү©иҙЁзҡ„еҢ–еӯҰејҸпјҡд№ҷ_________пјҢF__________гҖӮ (2)еҶҷеҮәдёӢеҲ—еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡ в‘ йҮ‘еұһAе’Ңж°ҙеҸҚеә”_______________гҖӮв‘ЎзәўиӨҗиүІжІүж·ҖCдёҺзү©иҙЁEеҸҚеә”__________гҖӮ в‘ўFдёҺй»„з»ҝиүІж°”дҪ“д№ҷеҸҚеә”____________гҖӮ в‘Је®һйӘҢе®Өеёёз”Ёж°ўж°§еҢ–й’ еҗёж”¶е®һйӘҢиҝҮзЁӢдёӯзҡ„й»„з»ҝиүІж°”дҪ“д№ҷпјҢеҶҷеҮәз”Ёж°ўж°§еҢ–й’ жә¶ж¶Іеҗёж”¶иҜҘж°”дҪ“зҡ„зҰ»еӯҗж–№зЁӢејҸ___гҖӮ (3)е°ҶGжә¶ж¶ІйҖҗж»ҙеҠ е…ҘеҲ°жІёж°ҙдёӯдјҡдә§з”ҹдёҖз§ҚзәўиӨҗиүІзҡ„ж¶ІдҪ“гҖӮдҪ и®ӨдёәиҜҘж¶ІдҪ“дёӯзҡ„еҲҶж•ЈиҙЁзІ’еӯҗзӣҙеҫ„еңЁ______д№Ӣй—ҙпјҢйӘҢиҜҒзҡ„з®ҖеҚ•ж–№жі•жҳҜпјҡ_____________гҖӮ
|
|
| 29. | иҜҰз»ҶдҝЎжҒҜ |
|
еҰӮеӣҫжҳҜйғЁеҲҶзҹӯе‘Ёжңҹе…ғзҙ зҡ„еҚ•иҙЁеҸҠе…¶еҢ–еҗҲзү©(жҲ–е…¶жә¶ж¶І)зҡ„иҪ¬еҢ–е…ізі»гҖӮе·ІзҹҘеңЁеёёжё©еёёеҺӢдёӢпјҢAжҳҜеӣәдҪ“пјҢBгҖҒCгҖҒDгҖҒEжҳҜйқһйҮ‘еұһеҚ•иҙЁдё”йғҪжҳҜж°”дҪ“пјҢCе‘Ҳй»„з»ҝиүІпјӣеҢ–еҗҲзү©FжҳҜж·Ўй»„иүІеӣәдҪ“пјҢеҢ–еҗҲзү©Gзҡ„з„°иүІеҸҚеә”дёәй»„иүІпјҢеҢ–еҗҲзү©в… е’ҢJйҖҡеёёзҠ¶еҶөдёӢе‘Ҳж°”жҖҒпјӣDе’ҢEеҸҚеә”з”ҹжҲҗдёҖз§ҚеҲәжҝҖжҖ§ж°”е‘ізҡ„ж°”дҪ“гҖӮ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)Eе’ҢJзҡ„еҢ–еӯҰејҸеҲҶеҲ«жҳҜ________е’Ң________гҖӮ (2)еҶҷеҮәFе’ҢCO2еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ并用еҚ•зәҝжЎҘжі•иЎЁзӨәз”өеӯҗиҪ¬з§»зҡ„жғ…еҶөпјҡ_________гҖӮ (3)е°Ҷе°‘йҮҸеҚ•иҙЁCйҖҡе…Ҙзӣӣжңүж·ҖзІүзўҳеҢ–й’ҫжә¶ж¶Ізҡ„иҜ•з®ЎдёӯпјҢжә¶ж¶ІеҸҳи“қиүІпјҢиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә_________гҖӮ (4)ж ҮеҶөдёӢ3.36 Lж°”дҪ“BдёҺAе®Ңе…ЁеҸҚеә”пјҢиҪ¬з§»з”өеӯҗзҡ„ж•°зӣ®дёә________гҖӮ
|
|
| 30. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ІгҖҒд№ҷгҖҒдёҷгҖҒдёҒеӣӣз§Қзҹӯе‘Ёжңҹе…ғзҙ зҡ„дҪҚзҪ®еҰӮеӣҫжүҖзӨә(е…¶дёӯд№ҷгҖҒдёҷгҖҒдёҒзҡ„дҪҚзҪ®жңӘж ҮеҮә)гҖӮ
е·ІзҹҘеӣӣз§Қе…ғзҙ зҡ„еҺҹеӯҗеәҸж•°д№Ӣе’Ңдёә36пјҢд№ҷзҡ„еҺҹеӯҗеәҸж•°дёҺз”ІгҖҒдёҒеҺҹеӯҗеәҸж•°д№Ӣе’ҢзӣёзӯүгҖӮ (1)з”Іе…ғзҙ еңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®дёә______________гҖӮ (2)дёҷгҖҒдёҒеҸҜеҪўжҲҗAB2еһӢеҢ–еҗҲзү©пјҢе…¶еҢ–еӯҰејҸдёә________гҖӮ (3)дёҷжҳҜиҮӘ然з•ҢдёӯеҪўжҲҗеҢ–еҗҲзү©з§Қзұ»жңҖеӨҡзҡ„е…ғзҙ пјҢеҲҷдёҷжҳҜ________(еЎ«еҗҚз§°)пјҢе…¶еҚ•иҙЁдёҺз”Іе…ғзҙ зҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©зҡ„жө“жә¶ж¶Іе…ұзғӯж—¶еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜ______________________гҖӮ (4)иӢҘз”ІгҖҒд№ҷгҖҒдёҷгҖҒдёҒеӣӣз§Қе…ғзҙ дёӨдёӨеҢ–еҗҲж—¶пјҢдёҒдёҺе…¶д»–дёүз§Қе…ғзҙ еҫ—еҲ°зҡ„еҢ–еҗҲзү©з§Қзұ»жңҖеӨҡпјҢеҲҷдёҒжҳҜ________(еЎ«е…ғзҙ з¬ҰеҸ·)пјҢеҶҷеҮәиҝҷдәӣеҢ–еҗҲзү©дёӯд»»ж„ҸдёӨз§Қз¬ҰеҗҲд»ҘдёӢжқЎд»¶зҡ„еҢ–еӯҰејҸ______________________пјҲв‘ еҺҹеӯҗдёӘж•°жҜ”дёә1вҲ¶2пјӣв‘ЎеҲҶеӯҗдёӯд»·з”өеӯҗжҖ»ж•°дёәеҒ¶ж•°пјүгҖӮ
|
|
| 31. | иҜҰз»ҶдҝЎжҒҜ |
|
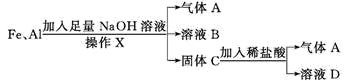
й“Ғе’Ңй“қжҳҜ科жҠҖгҖҒз”ҹдә§гҖҒз”ҹжҙ»дёӯеә”з”ЁжңҖе№ҝжіӣзҡ„йҮ‘еұһжқҗж–ҷгҖӮ
зҺ°жңүй“ҒгҖҒй“қзҡ„ж··еҗҲзү©иҝӣиЎҢеҰӮдёӢе®һйӘҢпјҡ
(1)ж“ҚдҪңXзҡ„еҗҚз§°жҳҜ_____гҖӮ (2)ж°”дҪ“AжҳҜ_____гҖӮ (3)AдёҺCl2ж··еҗҲе…үз…§еҸҜиғҪеҸ‘з”ҹзҲҶзӮёпјҢз”ҹжҲҗ_____(еЎ«еҢ–еӯҰејҸ)пјҢAеңЁиҜҘеҸҚеә”дёӯдҪңдёә_____(еЎ«вҖңж°§еҢ–еүӮвҖқжҲ–вҖңиҝҳеҺҹеүӮвҖқ)гҖӮ (4)жә¶ж¶ІBдёӯйҳҙзҰ»еӯҗйҷӨOH-еӨ–иҝҳжңү_____пјҢжә¶ж¶ІDдёӯеӯҳеңЁзҡ„йҮ‘еұһзҰ»еӯҗдёә_____гҖӮ
|
|
| 32. | иҜҰз»ҶдҝЎжҒҜ |
|
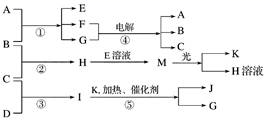
е·ІзҹҘз”ұзҹӯе‘Ёжңҹе…ғзҙ жһ„жҲҗзҡ„дёүз§ҚзІ’еӯҗпјҡз”Іa(еҚ•ж ёеёҰдёҖдёӘеҚ•дҪҚжӯЈз”өиҚ·)гҖҒд№ҷI(еӣӣж ёдёҚеёҰз”өиҚ·)гҖҒдёҷe(еҸҢж ёеёҰдёҖдёӘеҚ•дҪҚиҙҹз”өиҚ·)пјҢе®ғ们йғҪжңү10дёӘз”өеӯҗгҖӮзү©иҙЁAз”ұз”ІгҖҒдёҷжһ„жҲҗпјҢBгҖҒCгҖҒDгҖҒKйғҪжҳҜеҚ•иҙЁпјҢеҸҚеә”в‘ пҪһв‘ӨйғҪжҳҜз”ЁдәҺе·Ҙдёҡз”ҹдә§зҡ„еҸҚеә”пјҢеҗ„жңүе…ізү©иҙЁд№Ӣй—ҙзҡ„зӣёдә’еҸҚеә”иҪ¬еҢ–е…ізі»еҰӮдёӢеӣҫжүҖзӨәпјҡ
иҜ·еЎ«еҶҷдёӢеҲ—з©әзҷҪпјҡ (1)еҶҷеҮәдёӢеҲ—зү©иҙЁзҡ„еҢ–еӯҰејҸпјҡB________пјҢI________пјҢJ________гҖӮ (2) Aзҡ„еҢ–еӯҰејҸжҳҜ__________________гҖӮ (3)еҶҷеҮәдёӢеҲ—еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡ в‘ HпјӢE(жә¶ж¶І)вҶ’M_________________________________________________________гҖӮ в‘ЎIжә¶дәҺG________________________________________________________________гҖӮ (4)еҶҷеҮәеҸҚеә”в‘ зҡ„еҢ–еӯҰж–№зЁӢејҸ_________________________________________________гҖӮ
|
|
- й«ҳдёӯеҢ–еӯҰ2020е№ҙе№ҙжң«е‘Ёз»ғзҹҘиҜҶзӮ№вҖ”вҖ”з”өи§ЈеҺҹзҗҶи®ӯз»ғйўҳпјҲ1пјүгҖҗеҗ«иҜҰи§ЈгҖ‘
- 2018й«ҳдәҢдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹдёӯиҖғиҜ•
- 2016жұҹиӢҸй«ҳдёүдёӢеӯҰжңҹиӢҸж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
- зҰҸе»әзңҒ2021-2022еӯҰе№ҙй«ҳдёҖдёҠеӯҰжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰиҜ•йўҳеҗ«и§Јжһҗ
- 2020йҷ•иҘҝй«ҳдәҢдёӢеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
- 2017жұҹиҘҝй«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
- 2019зҰҸе»әй«ҳдәҢдёӢеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
- 2017еҢ—дә¬й«ҳдәҢдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹдёӯиҖғиҜ•