2017еӣӣе·қй«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еј•иө·зҺҜеўғжұЎжҹ“зҡ„еҺҹеӣ дёҚжӯЈзЎ®зҡ„жҳҜ A. йҮҚйҮ‘еұһгҖҒеҶңиҚҜе’ҢйҡҫеҲҶи§Јжңүжңәзү©гҖҒеҗ«NгҖҒPзҡ„жұЎж°ҙзӯүдјҡйҖ жҲҗж°ҙдҪ“жұЎжҹ“ B. иЈ…йҘ°жқҗж–ҷдёӯзҡ„з”ІйҶӣгҖҒиҠійҰҷзғғеҸҠж°ЎзӯүдјҡйҖ жҲҗеұ…е®ӨжұЎжҹ“ C. SO2гҖҒNO2е’ҢCO2йғҪдјҡеҜјиҮҙй…ёйӣЁзҡ„еҪўжҲҗ D. CO2зҡ„еӨ§йҮҸжҺ’ж”ҫдјҡйҖ жҲҗжё©е®Өж•Ҳеә”зҡ„еҠ еү§
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
В дёӢеҲ—и®ҫеӨҮе·ҘдҪңж—¶пјҢе°ҶеҢ–еӯҰиғҪиҪ¬еҢ–дёәз”өиғҪзҡ„жҳҜ
A. AВ В В B. BВ В В C. CВ В В D. D
|
|||||||||||||
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еҗҲзү©дёӯпјҢж—ўеҗ«жңүзҰ»еӯҗй”®еҸҲеҗ«жңүе…ұд»·й”®зҡ„жҳҜ A. CH3COOHВ В В B. CH3COONH4В В В C. SiO2В В В D. MgCl2
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A. NгҖҒOгҖҒFжңҖй«ҳжӯЈд»·дҫқж¬ЎеҚҮй«ҳ B. й”ӮгҖҒй’ гҖҒй’ҫгҖҒй“·еҚ•иҙЁдёҺж°ҙеҸҚеә”зҪ®жҚўеҮәж°ўж°”и¶ҠжқҘи¶Ҡйҡҫ C. F2гҖҒCl2гҖҒBr2гҖҒI2еҚ•иҙЁзҡ„зҶ”зӮ№йҖҗжёҗйҷҚдҪҺ D. Al3пјӢгҖҒNaпјӢгҖҒO2пјҚеҫ®зІ’еҚҠеҫ„дҫқж¬ЎеўһеӨ§
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—е…ідәҺжө“зЎ«й…ёзҡ„еҸҷиҝ°пјҢжӯЈзЎ®зҡ„жҳҜ A. е…·жңүеҗёж°ҙжҖ§пјҢеӣ иҖҢиғҪдҪҝи”—зі–зӮӯеҢ– B. еңЁеёёжё©дёӢеҸҜиҝ…йҖҹдёҺй“ңзүҮеҸҚеә”ж”ҫеҮәSO2ж°”дҪ“ C. жҳҜдёҖз§Қе№ІзҮҘеүӮпјҢиғҪеӨҹе№ІзҮҘNH3гҖҒH2зӯүж°”дҪ“ D. еңЁеёёжё©дёӢиғҪеӨҹдҪҝй“ҒгҖҒй“қзӯүйҮ‘еұһй’қеҢ–
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
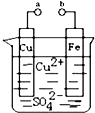
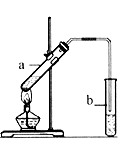
В жҹҗе°Ҹз»„дёәз ”з©¶з”өеҢ–еӯҰеҺҹзҗҶпјҢи®ҫи®ЎеҰӮеӣҫиЈ…зҪ®пјҺдёӢеҲ—еҸҷиҝ°дёҚжӯЈзЎ®зҡ„жҳҜ
A. aе’ҢbдёҚиҝһжҺҘж—¶пјҢй“ҒзүҮдёҠдјҡжңүйҮ‘еұһй“ңжһҗеҮә B. aе’Ңbз”ЁеҜјзәҝиҝһжҺҘж—¶пјҢй“ҒзүҮдёҠеҸ‘з”ҹзҡ„еҸҚеә”дёәпјҡFeпјҚ2eпјҚ=Fe2пјӢ C. aе’Ңbз”ЁеҜјзәҝиҝһжҺҘж—¶з”өеӯҗд»ҺCuзүҮжөҒеҗ‘й“ҒзүҮ D. aе’Ңbз”ЁеҜјзәҝиҝһжҺҘж—¶пјҢCu2пјӢеҗ‘й“ңз”өжһҒ移еҠЁ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ A. ж·ҖзІүдёҺзәӨз»ҙзҙ дёҚеұһдәҺеҗҢеҲҶејӮжһ„дҪ“пјҢд№ҹдёҚеұһдәҺеҗҢзі»зү© B. C. з…Өзҡ„ж°”еҢ–гҖҒж¶ІеҢ–йғҪеұһдәҺеҢ–еӯҰеҸҳеҢ–пјҢзҹіжІ№еҲҶйҰҸеұһдәҺзү©зҗҶеҸҳеҢ– D. зғҜзғғгҖҒйҶҮгҖҒи‘Ўиҗ„зі–йғҪеҸҜд»ҘдҪҝй…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶ІиӨӘиүІ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еӯҰеҸҚеә”еңЁйҮ‘еұһеҶ¶зӮје·ҘдёҡдёӯиҝҳжІЎжңүеҫ—еҲ°еә”з”Ёзҡ„жҳҜ A. 2NaCl(зҶ”иһҚ) C. Fe2O3+3CO
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸдјҪеҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A. 15g -CH3еҗ«жңүзҡ„з”өеӯҗж•°зӣ®дёә7 NA B. 1 mol Feзҡ„зІүжң«дёҺи¶ійҮҸжө“зЎ«й…ёеҠ зғӯеҸҚеә”пјҢиҪ¬з§»з”өеӯҗзҡ„ж•°зӣ®дёә2 NA C. е®Өжё©пјҢ28 gз”ұC3H6е’ҢC4H8з»„жҲҗзҡ„ж··еҗҲзү©дёӯеҗ«жңүж°ўеҺҹеӯҗзҡ„ж•°зӣ®дёә4 NA D. ж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4 L 1пјҢ2-дәҢжәҙд№ҷзғ·зҡ„еҲҶеӯҗж•°зәҰдёәNA
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸдёӯжӯЈзЎ®зҡ„жҳҜ A. е°‘йҮҸSO2йҖҡе…ҘNaOHжә¶ж¶ІдёӯпјҡOHпјҚ+SO2=HSO3пјҚ B. H2SйҖҡе…Ҙж°Ҝж°ҙдёӯпјҡS2пјҚ+Cl2=SвҶ“+2ClпјҚ C. дәҢж°§еҢ–ж°®жә¶дәҺж°ҙпјҡ3NO2+H2O=2HпјӢ+2NO3пјҚ+NO D. е°‘йҮҸNaHSO4дёҺиҝҮйҮҸBa(OH)2жә¶ж¶ІеҸҚеә”пјҡ2HпјӢ+SO42пјҚ+Ba2пјӢ+2OHпјҚ=BaSO4вҶ“+2H2O
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ в‘ зҰ»еӯҗеҢ–еҗҲзү©еҗ«зҰ»еӯҗй”®пјҢд№ҹеҸҜиғҪеҗ«жһҒжҖ§й”®жҲ–йқһжһҒжҖ§й”® в‘ЎHClOй…ёжҖ§пјңH2CO3й…ёжҖ§пјҢж•…йқһйҮ‘еұһжҖ§ClпјңC в‘ўеҗ«йҮ‘еұһе…ғзҙ зҡ„еҢ–еҗҲзү©дёҚдёҖе®ҡжҳҜзҰ»еӯҗеҢ–еҗҲзү© в‘Јз”ұйқһйҮ‘еұһе…ғзҙ з»„жҲҗзҡ„еҢ–еҗҲзү©дёҖе®ҡжҳҜе…ұд»·еҢ–еҗҲзү© в‘ӨзҶ”иһҚзҠ¶жҖҒиғҪеҜјз”өзҡ„еҢ–еҗҲзү©жҳҜзҰ»еӯҗеҢ–еҗҲзү© в‘Ҙз”ұеҲҶеӯҗз»„жҲҗзҡ„зү©иҙЁдёӯдёҖе®ҡеӯҳеңЁе…ұд»·й”® A. в‘ в‘ўв‘ӨВ В В B. в‘Ўв‘Јв‘Ҙ C. в‘ в‘Ўв‘ўв‘ӨВ В В D. в‘ в‘ўв‘Өв‘Ҙ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іеҗҢеҲҶејӮжһ„дҪ“ж•°зӣ®зҡ„еҸҷиҝ°дёӯпјҢжӯЈзЎ®зҡ„жҳҜ A. C2H6OеҸӘжңүдёҖз§Қз»“жһ„ B. еҲҶеӯҗејҸз¬ҰеҗҲC5H11Cl зҡ„еҢ–еҗҲзү©жңү6з§Қ C. е·ІзҹҘдәҢж°ҜиӢҜжңү3з§ҚеҗҢеҲҶејӮжһ„дҪ“пјҢеҲҷеӣӣж°ҜиӢҜзҡ„еҗҢеҲҶејӮжһ„дҪ“зҡ„ж•°зӣ®дёә3з§Қ D. иҸІзҡ„з»“жһ„з®ҖејҸдёә
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
В еңЁе®һйӘҢе®ӨдёӯпјҢдёӢеҲ—йҷӨеҺ»жқӮиҙЁзҡ„ж–№жі•жӯЈзЎ®зҡ„жҳҜ A. иӢҜдёӯж··жңүжәҙпјҢеҠ е…ҘKI жә¶ж¶ІпјҢжҢҜиҚЎпјҢз”Ё CCl4 иҗғеҸ–еҮәжәҙ B. д№ҷзғ·дёӯж··жңүд№ҷзғҜпјҢйҖҡиҝҮж°ўж°”еңЁдёҖе®ҡжқЎд»¶дёӢеҸҚеә”пјҢдҪҝд№ҷзғҜиҪ¬еҢ–дёәд№ҷзғ· C. зЎқеҹәиӢҜдёӯж··жңүжө“ HNO3 е’Ңжө“ H2SO4пјҢе°Ҷе…¶еҖ’е…ҘеҲ° NaOH жә¶ж¶ІдёӯпјҢжҢҜиҚЎгҖҒйқҷзҪ®пјҢеҲҶж¶І D. д№ҷзғҜдёӯж··жңү SO2пјҢе°Ҷе…¶йҖҡе…Ҙй…ёжҖ§ KMnO4 жә¶ж¶Ідёӯжҙ—ж°”
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
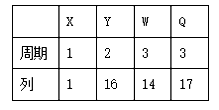
В XгҖҒYгҖҒWгҖҒQ еӣӣз§Қе…ғзҙ еңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®еҰӮдёӢпјҢдёӢеҲ—еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜ
A. Y зҡ„ж°ўеҢ–зү©жІёзӮ№й«ҳдәҺ Q зҡ„ж°ўеҢ–зү©жІёзӮ№ B. жңҖй«ҳжӯЈд»·дёҺжңҖдҪҺиҙҹд»·д№Ӣе’Ңдёә 0 зҡ„е…ғзҙ еҸӘжңү W C. еҺҹеӯҗеҚҠеҫ„йЎәеәҸдёәпјҡr(W)пјһr(Q)пјһr(X) D. XгҖҒYгҖҒQ дёүе…ғзҙ еҪўжҲҗзҡ„еҲҶеӯҗдёӯпјҢеҺҹеӯҗжңҖеӨ–еұӮз”өеӯҗж•°д№Ӣе’ҢжңҖеӨ§дёә 32
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
RгҖҒWгҖҒXгҖҒYгҖҒZдёәеҺҹеӯҗеәҸж•°дҫқж¬ЎйҖ’еўһзҡ„еҗҢдёҖзҹӯе‘Ёжңҹе…ғзҙ пјҢдёӢеҲ—дёҖе®ҡжӯЈзЎ®зҡ„жҳҜ(mгҖҒnеқҮдёәжӯЈж•ҙж•°) A. иӢҘR(OH)nдёәејәзўұпјҢеҲҷW(OH)n+1д№ҹдёәејәзўұ B. иӢҘHnXOmдёәејәй…ёпјҢеҲҷYжҳҜжҙ»жіјзҡ„йқһйҮ‘еұһе…ғзҙ C. иӢҘYзҡ„жңҖдҪҺеҢ–еҗҲд»·дёәпјҚ2пјҢеҲҷZзҡ„жңҖй«ҳжӯЈеҢ–еҗҲд»·дёә+7 D. иӢҘXзҡ„жңҖй«ҳжӯЈеҢ–еҗҲд»·дёә+5пјҢеҲҷдә”з§Қе…ғзҙ йғҪжҳҜйқһйҮ‘еұһе…ғзҙ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
жҒ’жё©жҒ’е®№, 4A(s)+3B(g) A. з”ЁAиЎЁзӨәзҡ„еҸҚеә”йҖҹзҺҮжҳҜ0.4molВ·LпјҚ1В·minпјҚ1 B. еҲҶеҲ«з”ЁBгҖҒCиЎЁзӨәеҸҚеә”зҡ„йҖҹзҺҮпјҢе…¶е…ізі»жҳҜпјҡ3П…(B)=2П…(C) C. 2minжң«зҡ„еҸҚеә”йҖҹзҺҮП…(B)=0.3molВ·LпјҚ1В·minпјҚ1 D. ж°”дҪ“зҡ„еҜҶеәҰдёҚеҶҚеҸҳеҢ–пјҢеҲҷиҜҒжҳҺеҸҚеә”е·Із»ҸиҫҫеҲ°е№іиЎЎзҠ¶жҖҒ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
a mLдёүз§Қж°”жҖҒзғғжҢүд»»ж„ҸжҜ”дҫӢж··еҗҲеҗҺдёҺи¶ійҮҸзҡ„ж°§ж°”ж··еҗҲзӮ№зҮғеҗҺпјҢжҒўеӨҚеҲ°еҺҹжқҘзҡ„зҠ¶жҖҒ(еёёжё©гҖҒеёёеҺӢ)пјҢдҪ“з§ҜжҖ»жҳҜзј©е°Ҹ2a mLгҖӮеҲҷдёүз§ҚзғғеҸҜиғҪжҳҜ A. CH4гҖҒC2H4гҖҒC3H4В В В B. C2H4гҖҒC3H6гҖҒC4H6 C. CH4гҖҒC2H6гҖҒC3H8В В В D. C2H4гҖҒC2H2гҖҒCH4
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||||||
|
В е®һйӘҢе®Өдёӯжҹҗдәӣж°”дҪ“зҡ„еҲ¶еҸ–гҖҒ收йӣҶеҸҠе°ҫж°”еӨ„зҗҶиЈ…зҪ®еҰӮеӣҫжүҖзӨә(зңҒз•ҘеӨ№жҢҒе’ҢеҮҖеҢ–иЈ…зҪ®)гҖӮд»…з”ЁжӯӨиЈ…зҪ®е’ҢиЎЁдёӯжҸҗдҫӣзҡ„зү©иҙЁе®ҢжҲҗзӣёе…іе®һйӘҢпјҢжңҖеҗҲзҗҶзҡ„йҖүйЎ№жҳҜ
A. A.В В В B. BВ В В C. CВ В В D. D
|
||||||||||||||||||||||||||
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
В е°ҶSO2йҖҡе…ҘBaCl2жә¶ж¶ІиҮійҘұе’ҢпјҢжңӘи§ҒжІүж·ҖпјҢ继з»ӯйҖҡе…ҘдёҖж°”дҪ“Xд»Қж— жІүж·ҖпјҢеҲҷXеҸҜиғҪжҳҜ A. Cl2В В В B. NH3В В В C. NO2В В В D. CO2
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||
|
AгҖҒBгҖҒCгҖҒDгҖҒEгҖҒ FгҖҒGжҳҜе‘ЁжңҹиЎЁдёӯзҹӯе‘Ёжңҹзҡ„дёғз§Қе…ғзҙ пјҢжңүе…іжҖ§иҙЁжҲ–з»“жһ„дҝЎжҒҜеҰӮдёӢиЎЁпјҡ
(1) Bе…ғзҙ з¬ҰеҸ·дёә____пјҢAдёҺCд»ҘеҺҹеӯҗдёӘж•°жҜ”дёә1пјҡ1еҪўжҲҗзҡ„еҢ–еҗҲзү©зҡ„з”өеӯҗејҸдёә___пјҢз”Ёз”өеӯҗејҸиЎЁзӨәCдёҺEеҪўжҲҗеҢ–еҗҲзү©зҡ„иҝҮзЁӢ____пјҢ DеҪўжҲҗзҡ„з®ҖеҚ•зҰ»еӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫдёә____гҖӮ (2) Fзҡ„ж°ўеҢ–зү©жҳҜз”ұ____(жһҒжҖ§жҲ–йқһжһҒжҖ§)й”®еҪўжҲҗзҡ„еҲҶеӯҗпјҢеҶҷеҮәе®һйӘҢе®ӨеҲ¶еӨҮиҜҘж°ўеҢ–зү©зҡ„еҢ–еӯҰж–№зЁӢејҸ____гҖӮ (3) йқһйҮ‘еұһжҖ§D____E(еЎ«еӨ§дәҺжҲ–е°ҸдәҺ)пјҢиҜ·д»ҺеҺҹеӯҗз»“жһ„зҡ„и§’еәҰи§ЈйҮҠеҺҹеӣ пјҡ__гҖӮ
|
|||||||||||||||||
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
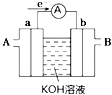
иғҪжәҗгҖҒиө„жәҗй—®йўҳжҳҜеҪ“еүҚдәәзұ»зӨҫдјҡйқўдёҙзҡ„дёҖйЎ№йҮҚеӨ§иҜҫйўҳгҖӮ (1)зӣҙжҺҘеҲ©з”Ёзү©иҙЁзҮғзғ§жҸҗдҫӣзғӯиғҪеңЁеҪ“д»ҠзӨҫдјҡд»Қ然еҚ еҫҲеӨ§жҜ”йҮҚпјҢдҪҶеӯҳеңЁеҲ©з”ЁзҺҮдҪҺзҡ„й—®йўҳгҖӮCH4гҖҒH2гҖҒCOгҖҒCH3OHйғҪжҳҜйҮҚиҰҒзҡ„иғҪжәҗзү©иҙЁпјҢз”Ізғ·зҮғзғ§зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡ____гҖӮ (2)зҮғж–ҷз”өжұ е°ҶиғҪйҮҸиҪ¬еҢ–ж•ҲзҺҮжҜ”зӣҙжҺҘзҮғзғ§ж•ҲзҺҮй«ҳпјҢеҰӮеӣҫдёәжҹҗз§ҚзҮғж–ҷз”өжұ зҡ„е·ҘдҪңеҺҹзҗҶзӨәж„ҸеӣҫпјҢaгҖҒbеқҮдёәжғ°жҖ§з”өжһҒгҖӮ
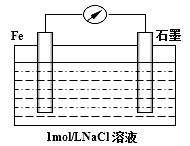
в‘ дҪҝз”Ёж—¶пјҢз©әж°”д»Һ____еҸЈйҖҡе…Ҙ(еЎ«вҖңAвҖқжҲ–вҖңBвҖқ)пјӣ в‘ЎеҒҮи®ҫдҪҝз”Ёзҡ„вҖңзҮғж–ҷвҖқжҳҜз”ІйҶҮпјҢaжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёәпјҡ____гҖӮ (3)й’ўй“Ғзҡ„и…җиҡҖзҺ°иұЎйқһеёёжҷ®йҒҚпјҢз”өеҢ–еӯҰи…җиҡҖжҳҜйҖ жҲҗй’ўй“Ғи…җиҡҖзҡ„дё»иҰҒеҺҹеӣ пјҢжҹҗеҗҢеӯҰжҢүдёӢеӣҫиҝӣиЎҢй’ўй“Ғи…җиҡҖзҡ„жЁЎжӢҹпјҢеҲҷжӯЈжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёәпјҡ____пјҢеҪ“еҜјзәҝдёӯжңү3.01Г—1023дёӘз”өеӯҗжөҒиҝҮпјҢиў«и…җиҡҖзҡ„й“Ғе…ғзҙ дёә____gгҖӮ[ жҸҗзӨәпјҡз”өеҢ–еӯҰзҡ„жҖ»еҸҚеә”ејҸдёә2Fe+2H2O+O2=2Fe(OH)2]
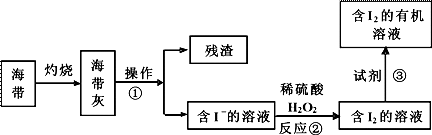
(4)жө·ж°ҙеҢ–еӯҰиө„жәҗзҡ„ејҖеҸ‘еҲ©з”Ёе…·жңүйҮҚиҰҒзҡ„ж„Ҹд№үе’ҢдҪңз”ЁпјҢдёӢеӣҫжҳҜжө·еёҰдёӯжҸҗеҸ–зўҳзҡ„зӨәж„Ҹеӣҫпјҡ
в‘ дёӯж“ҚдҪңзҡ„еҗҚз§°жҳҜ____пјӣеҸҚеә”в‘Ўзҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜ____пјҢдёӢиҝ°зү©иҙЁдёӯдёҚеҸҜеҒҡиҜ•еүӮв‘ўзҡ„жҳҜ____гҖӮ AпјҺд№ҷйҶҮВ В В В В В В В В BпјҺиӢҜВ В В В В В В В В CпјҺд№ҷй…ёВ В В В В В В В В DпјҺеӣӣж°ҜеҢ–зўі
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
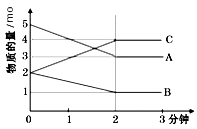
жҹҗеҸҚеә”еңЁдҪ“з§Ҝдёә5Lзҡ„жҒ’е®№еҜҶй—ӯзҡ„з»қзғӯе®№еҷЁдёӯиҝӣиЎҢпјҢеҗ„зү©иҙЁзҡ„йҮҸйҡҸж—¶й—ҙзҡ„еҸҳеҢ–жғ…еҶөеҰӮдёӢеӣҫжүҖзӨәпјҲе·ІзҹҘAгҖҒBгҖҒCеқҮдёәж°”дҪ“пјүгҖӮ
(1) иҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә____гҖӮ (2) еҸҚеә”ејҖе§ӢиҮі2еҲҶй’ҹж—¶пјҢBзҡ„е№іеқҮеҸҚеә”йҖҹзҺҮдёә____гҖӮ (3) иғҪиҜҙжҳҺиҜҘеҸҚеә”е·ІиҫҫеҲ°е№іиЎЎзҠ¶жҖҒзҡ„жҳҜ______гҖӮ пјЎпјҺП…пјҲAпјүпјқ2П…пјҲBпјүВ В В В В В В В В В В В В BпјҺе®№еҷЁеҶ…ж°”дҪ“еҜҶеәҰдёҚеҸҳ CпјҺП…йҖҶпјҲAпјүпјқП…жӯЈпјҲCпјүВ В В В В В В В В В В В DпјҺеҗ„з»„еҲҶзҡ„зү©иҙЁзҡ„йҮҸзӣёзӯү E. ж··еҗҲж°”дҪ“зҡ„е№іеқҮзӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёҚеҶҚж”№еҸҳзҡ„зҠ¶жҖҒ (4) з”ұеӣҫжұӮеҫ—е№іиЎЎж—¶пјЎзҡ„иҪ¬еҢ–зҺҮдёә____гҖӮ (5)дёәдәҶз ”з©¶зЎ«й…ёй“ңзҡ„йҮҸеҜ№ж°ўж°”з”ҹжҲҗйҖҹзҺҮзҡ„еҪұе“ҚпјҢжҹҗеҗҢеӯҰи®ҫи®ЎдәҶеҰӮдёӢдёҖзі»еҲ—зҡ„е®һйӘҢпјҡе°ҶиЎЁдёӯжүҖз»ҷзҡ„ж··еҗҲжә¶ж¶ІеҲҶеҲ«еҠ е…ҘеҲ°6дёӘзӣӣжңүиҝҮйҮҸZnзІ’зҡ„е®№еҷЁдёӯпјҢ收йӣҶдә§з”ҹзҡ„ж°”дҪ“пјҢи®°еҪ•иҺ·еҫ—зӣёеҗҢдҪ“з§Ҝзҡ„ж°”дҪ“жүҖйңҖж—¶й—ҙгҖӮ
в‘ иҜ·е®ҢжҲҗжӯӨе®һйӘҢи®ҫи®ЎпјҢе…¶дёӯпјҡV1=____пјҢV6=____гҖӮ в‘ЎиҜҘеҗҢеӯҰжңҖеҗҺеҫ—еҮәзҡ„з»“и®әдёәпјҡеҪ“еҠ е…Ҙе°‘йҮҸCuSO4жә¶ж¶Іж—¶пјҢз”ҹжҲҗж°ўж°”зҡ„йҖҹзҺҮдјҡеӨ§еӨ§жҸҗй«ҳпјҢдҪҶеҪ“еҠ е…Ҙзҡ„CuSO4жә¶ж¶Іи¶…иҝҮдёҖе®ҡйҮҸж—¶пјҢз”ҹжҲҗж°ўж°”зҡ„йҖҹзҺҮеҸҚиҖҢдјҡдёӢйҷҚгҖӮиҜ·еҲҶжһҗж°ўж°”з”ҹжҲҗйҖҹзҺҮдёӢйҷҚзҡ„дё»иҰҒеҺҹеӣ ____гҖӮ
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ | ||||||
|
в… .д№ҷзғҜзҡ„дә§йҮҸйҖҡеёёз”ЁжқҘиЎЎйҮҸдёҖдёӘеӣҪ家зҡ„зҹіжІ№еҢ–е·Ҙж°ҙе№ігҖӮд»Ҙд№ҷзғҜдёәдё»иҰҒеҺҹж–ҷеҗҲйҮҚиҰҒзҡ„жңүжңәеҢ–еҗҲзү©и·ҜзәҝеҰӮдёӢеӣҫжүҖзӨәгҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳгҖӮ
(1)Aзү©иҙЁжүҖеҗ«е®ҳиғҪеӣўзҡ„еҗҚз§°жҳҜ____гҖӮ (2)еҸҚеә”в‘ўзҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜ____гҖӮ (3)дёӢеҲ—зү©иҙЁдёӯпјҢдёҚиғҪйҖҡиҝҮд№ҷзғҜеҠ жҲҗеҸҚеә”еҫ—еҲ°зҡ„жҳҜ____пјҲеЎ«еәҸеҸ·пјүгҖӮ a. CH3CH3 В В В В В В В b. CH3CHCl2В В В В В В c. CH3CH2Br в…Ў.и‘Ўиҗ„еҸҜз”ЁдәҺй…ҝй…’гҖӮ (1)жЈҖйӘҢи‘Ўиҗ„жұҒеҗ«и‘Ўиҗ„зі–зҡ„ж–№жі•жҳҜпјҡеҗ‘е…¶дёӯеҠ зўұи°ғиҮізўұжҖ§пјҢеҶҚеҠ е…Ҙж–°еҲ¶еӨҮзҡ„CuпјҲOHпјү2пјҢеҠ зғӯпјҢе…¶зҺ°иұЎжҳҜ____гҖӮ (2)и‘Ўиҗ„й…’еҜҶе°ҒеӮЁеӯҳиҝҮзЁӢдёӯз”ҹжҲҗдәҶжңүйҰҷе‘ізҡ„й…ҜпјҢй…Ҝд№ҹеҸҜд»ҘйҖҡиҝҮеҢ–еӯҰе®һйӘҢжқҘеҲ¶еӨҮгҖӮе®һйӘҢе®Өз”ЁдёӢеӣҫжүҖзӨәиЈ…зҪ®еҲ¶еӨҮд№ҷй…ёд№ҷй…Ҝпјҡ
в‘ иҜ•з®Ўaдёӯз”ҹжҲҗд№ҷй…ёд№ҷй…Ҝзҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜ____гҖӮ в‘Ўе®һйӘҢејҖе§Ӣж—¶пјҢиҜ•з®Ўbдёӯзҡ„еҜјз®ЎдёҚдјёе…Ҙж¶ІйқўдёӢзҡ„еҺҹеӣ жҳҜ____гҖӮ (3)жңүжңәзү©Eз”ұзўігҖҒж°ўгҖҒж°§дёүз§Қе…ғзҙ з»„жҲҗпјҢеҸҜз”ұи‘Ўиҗ„зі–еҸ‘й…өеҫ—еҲ°пјҢд№ҹеҸҜд»Һй…ёзүӣеҘ¶дёӯжҸҗеҸ–пјҢзәҜеҮҖзҡ„Eдёәж— иүІзІҳзЁ ж¶ІдҪ“пјҢжҳ“жә¶дәҺж°ҙпјҺдёәз ”з©¶Eзҡ„з»„жҲҗдёҺз»“жһ„пјҢиҝӣиЎҢдәҶеҰӮдёӢе®һйӘҢпјҡ
в‘ЈеҶҷеҮәEдёҺNaHCO3жә¶ж¶ІеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ__________гҖӮ
|
|||||||
- й«ҳдәҢеүҚеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰзҪ‘дёҠжЈҖжөӢж— зәёиҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲ2018-2019е№ҙе№ҝиҘҝе…ҙе®үеҺҝ第дёүдёӯеӯҰпјү
- е№ҝиҘҝеҚ—е®ҒеёӮ2019е№ҙй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҲиҖғжөӢйӘҢеңЁзәҝе…Қиҙ№иҖғиҜ•
- 2019-2020е№ҙй«ҳдёҖдёӢеҶҢ第дёҖж¬Ўж‘ёеә•иҖғиҜ•еҢ–еӯҰиҖғиҜ•пјҲеұұиҘҝзңҒиҝҗеҹҺеёӮй«ҳдёӯиҒ”еҗҲдҪ“пјү
- 2018иҮі2019е№ҙй«ҳдёҖдёӢеҚҠе№ҙ第дәҢж¬Ўж®өиҖғеҢ–еӯҰпјҲжұҹиҘҝзңҒж–°дҪҷеёӮеҲҶе®ңдёӯеӯҰпјү
- 2019еұҠй«ҳдёүдёӢжңҹ第дёҖж¬ЎжЁЎжӢҹиҖғиҜ•еҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲеұұдёңзңҒжөҺе®ҒеёӮпјү
- жұҹиҘҝ2018е№ҙй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹдёӯиҖғиҜ•иҜ•еҚ·еёҰи§ЈжһҗеҸҠзӯ”жЎҲ
- жІіеҢ—2019е№ҙй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҲиҖғжөӢйӘҢеҗҢжӯҘз»ғд№
- 2019-2020е№ҙй«ҳдёҖдёҠеҚҠе№ҙжңҹдёӯиҖғиҜ•еҢ–еӯҰиҜ•еҚ·е®Ңж•ҙзүҲпјҲеҶ…и’ҷеҸӨеҢ…еӨҙеёӮ第еӣӣдёӯеӯҰпјү