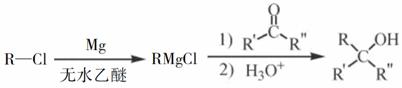2020山东高三上学期鲁科版高中化学期末考试
| 1. | 详细信息 |
|
化学与生活、生产密切相关,下列说法错误的是( ) A. Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池 B. 工业生产玻璃、水泥,均需要用石灰石为原料 C. 将二氧化硫添加于红酒中可以起到杀菌和抗氧化作用 D. 纳米铁粉和FeS都可去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其原理是相同的。
|
|
| 2. | 详细信息 |
|
有机物命名正确的是( ) A.2,3,5-三甲基己烷 B.1,3-二甲基丁烷 C.2,3-二甲基-2-乙基己烷 D.2,3-二甲基-4-乙基戊烷
|
|
| 3. | 详细信息 |
|
下列实验方案中,能达到相应实验目的是( )
A.方案①用于分离I2和NH4I固体 B.方案②用于比较CuSO4和MnO2的催化活性 C.方案③用于测定中和热 D.方案④用于比较醋酸和硼酸的酸性强弱
|
|
| 4. | 详细信息 |
|
美国《Science》上发表论文,宣布发现了一种 Al 的超原子结构,这种超原子(Al13)是以 1 个 Al 原子 在中心,12 个 Al 原子在表面形成的三角二十面体结构。这种超原子具有 40 个价电 子(价电 子即主族元 素的最外层电子数)时最稳定。请预测稳定的 Al13 所带的电荷为( ) A.-1 B.+2 C.+3 D.0
|
|
| 5. | 详细信息 |
|
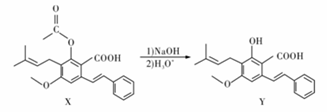
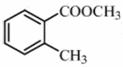
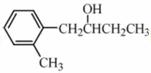
化合物Y具有抗菌、消炎作用,可由化合物X制得。
A. Y与乙酸发生酯化反应可得到X B.1mol X最多能与2mol NaOH反应 C.X、Y均能与酸性KMnO4溶液反应 D.室温下X、Y分别与足量Br2加成的产物分子中的手性碳原子数目相等
|
|
| 6. | 详细信息 |
|
短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,甲的浓溶液和A发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体。上述物质的转化关系如图所示。下列说法正确的是( ) A. 丁和戊中所含元素种类相同 B. 简单离子半径大小:X<Y C. 气态氢化物的还原性:X>Z D. Y的简单离子与Z的简单离子在水溶液中可大量共存
|
|
| 7. | 详细信息 | ||||||||||||||||||||
|
下表中实验操作、现象和所得出的结论正确的是( )
|
|||||||||||||||||||||
| 8. | 详细信息 |
|
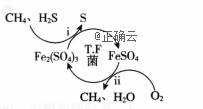
天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫, 其原理如图所示。下列说法不正确的是( )
A.脱硫过程O2间接氧化H2S B. 该脱硫过程需要不断添加Fe2(SO4)3溶液 C.亚铁是血红蛋白重要组成成分,FeSO4可用于治疗缺铁性贫血 D.《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐
|
|
| 9. | 详细信息 |
|
物质性质的差异与分子间作用力有关的是( ) A.硬度:晶体硅<金刚石 B.热稳定性:HF>HCl C.沸点:Cl2<I2 D.熔点:MgO>NaCl
|
|
| 10. | 详细信息 |
|
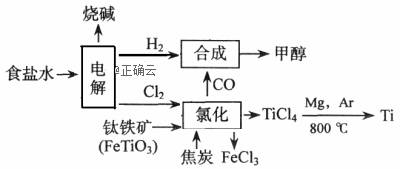
.如今环境保护越来越受重视,某化工集团为减少环境污染,提高资源的利用率、将钛厂、氯碱厂、甲醇厂进行联合生产。其主要生产工艺如下:(FeTiO3中Ti为+4价)
下列叙述正确的是( ) A.该流程中只有“电解”、“氯化”涉及氧化还原反应 B.“合成”反应中氧化剂与还原剂的物质的量之比为1:1 C.“氯化”时反应方程式为7Cl2+2FeTiO3+6C=2FeCl3+2TiCl4+6CO(条件省略) D.上述流程中“Mg,Ar"可用“Mg,CO2”代替
|
|
| 11. | 详细信息 |
|
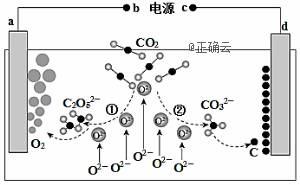
我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下: 下列说法不正确的是( )
A.b为电源的正极 B.①②中,捕获CO2时碳元素的化合价发生了变化 C.a极的电极反应式为2C2O52—— 4e-=4CO2+O2 D.上述装置存在的电解总反应式为:CO2
|
|
| 12. | 详细信息 |
|
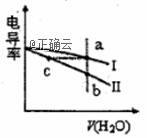
电导率是衡量电解质溶液导电能力大小的物理量。常温下,将相同体积的盐酸和氨水分别加水稀释,溶液的电导率随加入水的体积V(H2O)变化的曲线如图所示,下列说法正确的是( )
A. 曲线I表示盐酸加水稀释过程中溶液电导率的变化 B. a、b、c三点溶液的pH:a>b>c C. 将a、b两点溶液混合,所得溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O) D. 氨水稀释过程中,c(NH4+)/ c(NH3·H2O)不断减小
|
|
| 13. | 详细信息 |
|
KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。利用“KClO3氧化法”制备KIO3包括以下两个反应:①11KClO3+6I2+3H2O == 6KH(IO3)2+3Cl2↑+5KCl ②KH(IO3)2+KOH == 2KIO3+H2O 下列说法正确的是( ) A.化合物KH(IO3)2中含有共价键、离子键和氢键等化学键 B.反应①中每转移4mol电子生成2.24LCl2 C.向淀粉溶液中加入少量碘盐,溶液不会变蓝 D.可用焰色反应实验证明碘盐中含有钾元素
|
|
| 14. | 详细信息 |
|
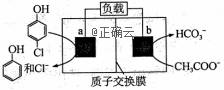
下图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是( )
A.工作时,a极的电势低于b极的电势 B.工作一段时间之后,a极区溶液的pH减小 C.a、b极不能使用同种电极材料 D.b极的电极反应式为:CH3 COO-+4H2O-8e-=2HCO3-+9H+
|
|
| 15. | 详细信息 |
|
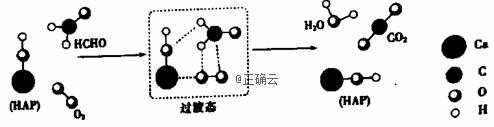
某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):
下列说法不正确的是( ) A.HAP能提高HCHO与O2的反应速率 B.HCHO在反应过程中,有C-H键发生断裂 C.根据图示信息,CO2分子中的氧原子全部来自O2 D.该反应可表示为:HCHO+O2
|
|
| 16. | 详细信息 |
|
常见的太阳能电池有单晶硅或多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。请回答下列问题: (1)基态硒原子的价电子排布式为_____________;H2O的沸点高于H2Se的沸点(-42℃),其原因是____________________________。 (2)已知GaCl3晶体熔点为77.9℃,沸点为201.3℃,GaCl3晶体类型为___________________。 (3)Na3AsO4中阴离子的空间构型为__________,As原子采取__________杂化。 (4)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:_______________________。 (5)锌与铜位于同一周期。硫化锌的晶胞结构如图所示,S2-周围等距离且最近的Zn2+个数为____;若晶胞边长为dpm,则硫化锌的密度为___________________g·cm-3(不必简化)。
|
|
| 17. | 详细信息 | ||||||||||||||||||||||||||||||||||
|
“绿水青山就是金山银山”。目前人们对环境保护、新能源开发很重视,研究NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。 (1)有人设计通过硫循环完成CO的综合处理,原理为 a.2CO(g)+SO2(g) b.S(l)+2H2O(g) 则CO和水蒸气完全反应生成H2和CO2的热化学方程式为__________________________________。 (2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g)
①前10min内的平均反应速率v(CO)= _______;在20min时,温度T2下,该反应的化学平衡常数为________________。 ②若30min时升高温度,化学平衡常数值_______(填:“增大“减小”“不变”)。 ③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有_____________(填两种措施即可) ④在恒温恒容下,下列可以判断CO(g)+2H2(g) a.2v正(H2)=v逆(CH3OH) b.混合气体的物质的量不再变化 c.单位时间内有1 mol CO消耗同时消耗2molH2 d.混合气体的平均相对分子质量不变 (3)已知反应2NO(g)+O2(g)
则k1=____, m =_____, n =_____。
|
|||||||||||||||||||||||||||||||||||
| 18. | 详细信息 |
|
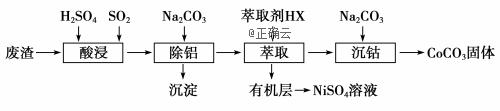
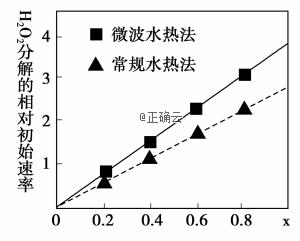
金属Co、Ni性质相似,在电子工业以及金属材料上应用十分广泛.现以含钴、镍、铝的废渣(含主要成分为CoO、Co2O3、Ni、少量杂质Al2O3)提取钴、镍的工艺如下:
(1)酸浸时SO2的作用是___________________________________。 (2)除铝时加入碳酸钠产生沉淀的离子反应_________________________________。 (3)用CoCO3为原料采用微波水热法和常规水热法均可制得H2O2分解的高效催化剂CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价).如图是用两种不同方法制得的CoxNi(1-x)Fe2O4 在10℃时催化分解6%的H2O2 溶液的相对初始速率随x 变化曲线.
①H2O2 的电子式_________________________________。 ②由图中信息可知:_________________________________法制取的催化剂活性更高。 ③Co2+ 、Ni2+ 两种离子中催化效果更好的是_________________________________。 (4)已知煅烧CoCO3时,温度不同,产物不同.在400℃充分煅烧CoCO3,得到固体氧化物的质量2.41g,CO2的体积为0.672L(标况下),则此时所得固体氧化物的化学式为____________。
|
|
| 19. | 详细信息 |
|
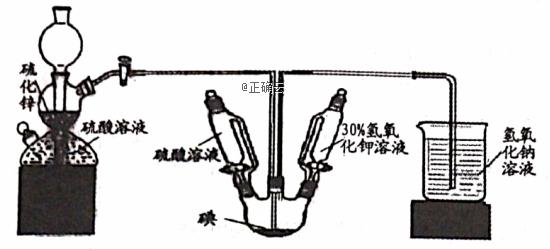
KI用于分析试剂、感光材料、制药和食品添加剂等。 制备原理如下:反应① 3I2 +6KOH = KIO3 +5KI +3H2O反应② 3H2S +KIO3 =3S↓+KI+3H2O
按照下列实验过程,请回答有关问题。 (1)启普发生器中发生的化学方程式为______________________________,用该装置还可以制备_________(填一种气体化学式)。 (2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,待观察到 _____________(填现象),停止滴入KOH溶液;然后________________________(填操作),待KIO3 混合液和NaOH溶液气泡速率接近相同时停止通气。 (3)滴入硫酸溶液,并对KI混合液水浴加热,其目的是________________________。 (4)把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和_________,其中加入碳酸钡的作用是_______________。合并滤液和洗液,蒸发至析出结晶。滤出经干燥得成品。 (5)如果得到3.2g硫单质,则理论上制得的KI为_________g。
|
|
| 20. | 详细信息 |
|
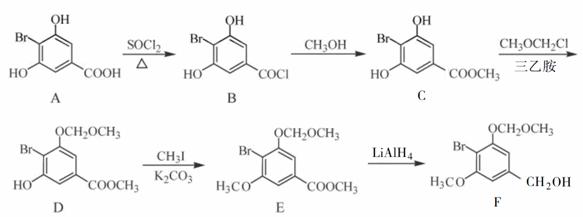
化合物F是合成一种天然茋类化合物的重要中间体,合成路线如下:
(1)A中含氧官能团的名称为___________和___________。 (2)A→B的反应类型为___________。 (3)C→D的反应中有副产物X(分子式为C12H15O6Br)生成,写出X的结构简式:_____________。 (4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:__________________。 ①能与FeCl3溶液发生显色反应; ②碱性水解后酸化,含苯环的产物分子中不同化学环境的氢原子数目比为1∶1。 (5)已知:(1) 写出以
|
|