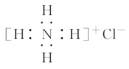2017宁夏高一下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满。若发现 119 号元素,请在“元素大厦”中安排好它的“房间” ( ) A.第七周期0族 B.第六周期第ⅡA族 C.第八周期第ⅠA族 D.第七周期第ⅦA 族
|
|
| 2. | 详细信息 |
|
正确掌握化学用语是学好化学的基础,下列有关表述正确的是( ) A.H、D、T互为同素异形体 B.氨分子中的化学键为非极性共价键 C.NH4Cl 的电子式: D.S2-的结构示意图:
|
|
| 3. | 详细信息 |
|
食盐(NaCl)是生活中常用的调味品,HCl是胃酸的主要成分,下列关于两种物质的说法正确的是 ( ) A.炒菜时放入食盐并不破坏 NaCl 中的化学键 B.HCl 的电子式是 C.NaCl 熔化时破坏共价键 D.HCl 的结构式是 H—Cl
|
|
| 4. | 详细信息 |
|
下列各组元素性质递变情况错误的是 ( ) A.H、Be、B原子最外层电子数依次增多 B.P、S、Cl元素最高正化合价依次升高 C.B、C、N、O、F原子半径依次增大 D.Li、Na、K、Rb的金属性依次增强
|
|
| 5. | 详细信息 |
|
下列反应的能量变化与其他三项不相同的是:( ) A.生石灰与水的反应 B.氯化铵与氢氧化钙的反应 C.锌片与稀硫酸的反应 D.金属钠与冷水的反应
|
|
| 6. | 详细信息 |
|
国际无机化学命名委员会作出决定:把长式周期表原有的主、副族及族号取消,由左至右按原顺序改为18列,如碱金属为第一列,稀有气体为18列,按这个规定,下列说法中错误的是 ( ) A.第3列元素种类最多,第14列元素形成的化合物种类最多 B.第8、9、10三列元素中没有非金属元素 C.只有第2列元素的原子最外层有2个电子 D.从上到下第1列碱金属元素的单质熔点逐渐降低,第17列元素的单质熔点逐渐升高
|
|
| 7. | 详细信息 |
|
“天宫一号”的燃料是氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,对这三种物质的下列说法中正确的是( ) A.质子数之比为1∶2∶3 B.中子数之比为1∶1∶1 C.质量数之比为8∶9∶10 D.化学性质不相同
|
|
| 8. | 详细信息 |
|
下列关于物质结构、性质的说法正确的是 ( ) A.因为酸性:HCl>H2CO3,所以非金属性:Cl>C B.同一周期元素的原子,半径越小越容易失去电子 C.K的原子半径比Na的原子半径大,K与水反应比Na与水反应更剧烈 D.离子化合物中可能含有共价键,共价化合物中可能含有离子键
|
|
| 9. | 详细信息 |
|
下列变化过程中,共价键被破坏的是( ) A.冰变成水 B.氯化氢气体溶于水 C.氯化钠熔化 D.酒精溶于水
|
|
| 10. | 详细信息 |
|
电子式书写错误的是 ( ) A. C.
|
|
| 11. | 详细信息 |
|
下列各组物质中化学键的类型完全相同的是 ( ) A.HCl、MgCl2、NH4Cl B.H2O、Na2O、CO2 C.CaCl2 、K2S、Na2O2 D.NH3、H2O、CO2
|
|
| 12. | 详细信息 |
|
X、Y、Z三种非金属元素具有相同的电子层数,它们的气态氢化物的稳定性强弱顺序是XH3<H2Y<HZ,下列说法中正确的是( ) A.原子序数X>Y>Z B.原子得电子能力X<Y<Z C.原子半径X<Y<Z D.离子还原性X3-<Y2-<Z-
|
|
| 13. | 详细信息 |
|
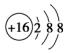
元素原子的质量数为A,Rn+核外电子数为x,则WgRn+离子所含中子数为 ( ) A. C.
|
|
| 14. | 详细信息 | |||||||||||||||||||||
|
六种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是 ( )
A.等物质的量的X、Y的单质与足量的盐酸反应,生成的H2一样多 B.Y与Q形成的化合物不能跟氢氧化钠溶液反应 C.Z的氢化物的稳定性强于 L 的氢化物的稳定性 D.在化学反应中, M 原子与其他原子易形成共价键而不易形成离子键
|
||||||||||||||||||||||
| 15. | 详细信息 |
|
元素R的气态氢化物的化学式为H2R,则R的最高价氧化物对应水化物化学式 是( ) A.H2RO4 B.HRO3 C.H3RO4 D.H2RO3
|
|
| 16. | 详细信息 |
|
B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物显碱性,且碱性B>A;C、D两种元素对应气态氢化物的稳定性C>D;E是这五种元素中形成简单离子半径最小的元素。则它们的原子序数由小到大的顺序为 ( ) A.D<C<E<A<B B.B<A<E<D<C C.E<B<A<C<D D.A<B<C<D<E
|
|
| 17. | 详细信息 |
|
期元素的离子aW2+、bX+、cY2-、dZ- 都具有相同的电子层结构,下列推断正确的是( ) A.原子半径:W>X>Z>Y B.热稳定性: H2Y>HZ C.离子半径:W2+>Y2- D.碱性:XOH>W(OH)2
|
|
| 18. | 详细信息 |
|
同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断中正确的是( ) A.元素非金属性按X、Y、Z的顺序减弱 B.阴离子的还原性按X、Y、Z的顺序减弱 C.气态氢化物的稳定性按X、Y、Z的顺序增强 D.单质的氧化性按X、Y、Z的顺序增强
|
|
| 19. | 详细信息 |
|
X、Y和Z是短周期元素组成的三种单质,X的组成元素是第三周期原子半径最大的元素;Y和Z均由元素R组成,Y由两个原子组成,R最外层电子数是内层电子数的3倍,下列推断正确的是( ) A.Y和Z互为同位素 B.X和Y能化合成两种化合物 C.X和Y化合的产物中一定不含有共价键 D.X离子比R的离子半径大
|
|
| 20. | 详细信息 |
|
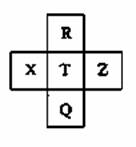
R、X、T、Z、Q在元素周期表中的相对位置如右表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
A.非金属性:Z<T<X B.R与Q的电子数相差24 C.气态氢化物稳定性:R<T<Q D.最高价氧化物的水化物的酸性:T>Q
|
|
| 21. | 详细信息 |
|
铍的原子序数为 4,下列对铍及其化合物的叙述中,正确的是( ) A.铍的金属性比钠强 B.氯化铍的氧化性比氯化锂弱 C.氢氧化铍的碱性比氢氧化钙弱 D.单质铍易跟冷水反应生成 H2
|
|
| 22. | 详细信息 |
|
元素X、Y、Z的原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子排布。下列推测不正确的是( ) A.同周期元素中 X 的金属性最强 B.原子半径:X>Y,离子半径:X+>Z2- C.同族元素中Z的氢化物稳定性最高 D.同周期元素中Y的最高价含氧酸的酸性最强
|
|
| 23. | 详细信息 |
|
现有下列物质: ①Cl2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥Na2O ⑦NH4Cl ⑧CO2 (1)只由离子键构成的物质是________________(填序号,下同) (2)只由极性键构成的物质是______ (3)只由非极性键构成的物质_______________ (4)由极性键和非极性键构成的物质是_____________ (5)由离子键和极性键构成的物质是___________ (6)由离子键和非极性键构成的物质是______________ (7)属于离子化合物的是___________________ (8)属于共价化合物的是__________________
|
|
| 24. | 详细信息 | |||||||||||||||||||||||||||||||||||||||||||||
|
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)金属性最强的元素是___________(填元素名称);⑥的离子结构示意图是________________ ; (2)④、⑤、⑥的原子半径由大到小的顺序为_________________。 (填元素符号); (3)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是________________。 (4)少量元素⑤的单质通常保存在_______________中; (5)用电子式表示④和⑤形成化合物的过程: ___________________ (6)常温下,将元素⑧的单质通入元素⑤的最高价氧化物对应的水化物中,其反应的离子方程式为___________________。 (7)在⑧与⑩的单质中,化学性质较活泼的是____________________,(填元素符号) 请设计一个实验方案,证明⑧和⑩的非金属性强弱___________________。
|
||||||||||||||||||||||||||||||||||||||||||||||
| 25. | 详细信息 |
|
A、B、C、D、E、F属于短周期主族元素.A的原子半径是短周期中最大,B元素的原子最外层电子数为m、次外层电子数为n,C元素的原子L层电子数为m+n, M层电子数为m﹣n,D元素与C元素同主族,E元素原子与B元素原子的核外电子数之比为2:1,F的一种原子中,质量数与质子数之差为零. (1)写出元素的名称C________E________F________. (2)C在周期表中的位置是________ (3)A2B2的电子式为______. (4)A、B形成的简单离子的半径由大到小的顺序为________.(用对应的化学符号填空,下同) (5)A、E形成的是________(填共价或离子)化合物 (6)B、E两种元素形成的气态氢化物中稳定性更强的是______; (7)由元素C形成的单质Y与由A、B、F三种元素形成的化合物X的水溶液反应的离子方程式为___________________________________.
|
|
| 26. | 详细信息 | ||||||||||||||||||||||||
|
A,B,C,D,E,F,G为7种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下,其中:B的离子半径大于E的离子半径;D是由极性键构成的4原子分子;C与F可形成D和G分子。
(1)A粒子的结构示意图是_________。 (2)用电子式表示D的形成过程: ________________________ (3)比较B与E相应元素的最高价氧化物对应水化物的碱性强弱,为______>_______(用化学式表示)。 (4)D与G反应的化学方程式是_________________。 (5)C粒子是_________,F粒子是_________(用电子式表示)。
|
|||||||||||||||||||||||||