2019иҙөе·һй«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
В еҰӮд»ҠпјҢжҲ‘еӣҪе·Із»ҸжҠҠжҺўжөӢеҷЁеҸ‘е°„еҲ°дәҶжңҲзҗғд№ӢдёҠгҖӮжҚ®жҠҘйҒ“пјҢжңҲзҗғдёҠжңүеӨ§йҮҸ3HeеӯҳеңЁпјҢд»ҘдёӢе…ідәҺ3Heзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү В В В A. жҳҜ4Heзҡ„еҗҢзҙ ејӮеҪўдҪ“В В В В В В В В В В В В В В В B. жҜ”4HeеӨҡдёҖдёӘдёӯеӯҗ В В C. жҳҜ4Heзҡ„еҗҢдҪҚзҙ В В В В В В В В В В В В В В В В В В В D. жҜ”4Heе°‘дёҖдёӘиҙЁеӯҗ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү В В A.40В Kе’Ң40В CaеҺҹеӯҗдёӯзҡ„иҙЁеӯҗж•°е’Ңдёӯеӯҗж•°йғҪзӣёзӯү В В BпјҺжҹҗе…ғзҙ жңҖеӨ–еұӮеҸӘжңүдёҖдёӘз”өеӯҗпјҢеҲҷе®ғдёҖе®ҡжҳҜв… Aж—Ҹе…ғзҙ C.д»»дҪ•еҺҹеӯҗжҲ–зҰ»еӯҗзҡ„з»„жҲҗдёӯйғҪеҗ«жңүиҙЁеӯҗ В DпјҺеҗҢдҪҚзҙ зҡ„дёҚеҗҢж ёзҙ зү©зҗҶгҖҒеҢ–еӯҰжҖ§иҙЁе®Ңе…ЁзӣёеҗҢ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
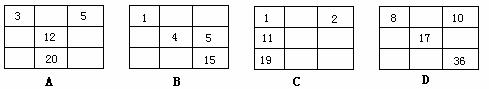
дёӢеҲ—еҢ–еҗҲзү©дёӯж—ўжңүзҰ»еӯҗй”®еҸҲжңүе…ұд»·й”®зҡ„жҳҜпјҲВ В пјү A.KBrВ В В В В В В В В В В В B.Na2O2В В В В В В В В В В В C.HBrВ В В В В В В В В В В В В D.N2
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯйҮ‘еұһе…ғзҙ дёҺйқһйҮ‘еұһе…ғзҙ зҡ„еҲҶз•Ңзәҝйҷ„иҝ‘зҡ„дёҖдәӣе…ғзҙ иғҪз”ЁдәҺеҲ¶пјҲВ В пјү В В AпјҺеҗҲйҮ‘ В В В В В В В В В BпјҺеҚҠеҜјдҪ“ В В В В В В CпјҺеӮ¬еҢ–еүӮ В В В В В В В DпјҺеҶңиҚҜ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲВ В пјү В AпјҺеҗ«жңүе…ұд»·й”®зҡ„еҢ–еҗҲзү©дёҖе®ҡжҳҜе…ұд»·еҢ–еҗҲзү©В BпјҺеңЁе…ұд»·еҢ–еҗҲзү©дёӯдёҖе®ҡеҗ«жңүе…ұд»·й”® В CпјҺеҗ«жңүзҰ»еӯҗй”®зҡ„еҢ–еҗҲзү©дёҖе®ҡжҳҜзҰ»еӯҗеҢ–еҗҲзү©В DпјҺеҸҢеҺҹеӯҗеҚ•иҙЁеҲҶеӯҗдёӯзҡ„е…ұд»·еҒҘдёҖе®ҡжҳҜйқһжһҒжҖ§й”®
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„дёӯеұһдәҺеҗҢдҪҚзҙ е…ізі»зҡ„жҳҜпјҲВ В пјү AпјҺ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ғзҙ жҖ§иҙЁе‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ–зҡ„еҶіе®ҡеӣ зҙ жҳҜпјҲВ В пјү AпјҺе…ғзҙ еҺҹеӯҗеҚҠеҫ„еӨ§е°Ҹе‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ–В В В В В В В В В В BпјҺе…ғзҙ еҺҹеӯҗйҮҸдҫқж¬ЎйҖ’еўһ CпјҺе…ғзҙ еҺҹеӯҗжңҖеӨ–еұӮз”өеӯҗжҺ’еёғе‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ–В В В В DпјҺе…ғзҙ зҡ„жңҖй«ҳжӯЈеҢ–еҗҲд»·е‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ–
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘжҹҗзІ’еӯҗ В AпјҺZВ В В В В В В В В В В В В В BпјҺA-ZВ В В В В В В В В В В В В В CпјҺZ-nВ В В В В В В В В В В В В В В DпјҺZ+nВ В
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„дёӯеҢ–еҗҲзү©зҡ„жҖ§иҙЁжҜ”иҫғпјҢдёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺй…ёжҖ§пјҡHClO4пјһHBrO4пјһHIO4В В В В В В В В В В В В BпјҺзўұжҖ§пјҡNaOHпјһMg(OH)2пјһAl(OH)3 CпјҺзЁіе®ҡжҖ§пјҡPH3пјһH2Sпјһ HClВ В В В В В В В В В В В В В DпјҺйқһйҮ‘еұһжҖ§пјҡFпјһOпјһS
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗдё»ж—Ҹе…ғзҙ Rзҡ„жңҖй«ҳжӯЈд»·дёҺжңҖдҪҺиҙҹеҢ–еҗҲд»·зҡ„д»Јж•°е’Ңдёә4пјҢз”ұжӯӨеҸҜд»ҘеҲӨж–ӯпјҲВ В пјү AпјҺRдёҖе®ҡжҳҜ第еӣӣе‘Ёжңҹе…ғзҙ В В В В В В В В В В В В В В В В В В В В В В В В В BпјҺRдёҖе®ҡжҳҜв…ЈAж—Ҹе…ғзҙ CпјҺRзҡ„ж°”жҖҒж°ўеҢ–зү©жҜ”еҗҢе‘Ёжңҹе…¶д»–е…ғзҙ ж°”жҖҒж°ўеҢ–зү©зЁіе®ҡВ DпјҺRж°”жҖҒж°ўеҢ–зү©еҢ–еӯҰејҸдёәH2R
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—з”өеӯҗејҸжҲ–з»“жһ„ејҸй”ҷиҜҜзҡ„жҳҜпјҲВ В пјү
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
. AгҖҒBдёӨдё»ж—Ҹе…ғзҙ еұһдәҺеҗҢдёҖе‘ЁжңҹпјҢе®ғ们зҡ„еҺҹеӯҗиғҪд»Ҙе…ұд»·й”®з»“еҗҲжҲҗеҢ–еӯҰејҸдёәAB2еһӢеҲҶеӯҗпјҢAгҖҒBе…ғзҙ еңЁе‘ЁжңҹиЎЁдёӯзҡ„ж—ҸеәҸж•°еҸҜиғҪдёәпјҲВ В пјү В В AпјҺв… AгҖҒв…ӨA В В В В В В В BпјҺв… AгҖҒв…ҰA В В В В В В В CпјҺв…ЈAгҖҒв…ҘA В В В В В В В В DпјҺв…ЎAгҖҒв…ҘA
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
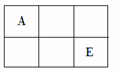
дёӢеҲ—еҗ„иЎЁдёӯзҡ„ж•°еӯ—д»ЈиЎЁзҡ„жҳҜеҺҹеӯҗеәҸж•°пјҢиЎЁдёӯж•°еӯ—жүҖиЎЁзӨәзҡ„е…ғзҙ дёҺе®ғ们еңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®зӣёз¬Ұзҡ„жҳҜпјҲВ В пјү
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…ізўұйҮ‘жҖ§й“·(Rb)зҡ„еҸҷиҝ°дёӯпјҢжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү В В В AпјҺзҒјзғ§ж°ҜеҢ–й“·ж—¶пјҢзҒ«з„°жІЎжңүзү№ж®ҠйўңиүІВ В В В В В В В В BпјҺзЎқй…ёй“·жҳҜзҰ»еӯҗеҢ–еҗҲзү©пјҢжҳ“жә¶дәҺж°ҙ В В В CпјҺеңЁй’ гҖҒй’ҫгҖҒй“·дёүз§ҚеҚ•иҙЁдёӯпјҢй“·зҡ„зҶ”зӮ№жңҖй«ҳВ В В DпјҺж°ўж°§еҢ–й“·жҳҜејұзўұ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӨз§Қеҫ®зІ’зҡ„иҙЁеӯҗж•°е’Ңз”өеӯҗж•°еқҮеҲҶеҲ«зӣёзӯүпјҢе®ғ们дёҚеҸҜиғҪжҳҜпјҲВ В пјү AпјҺдёҖз§ҚйҳізҰ»еӯҗе’ҢдёҖз§ҚйҳҙзҰ»еӯҗгҖҖгҖҖBпјҺдёҖз§ҚеҚ•иҙЁе’ҢдёҖз§ҚеҢ–еҗҲзү©еҲҶеӯҗгҖҖгҖҖ CпјҺдёҖз§ҚеҲҶеӯҗе’ҢдёҖз§ҚеҲҶеӯҗгҖҖгҖҖгҖҖгҖҖDпјҺдёҖз§ҚеҺҹеӯҗе’ҢдёҖз§ҚеҲҶеӯҗ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҺLi<Na<K<Rb<Csзҡ„еҸҳеҢ–规еҫӢ(з”ұејұеҲ°ејәжҲ–з”ұдҪҺеҲ°й«ҳ)дёҚз¬ҰеҗҲзҡ„жҳҜпјҲВ В пјү В В AпјҺдёҺж°ҙжҲ–й…ёеҸҚеә”зҪ®жҚўж°ўж°”зҡ„йҡҫжҳ“ В В В BпјҺйҮ‘еұһжҖ§зҡ„ејәејұ В В CпјҺиҝҳеҺҹжҖ§зҡ„ејәејұ В В В В В В В В В В В В В В В В В DпјҺзҶ”жІёзӮ№
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӨзҹӯе‘Ёжңҹе…ғзҙ з»„жҲҗзҡ„еҢ–еҗҲзү©дёӯпјҢеҺҹеӯҗдёӘж•°жҜ”дёә1пјҡ3пјҢиӢҘдёӨз§Қе…ғзҙ зҡ„еҺҹеӯҗеәҸж•°еҲҶеҲ«дёәaе’ҢbпјҢеҲҷaе’Ңbзҡ„е…ізі»еҸҜиғҪжҳҜпјҲВ В пјү в‘ a=b+3пјӣв‘Ўa+b=8пјӣв‘ўa+b=30пјӣв‘Јa=b+8 AпјҺв‘ в‘Ўв‘ўв‘Ј гҖҖгҖҖгҖҖВ BпјҺв‘Ўв‘ўв‘Ј гҖҖгҖҖгҖҖгҖҖ В CпјҺв‘Ўв‘ў гҖҖгҖҖгҖҖгҖҖ DпјҺв‘ўв‘Ј
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
в‘ҙе…ғзҙ зҡ„з§Қзұ»еҶіе®ҡдәҺ________________ , ж ёзҙ зҡ„з§Қзұ»еҶіе®ҡдәҺ________________, е…ғзҙ зҡ„еҢ–еӯҰжҖ§иҙЁдё»иҰҒеҶіе®ҡдәҺ________________,дё»ж—Ҹе…ғзҙ зҡ„жңҖй«ҳжӯЈеҢ–еҗҲд»·еҶіе®ҡдәҺВ В В В В В В В В гҖӮ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ғзҙ е‘ЁжңҹиЎЁжңү______дёӘжЁӘиЎҢпјҢеҸ«е‘ЁжңҹпјҢжҜҸдёҖе‘Ёжңҹдёӯе…ғзҙ еҺҹеӯҗзҡ„_______________зӣёеҗҢпјҢд»Һе·ҰеҲ°еҸіе…ғзҙ зҡ„йҮ‘еұһжҖ§________пјҲеЎ«еўһејәжҲ–еҮҸејұпјүпјӣе…ғзҙ е‘ЁжңҹиЎЁдёӯжңү_______еҲ—пјҢ第в…ҘAж—ҸеӨ„еңЁз¬¬________еҲ—пјҢеҗҢдёҖдё»ж—Ҹд»ҺдёҠеҲ°дёӢпјҢе…ғзҙ зҡ„йқһйҮ‘еұһжҖ§дҫқж¬Ў_________пјҲеЎ«еўһејәжҲ–еҮҸејұпјүгҖӮ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||||||||||||||||||
|
дёӢиЎЁжҳҜе…ғзҙ е‘ЁжңҹиЎЁзҡ„дёҖйғЁеҲҶ, й’ҲеҜ№иЎЁдёӯзҡ„в‘ пҪһв‘Ёз§Қе…ғзҙ ,еЎ«еҶҷдёӢеҲ—з©әзҷҪ:
В (1) еңЁиҝҷдәӣе…ғзҙ дёӯ,еҢ–еӯҰжҖ§иҙЁжңҖдёҚжҙ»жіјзҡ„жҳҜ:В В В В В В В В (еЎ«е…·дҪ“е…ғзҙ з¬ҰеҸ·,дёӢеҗҢ)гҖӮ В (2) еңЁжңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©дёӯпјҢй…ёжҖ§жңҖејәзҡ„еҢ–еҗҲзү©зҡ„еҲҶеӯҗејҸжҳҜ_______пјҢзўұжҖ§жңҖејәзҡ„еҢ–еҗҲзү©зҡ„з”өеӯҗејҸжҳҜ:_____________гҖӮ В (3) жңҖй«ҳд»·ж°§еҢ–зү©жҳҜдёӨжҖ§ж°§еҢ–зү©зҡ„е…ғзҙ жҳҜ_________пјӣеҶҷеҮәе®ғзҡ„ж°§еҢ–зү©дёҺж°ўж°§еҢ–й’ еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ_____ ________________________________________гҖӮ В (4) з”Ёз”өеӯҗејҸиЎЁзӨәе…ғзҙ в‘ЈдёҺв‘Ҙзҡ„еҢ–еҗҲзү©зҡ„еҪўжҲҗиҝҮзЁӢпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҢиҜҘеҢ–еҗҲзү©еұһдәҺВ В В В В В В В В (еЎ« вҖңе…ұд»·вҖқжҲ–вҖңзҰ»еӯҗвҖқ)еҢ–еҗҲзү©гҖӮ пјҲ5пјүиЎЁзӨәв‘ дёҺв‘Ұзҡ„еҢ–еҗҲзү©зҡ„з”өеӯҗејҸВ В В В В В В В В В В В В В В В В В В В В В В пјҢиҜҘеҢ–еҗҲзү©жҳҜз”ұВ В В В В В В В пјҲеЎ«вҖңжһҒжҖ§вҖқвҖңйқһжһҒжҖ§вҖқдёӢеҗҢпјүй”®еҪўжҲҗзҡ„гҖӮ
|
|||||||||||||||||||||||||||||||||||||
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
ж №жҚ®еҺҹеӯҗз»“жһ„е’Ңе…ғзҙ е‘ЁжңҹеҫӢпјҢеӣһзӯ”пјҡ116еҸ·е…ғзҙ еӨ„дәҺе‘Ёжңҹ表第______е‘ЁжңҹпјҢ第______ж—ҸпјӣеҺҹеӯҗж ёеӨ–жңү_______дёӘз”өеӯҗеұӮпјҢжңҖеӨ–еұӮжңү_______дёӘз”өеӯҗпјӣе®ғжҳҜ_________пјҲеЎ«йҮ‘еұһжҲ–йқһйҮ‘еұһпјүе…ғзҙ гҖӮ
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁж°ҙжә¶ж¶Ідёӯ,YO3-дёҺS2-еҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә:YO3-+3S2-+6H+=Y-+3SвҶ“+3H2O.иҜ·еӣһзӯ”: (1)жӯӨеҸҚеә”дёӯ,_______еҸ‘з”ҹж°§еҢ–еҸҚеә”,ж°§еҢ–еүӮжҳҜ_______гҖӮ (2)YO3-дёӯYзҡ„еҢ–еҗҲд»·жҳҜ_______гҖӮ (3)Yе…ғзҙ еҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°жҳҜ_______пјҢе®ғеҸҜиғҪеӨ„дәҺ第_______ж—ҸгҖӮ
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҲ1пјүеҶҷеҮәе…ғзҙ з¬ҰеҸ·пјҡA_________пјӣB______пјӣC_________гҖӮ пјҲ2пјүCзҡ„еҺҹеӯҗз»“жһ„зӨәж„Ҹеӣҫпјҡ__________пјӣBзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©зҡ„еҢ–еӯҰејҸдёә_________гҖӮ пјҲ3пјүAзҡ„ж°ўеҢ–зү©зҡ„ж°ҙжә¶ж¶Іжҳҫ______пјҲеЎ«й…ёжҲ–зўұпјүжҖ§гҖӮ
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
AгҖҒBгҖҒCгҖҒDеӣӣз§Қе…ғзҙ пјҢAе…ғзҙ жүҖеӨ„зҡ„е‘Ёжңҹж•°гҖҒдё»ж—ҸеәҸж•°гҖҒеҺҹеӯҗеәҸж•°еқҮзӣёзӯүпјӣBзҡ„еҺҹеӯҗеҚҠеҫ„жҳҜе…¶жүҖеңЁдё»ж—ҸдёӯжңҖе°Ҹзҡ„пјҢBзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©зҡ„еҢ–еӯҰејҸдёәHBO3пјӣCе…ғзҙ еҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°жҜ”ж¬ЎеӨ–еұӮе°‘2дёӘпјӣCзҡ„йҳҙзҰ»еӯҗдёҺDзҡ„йҳізҰ»еӯҗе…·жңүзӣёеҗҢзҡ„з”өеӯҗжҺ’еёғпјҢдёӨе…ғзҙ еҸҜеҪўжҲҗеҢ–еҗҲзү©D2CпјҺ (1)Bе…ғзҙ зҡ„еҗҚз§°________пјӣBеңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®з¬¬______е‘ЁжңҹпјҢ第______ж—Ҹпјӣ (2)AгҖҒBеҪўжҲҗзҡ„еҢ–еҗҲзү©зҡ„з”өеӯҗејҸВ В В В В В В В В В В В В В В В В В В В В В В пјӣ (3)Cзҡ„е…ғзҙ з¬ҰеҸ·________пјҢCзҡ„жңҖй«ҳд»·ж°§еҢ–зү©зҡ„еҢ–еӯҰејҸВ В В В В В В В В В В В В В пјӣ (4) Dзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©зҡ„еҢ–еӯҰејҸ________пјҺ
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
AгҖҒBгҖҒCгҖҒDгҖҒEгҖҒFжҳҜеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§зҡ„зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ пјҢAгҖҒEеңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯзҡ„зӣёеҜ№дҪҚзҪ®еҰӮеӣҫжүҖзӨәпјҢAдёҺж°§е…ғзҙ иғҪеҪўжҲҗдёӨз§Қж— иүІж°”дҪ“пјҢCжҳҜең°еЈідёӯеҗ«йҮҸжңҖеӨҡзҡ„е…ғзҙ пјҢDжҳҜең°еЈідёӯеҗ«йҮҸжңҖеӨҡзҡ„йҮ‘еұһе…ғзҙ гҖӮ
(1)CеңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®дёә________пјҢе…¶з®ҖеҚ•зҰ»еӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫдёә________________гҖӮ (2)AE2зҡ„еҲҶеӯҗејҸдёә__________гҖӮ (3)CгҖҒDгҖҒEгҖҒFзҡ„зҰ»еӯҗеҚҠеҫ„з”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜ___________(еЎ«зҰ»еӯҗз¬ҰеҸ·)гҖӮ (4)е®һйӘҢе®ӨеҲ¶еҸ–Fзҡ„еҚ•иҙЁж°”дҪ“зҡ„зҰ»еӯҗж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ (5)еңЁеҫ®з”өеӯҗе·ҘдёҡдёӯпјҢBзҡ„з®ҖеҚ•ж°”жҖҒж°ўеҢ–зү©зҡ„ж°ҙжә¶ж¶ІеҸҜдҪңеҲ»иҡҖеүӮH2O2зҡ„жё…йҷӨеүӮпјҢжүҖеҸ‘з”ҹеҸҚеә”зҡ„дә§зү©дёҚжұЎжҹ“зҺҜеўғпјҢе…¶еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
|
- 2018-2019е№ҙй«ҳдёҖдёҠеҶҢжңҹжң«иҖғиҜ•еҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·пјҲз”ҳиӮғзңҒжӯҰеЁҒ第еҚҒе…«дёӯеӯҰпјү
- 2018иҮі2019е№ҙй«ҳдәҢдёӢеҚҠе№ҙ第дәҢж¬ЎжңҲиҖғеҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲйқ’жө·зңҒжө·дёңеёӮ第дәҢдёӯеӯҰпјү
- е®ЈеҹҺеёӮй«ҳдәҢеҢ–еӯҰ2019е№ҙеҗҺеҚҠжңҹжңҹжң«иҖғиҜ•еңЁзәҝзӯ”йўҳ
- йҳңйҳіеёӮй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·иҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- зӣҳй”ҰеёӮ2019е№ҙй«ҳдәҢеҢ–еӯҰдёӢеӯҰжңҹжңҲиҖғжөӢйӘҢе…Қиҙ№жЈҖжөӢиҜ•еҚ·
- еҗүжһ—жқҫеҺҹеёӮ油田第еҚҒдёҖдёӯеӯҰ2021еұҠй«ҳдёү第дәҢж¬Ўйҳ¶ж®өиҖғиҜ•еҢ–еӯҰйўҳе…Қиҙ№еңЁзәҝжЈҖжөӢ
- иҺҶз”°еёӮй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•еңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ
- еҚ—жҳҢеёӮй«ҳдёүеҢ–еӯҰ2019е№ҙдёӢжңҹй«ҳиҖғжЁЎжӢҹеёҰеҸӮиҖғзӯ”жЎҲдёҺи§Јжһҗ