2018高三上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列物质中,既能导电又属于强电解质的一组物质是( ) A.石墨、食醋 B.液氨、石灰水 C.熔融MgCl2、熔融NaOH D.稀硫酸、蔗糖
|
|
| 2. | 详细信息 |
|
下列说法正确的是( ) A.含有相同氧原子数的SO2和CO的质量相等 B.等物质的量浓度的NaOH溶液与氨水中的c(OH-)相等 C.等物质的量的乙酸与甲酸甲酯中的共价键数相等 D.等温等压下,3 mol C2H2(g)与1 mol C6H6(g)的密度相等
|
|
| 3. | 详细信息 |
|
阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是( ) A.1.0 L 1 mol·L-1氨水中,NH3·H2O的分子数为6.02×1023 B.当有7.1 g Cl2和水完全反应时转移的电子数为0.1×6.02×1023 C.白磷分子(P4)呈正四面体结构,31 g白磷中含有P—P键个数为6×6.02×1023 D.20 g重水(2H
|
|
| 4. | 详细信息 |
|
NA表示阿伏加德罗常数,下列判断正确的是( ) A.标准状况下,22.4 L CCl4中含有氯原子数目为4NA B.0.05 mol硫酸氢钠晶体中含离子总数为0.15NA C.常温下,16 g O2与O3的混合气体中含氧原子数为NA D.一定条件下,2 mol二氧化硫和1 mol氧气混合,反应时转移的电子数为4NA
|
|
| 5. | 详细信息 |
|
设NA表示阿伏加德罗常数,下列说法错误的是( ) A.一定量的Fe与含1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA B.1 L 1 mol/L的FeCl3溶液中含有NA个Fe3+ C.常温常压下,等质量的SO2、S2含有相同的分子数 D.125 g CuSO4·5H2O晶体中含有0.5NA个Cu2+
|
|
| 6. | 详细信息 | |||||||||||||||
|
分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法。下列各组物质分类中不合理的是( )
|
||||||||||||||||
| 7. | 详细信息 | ||||||||||||||||||||||||||||||
|
下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的顺序组合正确的是( )
|
|||||||||||||||||||||||||||||||
| 8. | 详细信息 |
|
以Al、CuO、CuCl2溶液、盐酸、氢氧化钾溶液为反应物,常温下两两间可发生的反应有 A.6个 B.5个 C.4个 D.3个
|
|
| 9. | 详细信息 |
|
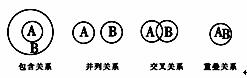
化学概念在逻辑上存在如下关系:
对下列概念的说法正确的是( ) A.化合物与电解质属于重叠关系 B.化合物与碱性氧化物属于交叉关系 C.溶液与胶体属于并列关系 D.氧化还原反应与放热反应属于包含关系
|
|
| 10. | 详细信息 |
|
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞 菁”分子的说法中正确的是( ) A.在水中所形成的分散系属悬浊液 B.“钴酞菁”分子既能透过滤纸,也能透过半透膜 C.分子直径比Na+小 D.在水中形成的分散系能产生丁达尔现象
|
|
| 11. | 详细信息 |
|
某同学欲配制符合下列条件的溶液,其中可能实现的是( ) A.只含0.1 mol Na+、0.2 mol Mg2+、0.1 mol Cl-和0.1 mol NO B.只含0.1 mol NH C.为了通过测定pH的大小,达到比较HCl和CH3COOH酸性强弱的目的,分别配制100 mL 0.1 mol/L的NaCl溶液和CH3COONa溶液 D.仅用1 000 mL的容量瓶、烧杯、玻璃棒、量筒、58.5 g NaCl固体和水配制1 L 1 mol/L的NaCl溶液
|
|
| 12. | 详细信息 |
|
36.5 g HCl溶解在1 L水中(水的密度近似为1 g/cm3),所得溶液的密度为ρg/cm3,质量分数为ω,物质的量浓度为c mol/L,NA表示阿伏加德罗常数,则下列叙述中正确的是( ) A.所得溶液的物质的量浓度:c=1 mol/L B.所得溶液中含有NA个HCl分子 C.36.5 g HCl气体占有的体积为22.4 L D.所得溶液的质量分数:ω=36.5 c/1 000ρ
|
|
| 13. | 详细信息 |
|
下列条件中,两种气体所含原子数一定相等的是( ) A.同质量、不同密度的N2和CO B.同温度、同体积的H2和N2 C.同体积、同密度的C2H6和NO D.同压强、同体积的N2O和CO2
|
|
| 14. | 详细信息 |
|
下列叙述中正确的是( ) A.有单质生成的反应一定是氧化还原反应 B.非金属的最高价含氧酸都具有强氧化性 C.两种不同的阴离子在溶液中一定能大量共存 D.同种物质中的同种元素在反应中可能既被氧化又被还原
|
|
| 15. | 详细信息 |
|
R2O A.1 B.2 C.3 D.4
|
|
| 16. | 详细信息 |
|
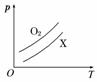
如图表示1 g O2与1 g X气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )
A.C2H4 B.CH4 C.CO2 D.NO
|
|
| 17. | 详细信息 |
|
某溶液中(假定不考虑水解因素)仅含有K+、Mg2+、SO Mg2+的 个数之比为4∶5,则NO A.8∶3 B.3∶2 C.1∶3 D.2∶3
|
|
| 18. | 详细信息 |
|
在一种酸性溶液中,可能存在NO A.一定有碘离子 B.可能含铁离子 C.可能有氯离子 D.不含硝酸根离子
|
|
| 19. | 详细信息 |
|
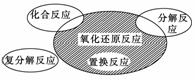
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是
A.Cl2+2KBr===Br2+2KCl B.2NaHCO3 C.4Fe(OH)2+O2+2H2O===4Fe(OH)3 D.2Na2O2+2CO2===2Na2CO3+O2
|
|
| 20. | 详细信息 |
|
已知:2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O;Cl2+2FeCl2===2FeCl3; 2KI+2FeCl3===2KCl+I2+2FeCl2。则下列判断正确的是( ) A.氧化性:MnO B.还原性:Fe2+>I->Cl- C.Fe3+只有氧化性,Fe2+只有还原性 D.FeCl3能使湿润的淀粉碘化钾试纸变蓝
|
|
| 21. | 详细信息 |
|
对下列反应:①NH4HCO3溶液与石灰水反应、②K2SO3溶液与稀盐酸反应,③Si与烧碱溶液反应、④Fe与稀硝酸反应,改变反应物用量,不能用同一个离子方程式表示的是( ) A.①②③ B.①②④ C.①③④ D.②③④
|
|
| 22. | 详细信息 |
|
.有人欲配制含有下列四种离子的溶液,其中能配制成功的是( ) A.Ca2+、H+、Cl-、HCO C.Na+、H+、NO
|
|
| 23. | 详细信息 |
|
下列离子组一定能大量共存的是( ) A.甲基橙呈黄色的溶液中:I-、Cl-、NO B.石蕊呈蓝色的溶液中:Na+、AlO C.含大量Al3+的溶液中:K+、Na+、NO D.含大量OH-的溶液中:CO
|
|
| 24. | 详细信息 |
|
.下列离子方程式表达正确的是( ) A.SO2通入溴水中:SO2+2H2O+Br2===2H++SO B.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++2OH-+2H++SO C.漂白粉溶液在空气中失效:ClO-+CO2+H2O===HClO+HCO D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+===Fe3++3H2O
|
|
| 25. | 详细信息 |
|
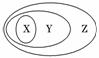
用下图表示的一些物质或概念间的从属关系中不正确的是( )
X Y Z A. 氧化物 化合物 纯净物 B. 胶体 分散系 混合物 C. 金属氧化物 碱性氧化物 氧化物 D. 离子化合物 电解质 化合物
|
|
| 26. | 详细信息 |
|
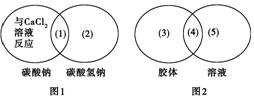
下图是一种用于显示事物异同点的信息处理方法。图1中两个圆分别代表碳酸钠和碳酸氢钠的有关信息,两圆重叠区域表示它们的共同特点(相似点),重叠区域以外的部分表示它们独有的特征(不同点)。请你在图下的空格内填写适当内容。(每处只要求填一点)
(1)________;(2)________;(3)______ __; (4)________;(5)________。
|
|
| 27. | 详细信息 |
|
有一瓶澄清的溶液,其中可能含有H+、NH (1)取pH试纸检验,溶液呈酸性,可以排除____________的存在。 (2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红色,可以排除____________的存在。 (3)另取出部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,反应过程中均无沉淀产生,则又可排除_____________的存在。 (4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,证明有________的存在,又可以排除________的存在。 (5)根据上述实验事实可以确定,该溶液中肯定存在的离子是___________________,还不能确定是否存在的离子是________。
|
|
| 28. | 详细信息 |
|
.已知A和B两支试管所盛的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、NO (1)试管A的溶液中所含上述离子共有________种。 (2)若向某试管中滴入稀盐酸产生沉淀,则该试管为______(填“A”或“B”)。 (3)若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是__________(填化学式)。 (4)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为___________________________________、_________________。 (5)若试管A和试管B中的溶液是由等物质的量的四种物质配成的溶液,将两试管中溶液混合后过滤,所得滤液中各种离子的物质的量之比为________。 (6)若向由试管A溶液中的阳离子组成的碳酸氢盐溶液中,滴入少量Ba(OH)2溶液,则发生反应的离子方程式为________________
|
|
| 29. | 详细信息 |
|
某同学称取了4.0 gNaOH固体,欲配制100 mL溶液。回答下列问题: (1)该实验中,用到的能确定体积的两种玻璃仪器是________、________。 (2)操作过程中多次用到玻璃棒,其在实验中的作用有_____。 (3)不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响(填“偏大”、“偏小”或“不变”): ①在溶解过程中有少量液体溅出烧杯外________; ②定容时仰视仪器上的刻度线________; ③定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线________。 (4)最后所得的溶液应存放在试剂瓶中,并贴上标签,请你填写该标签(如图)。
|
|
| 30. | 详细信息 |
|
.2011年4月27日某市工商局查获400克袋装中老年补钙营养奶粉1 401包。这种奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO+I2+2NaI+2H2O。 (1)上述反应中氧化剂是________,若有0.75 mol的还原剂被氧化,则被还原的氧化剂有________ mol。 (2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有①自来水;②淀粉碘化钾试纸;③淀粉;④白糖;⑤食醋;⑥白酒。进行实验时,必须选用的物质有__________。 (3)某厂废切削液中,含2%~5%的NaNO2,直接排放会造成污染,下列试剂中________(填序号)能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为 ________________________________________________________________________ (并标出电子转移的数目和方向)。 ①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
|
|