2018й«ҳдәҢдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”ж—ўжҳҜж°§еҢ–иҝҳеҺҹеҸҚеә”пјҢеҸҲжҳҜеҗёзғӯеҸҚеә”зҡ„жҳҜ(гҖҖгҖҖ) AпјҺй“қзүҮдёҺзЁҖH2SO4еҸҚеә”В В В В В В В В В В В В В В В BпјҺBa(OH)2В·8H2OдёҺNH4ClеҸҚеә” CпјҺзҒјзғӯзҡ„зӮӯдёҺCO2еҸҚеә”В В В В В В В В В В В В В В DпјҺз”Ізғ·еңЁO2дёӯзҡ„зҮғзғ§еҸҚеә”
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В ) A.еҸҚеә”зғӯжҢҮзҡ„жҳҜеҸҚеә”иҝҮзЁӢдёӯж”ҫеҮәзҡ„зғӯйҮҸ B.зғӯеҢ–еӯҰж–№зЁӢејҸзҡ„еҢ–еӯҰи®ЎйҮҸзі»ж•°еҸҜиЎЁзӨәеҲҶеӯҗзҡ„дёӘж•° C.зғӯеҢ–еӯҰж–№зЁӢејҸзҡ„еҢ–еӯҰи®ЎйҮҸзі»ж•°еҸӘиғҪдёәж•ҙж•° D.жүҖжңүзҡ„еҢ–еӯҰеҸҚеә”еқҮдјҙйҡҸиғҪйҮҸеҸҳеҢ–
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
зҒ°й”Ў(д»ҘзІүжң«зҠ¶еӯҳеңЁ)е’ҢзҷҪй”ЎжҳҜй”Ўзҡ„дёӨз§ҚеҗҢзҙ ејӮеҪўдҪ“гҖӮе·ІзҹҘпјҡ в‘ Sn(sпјҢзҷҪ)пјӢ2HCl(aq)===SnCl2(aq)пјӢH2(g)гҖҖО”H1
в‘ўSn(sпјҢзҒ°)В В В В В В Sn(sпјҢзҷҪ)гҖҖО”H3пјқпјӢ2.1 kJВ·molпјҚ1 дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺО”H1>О”H2В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В BпјҺй”ЎеңЁеёёжё©дёӢд»ҘзҒ°й”ЎзҠ¶жҖҒеӯҳеңЁ CпјҺзҒ°й”ЎиҪ¬еҢ–дёәзҷҪй”Ўзҡ„еҸҚеә”жҳҜж”ҫзғӯеҸҚеә” DпјҺй”ЎеҲ¶еҷЁзҡҝй•ҝжңҹеӨ„еңЁдҪҺдәҺ13.2 в„ғзҡ„зҺҜеўғдёӯпјҢдјҡиҮӘиЎҢжҜҒеқҸ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘпјҡв‘ 101 kPaж—¶пјҢ2C(s)пјӢO2(g)===2CO(g)гҖҖО”HпјқпјҚ221 kJ/mol в‘ЎзЁҖжә¶ж¶ІдёӯпјҢHпјӢ(aq)пјӢOHпјҚ(aq)===H2O(l)гҖҖО”HпјқпјҚ57.3 kJ/mol дёӢеҲ—з»“и®әжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺзўізҡ„зҮғзғ§зғӯеӨ§дәҺ110.5 kJ/mol BпјҺв‘ зҡ„еҸҚеә”зғӯдёә 221 kJ CпјҺзЁҖзЎ«й…ёдёҺзЁҖNaOHжә¶ж¶ІеҸҚеә”зҡ„дёӯе’ҢзғӯдёәпјҚ57.3 kJ/mol DпјҺжө“зЎ«й…ёдёҺзЁҖNaOHжә¶ж¶ІеҸҚеә”з”ҹжҲҗ1 molж°ҙпјҢж”ҫеҮә57.3 kJзғӯйҮҸ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘ1 gж°ўж°”е®Ңе…ЁзҮғзғ§з”ҹжҲҗж°ҙи’ёж°”ж—¶ж”ҫеҮәзғӯйҮҸ121 kJпјҢдё”ж°§ж°”дёӯ1 mol O===Oй”®е®Ңе…Ёж–ӯиЈӮж—¶еҗёж”¶зғӯйҮҸ496 kJпјҢж°ҙи’ёж°”дёӯ1 mol HвҖ”Oй”®еҪўжҲҗж—¶ж”ҫеҮәзғӯйҮҸ463 kJпјҢеҲҷж°ўж°”дёӯ1 mol HвҖ”Hй”®ж–ӯиЈӮж—¶еҗёж”¶зғӯйҮҸдёә(гҖҖгҖҖ) AпјҺ920 kJВ В В В В В В В В В В В В В В В В В В В В В В В BпјҺ557 kJ CпјҺ436 kJВ В В В В В В В В В В В В В В В В В В В В В В В DпјҺ188 kJ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘ298 Kж—¶еҗҲжҲҗж°ЁеҸҚеә”пјҢN2(g)пјӢ3H2(g) AпјҺдёҖе®ҡе°ҸдәҺ92.0 kJВ В В В В В В В В В В В В В В BпјҺдёҖе®ҡеӨ§дәҺ92.0 kJ CпјҺдёҖе®ҡзӯүдәҺ92.0 kJВ В В В В В В В В В В В В В В DпјҺж— жі•зЎ®е®ҡ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
25в„ғгҖҒ101 kPaж—¶,дёӯе’ҢзғӯдёәО”H=пјҚ57.3 kJВ·molпјҚ1,иҫӣзғ·зҡ„зҮғзғ§зғӯдёә5 518 kJВ·molпјҚ1гҖӮдёӢеҲ—зғӯеҢ–еӯҰж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜ(В В ) A.2H+(aq)+ SO42пјҚ(aq)+Ba2+(aq)+2OHпјҚ==BaSO4(s)+2H2O(l) О”H=пјҚ114.6 kJВ·molпјҚ1 B.2KOH(aq)+H2SO4(aq) ==K2SO4(aq)+2H2O(l) О”H=пјҚ114.6 kJВ·molпјҚ1 C.C8H18(l)+25/2O2(g) ==8CO2(g)+9H2O(g)В О”H=пјҚ5 518 kJВ·molпјҚ1 D.2C8H18(l)+25O2(g) ==16CO2(g)+18H2O(l)В О”H=пјҚ5 518 kJВ·molпјҚ1[.
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
д»ҠжңүеҰӮдёӢдёүдёӘзғӯеҢ–еӯҰж–№зЁӢејҸпјҡ H2(g)+1/2O2(g)== H2O(g)В О”H=a kJВ·molпјҚ1 H2(g)+1/2O2(g)== H2O(l)В О”H=b kJВ·molпјҚ1 2H2(g)+O2(g)== 2H2O(l)В О”H=c kJВ·molпјҚ1 е…ідәҺе®ғ们зҡ„дёӢеҲ—иЎЁиҝ°жӯЈзЎ®зҡ„жҳҜ(В В В ) AпјҺ2b=cВ В В В В В В В В В В В В В В В В В В В B.aгҖҒbе’ҢcеқҮдёәжӯЈеҖј C.a=bВ В В В В В В В В В В В В В В В В В В В В В D. е®ғ们йғҪжҳҜеҗёзғӯеҸҚеә”
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–е·Ҙз”ҹдә§дёӯеёёз”Ёзҡ„COе’ҢH2пјҢеҸҜйҖҡиҝҮзғғдёҺж°ҙи’ёж°”еҸҚеә”еҫ—еҲ°гҖӮе…¶дёӯз”Ізғ·еҸҜеҸ‘з”ҹд»ҘдёӢдёӨдёӘеҸҚеә”пјҡв‘ CH4(g)+ 1/2O2(g) в‘ЎCH4(g)+H2O(g) дёӢеҲ—зғӯеҢ–еӯҰж–№зЁӢејҸдёӯпјҢеҸҚеә”зғӯдёәйӣ¶зҡ„жҳҜ (В В В ) A.4CH4(g)+O2(g)+2H2O(g) B.7CH4(g)+3O2(g)+H2O(g) C.3CH4(g)+O2(g)+H2O(g) D.5CH4(g)+2O2(g)+H2O(g)
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁ2AпјӢB AпјҺП…(A)пјқ 0.5 mol/(LВ·пҪ“)В В В В В В BпјҺП…(B)пјқ 0.3 mol/(LВ·пҪ“) CпјҺП…(C)пјқ 0.8 mol/(LВ·пҪ“) В В В В В В DпјҺП…(D)пјқ 1 mol/(LВ·пҪ“)
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁ2Lзҡ„еҜҶй—ӯе®№еҷЁдёӯ,еҸ‘з”ҹд»ҘдёӢеҸҚеә”:2A(g)+ B(g) A. 1.6 molВ В В В В В В В В B. 2.8 molВ В В В В В В В В В C. 2.4 molВ В В В В В В D. 1.2 mol
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁеҜҶй—ӯе®№дёӯеҸ‘з”ҹдёӢеҲ—еҸҚеә”aA(g) AпјҺAзҡ„иҪ¬еҢ–зҺҮеҸҳеӨ§В В В В В В В В В В В В В В В В В В В В В В BпјҺе№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁ CпјҺDзҡ„дҪ“з§ҜеҲҶж•°еҸҳеӨ§В В В В В В В В В В В В В В В В В В В В DпјҺa пјң cпјӢd
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁжҒ’жё©гҖҒжҒ’е®№зҡ„е®№еҷЁдёӯиҝӣиЎҢеҸҚеә”пјҡ2X(g) AпјҺзӯүдәҺ10sВ В В В В В В В В В В В В В В В В В В В В В В BпјҺеӨ§дәҺ10s CпјҺе°ҸдәҺ10sВ В В В В В В В В В В В В В В В В В В В В В В DпјҺзӯүдәҺ8s
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
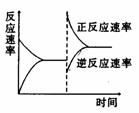
е·ІзҹҘеҸҚеә”A2(g)+2B2(g) AпјҺеҚҮй«ҳжё©еәҰжңүеҲ©дәҺеҸҚеә”йҖҹзҺҮеўһеҠ пјҢд»ҺиҖҢзј©зҹӯиҫҫеҲ°е№іиЎЎзҡ„ж—¶й—ҙ BпјҺеҚҮй«ҳжё©еәҰпјҢжӯЈеҗ‘еҸҚеә”йҖҹзҺҮеўһеҠ пјҢйҖҶеҗ‘еҸҚеә”йҖҹзҺҮеҮҸе°Ҹ CпјҺиҫҫеҲ°е№іиЎЎеҗҺпјҢеҚҮй«ҳжё©еәҰжҲ–еўһеӨ§еҺӢејәйғҪжңүеҲ©дәҺиҜҘеҸҚеә”е№іиЎЎжӯЈеҗ‘移еҠЁ DпјҺиҫҫеҲ°е№іиЎЎеҗҺпјҢйҷҚдҪҺжё©еәҰжҲ–еҮҸе°ҸеҺӢејәйғҪжңүеҲ©дәҺиҜҘеҸҚеә”е№іиЎЎжӯЈеҗ‘移еҠЁ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©еёёеҺӢдёӢпјҢеңЁеёҰжңүзӣёеҗҢиҙЁйҮҸжҙ»еЎһзҡ„е®№з§Ҝзӣёзӯүзҡ„з”ІгҖҒд№ҷдёӨе®№еҷЁйҮҢпјҢеҲҶеҲ«е……жңүдәҢж°§еҢ–ж°®е’Ңз©әж°”пјҢзҺ°еҲҶеҲ«иҝӣиЎҢдёӢеҲ—дёӨдёҠе®һйӘҢпјҡ (N2O4 (a)е°ҶдёӨе®№еҷЁзҪ®дәҺжІёж°ҙдёӯеҠ зғӯ[] (b)еңЁжҙ»еЎһдёҠйғҪеҠ 2 kgзҡ„з қз Ғ еңЁд»ҘдёҠдёӨжғ…еҶөдёӢпјҢз”Іе’Ңд№ҷе®№еҷЁзҡ„дҪ“з§ҜеӨ§е°Ҹзҡ„жҜ”иҫғпјҢжӯЈзЎ®зҡ„жҳҜ(В В )В В AпјҺ(a)з”Іпјһд№ҷпјҢ(b)з”Іпјһд№ҷ В В В В В В В В В В В В В В В BпјҺ(a)з”Іпјһд№ҷпјҢ(b)з”Іпјқд№ҷ CпјҺ(a)з”Іпјңд№ҷпјҢ(b)з”Іпјһд№ҷВ В В В В В В В В В В В В В В DпјҺ(a)з”Іпјһд№ҷпјҢ(b)з”Іпјңд№ҷ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иғҪз”ЁеӢ’жІҷзү№еҲ—еҺҹзҗҶи§ЈйҮҠзҡ„жҳҜпјҲВ В пјүВ В AпјҺеҜ№дәҺ2HI(g) BпјҺжЈ•зәўиүІNO2еҠ еҺӢеҗҺйўңиүІе…ҲеҸҳж·ұеҗҺеҸҳжө… CпјҺSO2еӮ¬еҢ–ж°§еҢ–жҲҗSO3зҡ„еҸҚеә”пјҢеҫҖеҫҖйңҖиҰҒдҪҝз”ЁеӮ¬еҢ–еүӮ DпјҺеҜ№дәҺеҸҚеә”N2(g)пјӢ3H2(g)
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
еҸҚеә”пјҡL(s)пјӢaG(g) AпјҺдёҠиҝ°еҸҚеә”жҳҜж”ҫзғӯеҸҚеә”В В В BпјҺдёҠиҝ°еҸҚеә”жҳҜеҗёзғӯеҸҚеә”В В В пјЈпјҺaпјһbВ В В В В В В В В В В В В В В В В DпјҺж— жі•зЎ®е®ҡaгҖҒbзҡ„еӨ§е°Ҹ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘеҸҚеә”mX(g)пјӢnY(g) AпјҺXзҡ„жӯЈеҸҚеә”йҖҹзҺҮжҳҜYзҡ„йҖҶеҸҚеә”йҖҹзҺҮзҡ„m/nеҖҚ BпјҺйҖҡе…ҘзЁҖжңүж°”дҪ“дҪҝеҺӢејәеўһеӨ§пјҢе№іиЎЎе°ҶжӯЈеҗ‘移еҠЁ CпјҺйҷҚдҪҺжё©еәҰпјҢж··еҗҲж°”дҪ“зҡ„е№іеқҮзӣёеҜ№еҲҶеӯҗиҙЁйҮҸеҸҳе°Ҹ DпјҺиӢҘе№іиЎЎж—¶XгҖҒYзҡ„иҪ¬еҢ–зҺҮзӣёзӯүпјҢиҜҙжҳҺеҸҚеә”ејҖе§Ӣж—¶XгҖҒYзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёәn:m
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
еҜ№жҹҗдёҖеҸҜйҖҶеҸҚеә”жқҘиҜҙ,дҪҝз”ЁеӮ¬еҢ–еүӮзҡ„дҪңз”ЁжҳҜ(В В В ) В В В AпјҺжҸҗй«ҳеҸҚеә”зү©зҡ„е№іиЎЎиҪ¬еҢ–зҺҮВ В В В В В В В В В В BпјҺеҗҢзӯүзЁӢеәҰж”№еҸҳжӯЈйҖҶеҸҚеә”зҡ„йҖҹзҺҮ В В В CпјҺеўһеӨ§жӯЈеҸҚеә”йҖҹзҺҮпјҢеҮҸе°ҸйҖҶеҸҚеә”йҖҹзҺҮ В В В DпјҺж”№еҸҳе№іиЎЎж··еҗҲзү©зҡ„з»„жҲҗ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
В еҸіеӣҫжҳҜе…ідәҺеҸҚеә”A2(g)+3B2(g) В В В AпјҺеҚҮй«ҳжё©еәҰпјҢеҗҢж—¶еҠ еҺӢ В В В В В В В В В В В В В BпјҺйҷҚдҪҺжё©еәҰпјҢеҗҢж—¶еҮҸеҺӢ В В В CпјҺеўһеӨ§еҸҚеә”зү©жө“еәҰпјҢеҗҢж—¶еҮҸе°Ҹз”ҹжҲҗзү©жө“еәҰ В В В DпјҺеўһеӨ§еҸҚеә”зү©жө“еәҰпјҢеҗҢж—¶дҪҝз”ЁеӮ¬еҢ–еүӮ
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёҖеҜҶй—ӯе®№з§Ҝзҡ„е®№еҷЁдёӯиҝӣиЎҢеҸҚеә”пјҡ2SO2(g)+O2(g) A. SO2дёә0.4 molвҖўLпјҚ1пјҢO2дёә0.2 molвҖўLпјҚ1В В В В B. SO2дёә0.25 molвҖўLпјҚ1 C. SO2гҖҒSO3еқҮдёә0.15 molвҖўLпјҚ1В В В В В В В В В В В В D. SO3дёә0.4 molвҖўLпјҚ1
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
XгҖҒYгҖҒZдёүз§Қж°”дҪ“пјҢеҸ–Xе’ҢYжҢү1:1зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”ж··еҗҲпјҢж”ҫе…ҘеҜҶй—ӯе®№еҷЁдёӯеҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡX+2Y A. 33%В В В В В В В В В В В В В B. 40%В В В В В В В В В C. 50%В В В В В В В В В D. 66%[]
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗжё©еәҰдёӢпјҢеҸҚеә”SO2(g)+ 1/2O2(g) A. 2500В В В В В В В В В В B. 100В В В В В В В В В В C. 4Г—10пјҚ4 В В В В В В В В D. 2Г—10пјҚ2
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
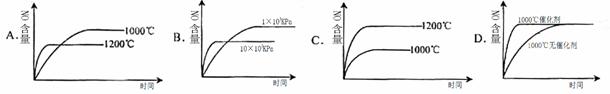
е·ІзҹҘпјҡ4NH3(g)+5O2(g) == 4NO(g)+6H2O(g)В в–іH=пјҚ1025kJ/molпјҢиҜҘеҸҚеә”жҳҜдёҖдёӘеҸҜйҖҶеҸҚеә”гҖӮиӢҘеҸҚеә”зү©иө·е§Ӣзү©иҙЁзҡ„йҮҸзӣёеҗҢпјҢдёӢеҲ—е…ідәҺиҜҘеҸҚеә”зҡ„зӨәж„ҸеӣҫдёҚжӯЈзЎ®зҡ„жҳҜ( В В В )
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
298KдёӢпјҢе°Ҷ1molNaClжә¶и§ЈеңЁ1Lж°ҙдёӯпјҢжӯӨжә¶и§ЈиҝҮзЁӢдёӯдҪ“зі»зҡ„вҲҶG = вҲҶHпјҚTвҲҶSе’ҢвҲҶSзҡ„еҸҳеҢ–жғ…еҶөжҳҜ(В В В В ) A. вҲҶG>0пјҢвҲҶS<0В В В В В В В В В В В В В В В В В В В В В B. вҲҶG<0пјҢвҲҶS>0В В В В C. вҲҶG>0пјҢвҲҶS>0В В В В В В В В В В В В В В В В В В В В В D. вҲҶG<0пјҢвҲҶS<0
|
|
| 26. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ( В В В ) A. ејәз”өи§ЈиҙЁжә¶ж¶Ізҡ„еҜјз”өиғҪеҠӣдёҖе®ҡжҜ”ејұз”өи§ЈиҙЁжә¶ж¶Ізҡ„ејә B. ж°Ёж°”жҳҜејұз”өи§ЈиҙЁпјҢй“ңжҳҜејәз”өи§ЈиҙЁ C.зЎ«й…ёй’ЎжҳҜејәз”өи§ЈиҙЁпјҢйҶӢй…ёжҳҜејұз”өи§ЈиҙЁ D.зӣёеҗҢжё©еәҰдёӢпјҢжө“еәҰеқҮдёә0.1 molвҖўLпјҚ1зҡ„NH4Clжә¶ж¶Іе’Ңж°Ёж°ҙпјҢNH4+зҡ„жө“еәҰдёҖж ·еӨ§
|
|
| 27. | иҜҰз»ҶдҝЎжҒҜ |
|
В жңүзӯүдҪ“з§ҜгҖҒзӯүжө“еәҰзҡ„зӣҗй…ёгҖҒзЎ«й…ёгҖҒйҶӢй…ёдёүз§Қжә¶ж¶ІпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ В пјү A.дёүз§Қй…ёжә¶ж¶Ідёӯc(H+) зӣёеҗҢ B. дёҺNaOHжә¶ж¶Із”ҹжҲҗжӯЈзӣҗж—¶пјҢж¶ҲиҖ—NaOHжә¶ж¶Ізҡ„дҪ“з§ҜзӣёеҗҢ C. дёҺеӨ§е°Ҹе’ҢиҙЁйҮҸзӣёеҗҢзҡ„й”ҢеҸҚеә”ж—¶дә§з”ҹж°ўж°”зҡ„йҖҹзҺҮзӣёеҗҢ D.дёҺи¶ійҮҸзҡ„й”ҢеҸҚеә”ж—¶пјҢзӣҗй…ёдёҺйҶӢй…ёдә§з”ҹж°ўж°”зҡ„дҪ“з§ҜзӣёеҗҢ
|
|
| 28. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜ( В В В В ) A. NaHSжә¶дәҺж°ҙ: NaHS пјқ Na+ + H+ + S2пјҚ B. Al(OH)3з”өзҰ»: H2O+AlO2пјҚ+H+пјқAl(OH)3пјқAl3++3OHпјҚ C. NaHSO4жә¶дәҺж°ҙпјҡNaHSO4пјқNa++ HSO4пјҚ D. HFжә¶дәҺж°ҙпјҡHF+H2O
|
|
| 29. | иҜҰз»ҶдҝЎжҒҜ |
|
В иҰҒдҪҝз”өзҰ»е№іиЎЎHA A. еҚҮй«ҳжә¶ж¶Іжё©еәҰВ В В В В В В В В В B. еҠ е…Ҙе°‘йҮҸNaOHеӣәдҪ“ C. еҠ ж°ҙзЁҖйҮҠВ В В В В В В В В В В В В В D. еҠ е…ҘHAжө“жә¶ж¶І
|
|
| 30. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁpHиҜ•зәёжөӢе®ҡжә¶ж¶ІpHзҡ„жӯЈзЎ®ж“ҚдҪңжҳҜ(гҖҖгҖҖ) A. е°ҶдёҖе°Ҹеқ—иҜ•зәёж”ҫеңЁиЎЁйқўзҡҝдёҠпјҢз”ЁзҺ»з’ғжЈ’иҳёеҸ–е°‘йҮҸеҫ…жөӢж¶ІзӮ№еңЁиҜ•зәёдёҠпјҢеҶҚдёҺж ҮеҮҶжҜ”иүІеҚЎеҜ№з…§ B. е°ҶдёҖе°Ҹеқ—иҜ•зәёз”Ёи’ёйҰҸж°ҙж¶Ұж№ҝеҗҺж”ҫеңЁиЎЁйқўзҡҝдёҠпјҢз”ЁзҺ»з’ғжЈ’иҳёеҸ–е°‘йҮҸеҫ…жөӢзӮ№еңЁиҜ•зәёдёҠпјҢеҶҚдёҺж ҮеҮҶжҜ”иүІеҚЎеҜ№з…§ C. е°ҶдёҖе°ҸжқЎиҜ•зәёеңЁеҫ…жөӢж¶ІдёӯиҳёдёҖдёӢпјҢеҸ–еҮәеҗҺж”ҫеңЁиЎЁйқўзҡҝдёҠпјҢдёҺж ҮеҮҶжҜ”иүІеҚЎеҜ№з…§ D. е°ҶдёҖе°ҸжқЎиҜ•зәёе…Ҳз”Ёи’ёйҰҸж°ҙж¶Ұж№ҝеҗҺпјҢеңЁеҫ…жөӢж¶ІдёӯиҳёдёҖдёӢпјҢеҸ–еҮәеҗҺдёҺж ҮеҮҶжҜ”иүІеҚЎеҜ№з…§
|
|
| 31. | иҜҰз»ҶдҝЎжҒҜ |
|
й…Қе№ідёӢеҲ—еҸҚеә”ж–№зЁӢејҸпјҡ пјҲ1пјүй…ёжҖ§KMnO4жә¶ж¶ІиғҪеҗҲH2C2O4пјҲиҚүй…ёпјүжә¶ж¶ІиӨӘиүІпјҢеҸҚеә”зҰ»еӯҗж–№зЁӢејҸдёәпјҡ В В В В В В В MnO4пјҚ + В В В В В H2C2O4 + В В В В В H+В =В В В В Mn2+ + В В В В В CO2вҶ‘+ В В В В В H2O пјҲ2пјүж·ҖзІүзўҳеҢ–й’ҫжә¶ж¶ІеңЁй…ёжҖ§зҺҜеўғдёӯиҝҮдёҖж®өж—¶й—ҙеҗҺдјҡиӨӘиүІпјҢеҸҚеә”зҰ»еӯҗж–№зЁӢејҸдёәпјҡ В В В В В В В IпјҚ + В В В В В O2 + В В В В В H+В = В В В В В I2В + В В В В В H2O
|
|
| 32. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
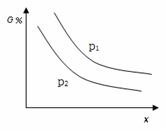
еңЁдёҖе®ҡдҪ“з§Ҝзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢиҝӣиЎҢеҰӮдёӢеҢ–еӯҰеҸҚеә”пјҡ CO2(g)пјӢH2(g) е…¶еҢ–еӯҰе№іиЎЎеёёж•°Kе’Ңжё©еәҰTзҡ„е…ізі»еҰӮдёӢиЎЁ, еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
(1)иҜҘеҸҚеә”зҡ„еҢ–еӯҰе№іиЎЎеёёж•°иЎЁиҫҫејҸдёәK пјқВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ (2)иҜҘеҸҚеә”дёәВ В В В В В В В В В В еҸҚеә”(йҖүеЎ«еҗёзғӯгҖҒж”ҫзғӯ)гҖӮ (3)жҹҗжё©еәҰдёӢпјҢе№іиЎЎжө“еәҰз¬ҰеҗҲдёӢејҸпјҡc(CO2)В·c(H2)пјқc(CO)В·c(H2O)пјҢиҜ•еҲӨж–ӯжӯӨж—¶зҡ„жё©еәҰдёә В В В В В В В В В В В В KгҖӮ
|
|||||||||||||
| 33. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||
|
еңЁ100в„ғж—¶пјҢдҪ“з§ҜдёҚеҸҳзҡ„еҜҶй—ӯе®№еҷЁдёӯеҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡA(g)
(1)иҫҫеҲ°е№іиЎЎж—¶Aзҡ„иҪ¬еҢ–зҺҮдёә__ _____гҖӮеңЁжӯӨжқЎд»¶дёӢпјҢе№іиЎЎеёёж•°пј«дёәгҖҖгҖҖгҖҖВ гҖҖгҖӮ (2)еңЁ0пҪһ60sж—¶й—ҙж®өеҶ…пјҢAзҡ„е№іеқҮеҸҚеә”йҖҹзҺҮдёә____ __В В В В В В В __гҖӮ (3)иҰҒдҪҝе№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁпјҢеҸҜйҮҮеҸ–зҡ„жҺӘж–ҪгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖпјҲеЎ«еәҸеҸ·пјүгҖӮ AгҖҒдҪ“з§ҜдёҚеҸҳжҳҜеўһеӨ§зҡ„Aиө·е§Ӣжө“еәҰВ В В В BгҖҒеҚҮй«ҳжё©еәҰ CгҖҒдҪҝз”ЁеӮ¬еҢ–еүӮ В В В В В В В В В В В В В В В В В В В DгҖҒзј©е°Ҹе®№еҷЁдҪ“з§Ҝ
|
||||||||||||||||||||||
| 34. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёҖе®ҡжқЎд»¶дёӢпјҢдәҢж°§еҢ–зЎ«е’Ңж°§ж°”еҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡ
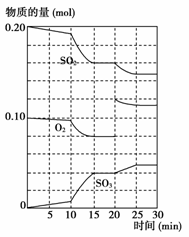
(1)йҷҚдҪҺжё©еәҰпјҢиҜҘеҸҚеә”KеҖј______пјҢдәҢж°§еҢ–зЎ«иҪ¬еҢ–зҺҮ______гҖӮ(д»ҘдёҠеқҮеЎ«вҖңеўһеӨ§вҖқвҖңеҮҸе°ҸвҖқжҲ–вҖңдёҚеҸҳвҖқ) (2) (3)600 в„ғж—¶пјҢеңЁдёҖеҜҶй—ӯе®№еҷЁдёӯпјҢе°ҶдәҢж°§еҢ–зЎ«е’Ңж°§ж°”ж··еҗҲпјҢеҸҚеә”иҝҮзЁӢдёӯSO2гҖҒO2гҖҒSO3зү©иҙЁзҡ„йҮҸеҸҳеҢ–еҰӮеӣҫжүҖзӨәпјҢеҸҚеә”еӨ„дәҺе№іиЎЎзҠ¶жҖҒзҡ„ж—¶й—ҙжҳҜ______В В В В В В В В В В В В В __гҖӮ (3)жҚ®дёҠеӣҫеҲӨж–ӯпјҢеҸҚеә”иҝӣиЎҢиҮі20 minж—¶пјҢжӣІзәҝеҸ‘з”ҹеҸҳеҢ–зҡ„еҺҹеӣ жҳҜ________________ __________________________(з”Ёж–Үеӯ—иЎЁиҫҫ)гҖӮ (4)еҸҜз”ЁдёҠиҝ°еҸҚеә”дёӯжҹҗз§Қзү©зҗҶйҮҸжқҘиҜҙжҳҺиҜҘеҸҚеә”е·ІиҫҫеҲ°е№іиЎЎзҠ¶жҖҒзҡ„жҳҜгҖҖгҖҖгҖҖгҖҖ гҖҖгҖҖгҖӮВ A .SO2зҡ„з”ҹжҲҗйҖҹзҺҮдёҺSO3зҡ„з”ҹжҲҗйҖҹзҺҮзӣёзӯү B. ж¶ҲиҖ—a mol SO2зҡ„еҗҢж—¶з”ҹжҲҗa mol SO3 C. еҗ„з»„еҲҶжө“еәҰдёҚеңЁеҸ‘з”ҹеҸҳеҢ– D.жҒ’е®№дҪ“зі»дёӯеҺӢејәдёҚеҶҚеҸ‘з”ҹеҸҳеҢ– E. жҒ’е®№дҪ“зі»дёӯж°”дҪ“еҜҶеәҰдёҚеҶҚеҸҳеҢ– F. О”HдёҚеҶҚеҸ‘з”ҹеҸҳеҢ– GпјҺ е®№еҷЁйҮҢSO2гҖҒO2гҖҒSO3зҡ„жө“еәҰжҜ”жҳҜ2:1:2
|
|
- еҫ·е·һеёӮй«ҳдёҖеҢ–еӯҰжңҹдёӯиҖғиҜ•пјҲ2019е№ҙдёӢеҶҢпјүе®Ңж•ҙиҜ•еҚ·
- й»‘йҫҷжұҹ2018е№ҙй«ҳдәҢеҢ–еӯҰдёҠеҚҠжңҹжңҹдёӯиҖғиҜ•зҪ‘дёҠеңЁзәҝеҒҡйўҳ
- еҗүжһ—й«ҳдәҢеҢ–еӯҰжңҹдёӯиҖғиҜ•пјҲ2019е№ҙдёҠеҚҠе№ҙпјүе®Ңж•ҙиҜ•еҚ·
- дёғж ЎиҒ”зӣҹ2019е№ҙй«ҳдёҖеҢ–еӯҰдёҠеҚҠжңҹжңҹдёӯиҖғиҜ•зҪ‘з»ңиҖғиҜ•иҜ•еҚ·
- дёғж ЎиҒ”зӣҹй«ҳдәҢеҢ–еӯҰ2018е№ҙдёҠеҚҠжңҹжңҹдёӯиҖғиҜ•зҪ‘дёҠиҖғиҜ•з»ғд№
- 2018-2019е№ҙй«ҳдәҢдёӢеҶҢ第дәҢж¬ЎжңҲиҖғеҢ–еӯҰиҖғиҜ•пјҲе®үеҫҪзңҒе…ӯе®үеёӮиҲ’еҹҺдёӯеӯҰпјү
- ж№–еҢ—2018е№ҙй«ҳдёҖдёҠеҚҠе№ҙеҢ–еӯҰжңҹдёӯиҖғиҜ•е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- жҪ®е·һеёӮй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•жЁЎжӢҹиҖғиҜ•з»ғд№